接种地衣芽孢杆菌发酵的普洱茶品质与微生物群落分析
刘琨毅, 王利妍, 安江珊, 王兴华, 罗 慧,范家坤, 陈立佼, 马 燕, 赵 明,2,*
(1.云南农业大学 茶学院/食品科学技术学院, 云南 昆明 650201;2.云南农业大学 云南省药用植物生物学重点实验室/西南中药材种质创新与利用国家地方联合工程研究中心, 云南 昆明 650201;3.宜宾职业技术学院 五粮液技术与食品工程学院, 四川 宜宾 644003;4.普洱市茶叶科学研究所, 云南 普洱 665000)
云南普洱茶是国家地理标志保护产品,具有抗高脂血症、抗氧化等多种保健功能[1-3],深受消费者喜爱。2020年总产量约15.60万t,其公用品牌价值70.35亿元[4]。普洱茶生产过程主要依靠环境中的微生物发酵茶叶[5-6],适宜在其中生长繁殖的微生物会产生多种酶类,而这些酶类有助于普洱茶形成独特的品质[7]。就目前实际情况看,传统普洱茶生产处于开放的环境中,往往存在微生物来源复杂、不可控等问题,从而导致产品质量不稳定[8],因此,亟须对传统普洱茶发酵工艺进行改进。
强化发酵是将一种或多种外源微生物接入到未经灭菌的原料中进行发酵,以期提高发酵产品的品质[9]。例如乳酸菌和酵母菌强化发酵四川泡菜可以明显提高总酸、总酯含量,从而改善产品风味[10];接种酵母菌强化发酵酱油,可增加风味物质数量,改善感官品质[11]。目前,已有研究发现接菌强化发酵可缩短普洱茶加工时间,降低成本,提高茶叶感官品质[12],但对茶叶微生物群落和最终产品化学成分及感官特性的影响却鲜有研究。
地衣芽孢杆菌(Bacilluslicheniformis)是一种能产淀粉酶、蛋白酶、木聚糖酶、葡聚糖酶、纤维素酶以及地衣素等令人愉悦的风味物质的细菌,在传统发酵食品,如郫县豆瓣[13]、酱香型白酒[14]、普洱茶[15-16]的生产过程中均起到积极作用[17]。王鹏[18]利用地衣芽孢杆菌强化发酵浓香型白酒显著提高了其感官品质。本团队前期研究[6]发现,地衣芽孢杆菌是普洱茶发酵过程中的优势细菌,在普洱茶品质形成过程中有可能具有重要作用,有望用于普洱茶的强化发酵。作为一种在普洱茶发酵中存在的微生物,地衣芽孢杆菌进行的普洱茶强化发酵是否能够影响发酵过程中的微生物群落,进而改善普洱茶的品质特征,需要进一步研究。本研究将从普洱茶中分离鉴定得到的地衣芽孢杆菌接种于灭菌或未灭菌的晒青茶(RM)中,进行纯菌发酵(pure fermentation,PF)和强化发酵(enhanced fermentation,EF)普洱茶,分析发酵样品的感官特征、化学成分及微生物群落结构,以期评估该菌用于普洱茶强化接菌发酵的可行性,为提高普洱茶品质提供实验依据。
1 材料与方法
1.1 材料与试剂
晒青茶(一芽三叶),云南省普洱市茶叶科学研究所;儿茶素[(+)-catechin,C]、没食子酸(gallic acid,GA)、表儿茶素[(-)-epicatechin,EC]、表没食子儿茶素[(-)-epigallocatechin,EGC]、表儿茶素没食子酸酯[(-)-epicatechin-3-gallate,ECG]、表没食子儿茶素没食子酸酯[(-)-epigallocatechin-3-gallate,EGCG]、没食子儿茶素[(-)-gallocatechin,GC]、儿茶素没食子酸酯[(-)-catechin gallate,CG]、没食子儿茶素没食子酸酯[(-)-gallocatechin gallate,GCG]、鞣花酸(ellagic acid,EA)、咖啡碱(caffeine,CA)、杨梅素(myricetin,MY)、槲皮素(quercetin,QU)、木犀草素(luteolin,LU)、山柰酚(kaempferol,KA)等物质的标准品(纯度均大于98.00%),成都曼思特生物科技有限公司;真菌DNA提取试剂盒、细菌DNA提取试剂盒,生工生物工程(上海)股份有限公司;牛肉膏蛋白胨培养基,青岛海博生物技术有限公司;DNA聚合酶(2×Rapid Taq Master Mix),南京诺唯赞生物科技公司;DNA分子量标准试剂、DNA染料,上海捷瑞生物工程公司。实验所用试剂均为国产分析纯。所有DNA引物由北京擎科生物科技有限公司昆明分公司合成。
1.2 仪器与设备
HH- S28S型数显恒温水浴锅,常州市金坛大地自动化仪器厂;756CRT型紫外可见分光光度计,上海菁华科技仪器有限公司;CP214型电子分析天平,上海奥豪斯仪器有限公司;CT15RE型离心机,日本日立公司;SW- CJ- 1B型超净工作台,苏州安泰空气技术有限公司;LRHS- 250- Ⅱ型生化培养箱,上海跃进医疗器械有限公司;1200型高速液相色谱[配有TSKgel ODS- 80TM色谱柱(4.6 mm×250 mm,5 μm)],美国安捷伦公司;Trident 960型基因扩增仪,上海力新仪器有限公司;DW- 86L626型医用低温保存箱,青岛海尔生物医疗股份有限公司;YS6060型色差仪,深圳市三恩时科技有限公司;血球计数板,上海求精生化试剂仪器有限公司。
1.3 实验方法
1.3.1地衣芽孢杆菌L1的分离鉴定
对从普洱茶中分离纯化得到的菌株进行形态学观察及16S rRNA基因序列测序分析[19],并利用16S rRNA基因序列进行系统发育分析,明确菌株的系统分类学地位,命名为地衣芽孢杆菌L1。
1.3.2地衣芽孢杆菌L1菌悬液的制备
将分离鉴定得到的地衣芽孢杆菌L1接种于牛肉膏蛋白胨液体培养基中,37 ℃振荡培养48 h。计数后用适量无菌生理盐水稀释成1×107个/mL的细胞菌悬液,将1%细胞菌悬液接种到茶叶培养基中,37 ℃、120 r/min振荡培养4 d。茶叶培养基是用2 L蒸馏水在100 ℃条件下提取100 g晒青茶30 min,4层纱布过滤后,121 ℃灭菌20 min制成。
1.3.3地衣芽孢杆菌L1纯菌发酵普洱茶实验
称取100 g晒青茶置于500 mL三角瓶中,加入40 mL蒸馏水,湿热灭菌(121 ℃,20 min),冷却后待用。将1 mL地衣芽孢杆菌L1的菌悬液(含1×107个细胞)接种于灭菌茶样中,37 ℃、相对湿度60%的培养箱中发酵20 d,为PF组。将PF组样品分为2份,一份用于感官审评,另一份-80 ℃贮藏用于化学成分测定及微生物分析。将灭菌茶样不接菌进行相同操作为对照组(CK)。每组样品进行3次重复实验。
1.3.4地衣芽孢杆菌L1强化发酵普洱茶实验
称取晒青茶25 kg装入发酵筐,加入10 L蒸馏水和250 mL地衣芽孢杆菌L1的菌悬液(含1×107个细胞)搅拌混匀后,进行发酵。每隔5 d翻堆一次,25 d后发酵完成。在每次翻堆前,采用五点取样法取样,分别命名为EF1~EF5。每次取样后将样品分为2份,一份用于感官审评,另一份-80 ℃贮藏用于化学成分测定及微生物分析。将每一翻自然发酵(normal fermentation,NF)的样品(未接入地衣芽孢杆菌L1)命名为NF1~NF5,取样方法和强化发酵一致。每组样品进行3次重复实验。
1.3.5茶叶化学成分测定及感官审评
参考Zhao等[5]分析茶叶特征成分的方法,分别采用恒重法、酒石酸亚铁法、茚三酮比色法、蒽酮法测定茶叶样品水浸出物(water extracts,WE)、茶多酚(tea polyphenols,TP)、游离氨基酸(free amino acids,FAA)、可溶性糖(soluble sugars,SS)的质量分数;应用萃取比色法[20]检测茶红素(thearubigins,TR)、茶黄素(theaflavins,TF)及茶褐素(theabrownins,TB)质量分数;采用本课题组建立的高效液相色谱法(high performance liquid chromatography,HPLC)[6]定量分析茶叶样品中GA、CA、EA、QU、LU、KA、MY、C、EC、EGC、ECG、EGCG、GC、GCG和CG的质量比。9位评茶员根据GB/T 23776—2018《茶叶感官审评方法》[21]对茶叶样品的感官品质进行审评;其中,采用定量描述分析法[22]对茶汤滋味特征进行评价,包括苦味、涩味、酸味、甜味和厚重感5个属性,分数从0(无)到9(非常强烈)。同时用YS6060型色差仪对茶汤的颜色进行测定,a*值为红绿色,b*值为黄蓝色,L*值为明暗度。
1.3.6基于高通量测序的微生物多样性分析
采用细菌DNA提取试剂盒、真菌DNA提取试剂盒分别提取接种发酵普洱茶样品的细菌和真菌DNA,应用DNA聚合酶(2×Rapid Taq Master Mix)进行聚合酶链式反应(polymerase chain reaction,PCR)。其中,利用引物338F和806R扩增细菌16S rRNA基因的V3~V4区;以引物ITS1和ITS4扩增真菌ITS1区域。委托深圳微生态公司,应用Illumina MiSeq测序平台对PCR产物进行基因测序[15]。通过QIIME软件检查并剔除嵌合体序列等疑问序列,选择序列比对工具对获得的序列按97%的相似度进行聚类和OTU划分,绘制稀疏曲线,计算α多样性指数,评估每个样本的多样性水平[23]。
1.4 数据处理
应用IBM SPSS Statistics 22.0软件进行数据处理和统计分析,数值以平均值±标准差表示,统计分析采用LSD方差分析方法,显著性用P<0.05表示;采用TBtools 1.09854对归一化后的数据进行聚类热图的绘制;采用微科盟生科云在线工具(https://www.bioincloud.tech/#/)进行主成分分析(principal component analysis,PCA)和线性判别分析(linear discriminant analysis effect size,LEfSe);基因测序结果已上传至National Center for Biotechnology Information (NCBI)基因数据库,编号为MZ675664和PRJNA691718。
2 结果与分析
2.1 地衣芽孢杆菌L1的分离鉴定结果
将菌株接种到PDA培养基中培养3 d后,菌落形态如图1。菌株菌落呈乳白色凸起,显微形态为长杆状菌体。将菌株测序所得序列与NCBI数据库进行比对,选择模式物种进行建树分析,见图2。结果表明,菌株与006270.3B.licheniformis聚为一支,证明为地衣芽孢杆菌L1(B.licheniformisL1)。
图1 地衣芽孢杆菌L1的菌落形态Fig.1 Colony morphology of B. licheniformis L1

图2 地衣芽孢杆菌L1 DNA序列系统发育树Fig.2 Phylogenetic trees of DNA sequences of B. licheniformis L1
2.2 地衣芽孢杆菌L1纯菌发酵对茶叶品质的影响
地衣芽孢杆菌L1纯菌发酵普洱茶样品与对照(CK)样品进行感官审评,PF组的茶汤呈橙红色,滋味较为醇厚;CK组的茶汤为黄绿色,涩味较为突出。表明地衣芽孢杆菌L1纯菌发酵能改普洱茶感官特征,并与传统普洱茶的感官品质(茶汤呈红褐色,滋味醇厚回甘)相似[24]。采用高效液相色谱法和分光光度法测定了22种茶叶特征成分的含量,见图3。与CK组相比,PF组中TP质量分数和5种儿茶素(C、GCG、EGCG、ECG、CG)质量比显著降低(P<0.05),验证了PF组茶汤苦涩度降低感官评审结果;聚类分析结果也显示TP、EGCG、GCG、CG和ECG聚为一簇,其他17种茶叶特征成分聚为另一簇(图3)。因TB质量分数显著增加(P<0.05),使得PF组茶汤由黄绿色变为橙红色。这些茶叶特征成分的变化也与传统普洱茶发酵过程中物质的变化相似[25],故地衣芽孢杆菌L1对普洱茶的发酵起到积极作用。由于传统普洱茶发酵的原料晒青茶未经灭菌处理,并且是在开放式的环境中进行,因此需要对接种地衣芽孢杆菌的普洱茶强化发酵做进一步研究。
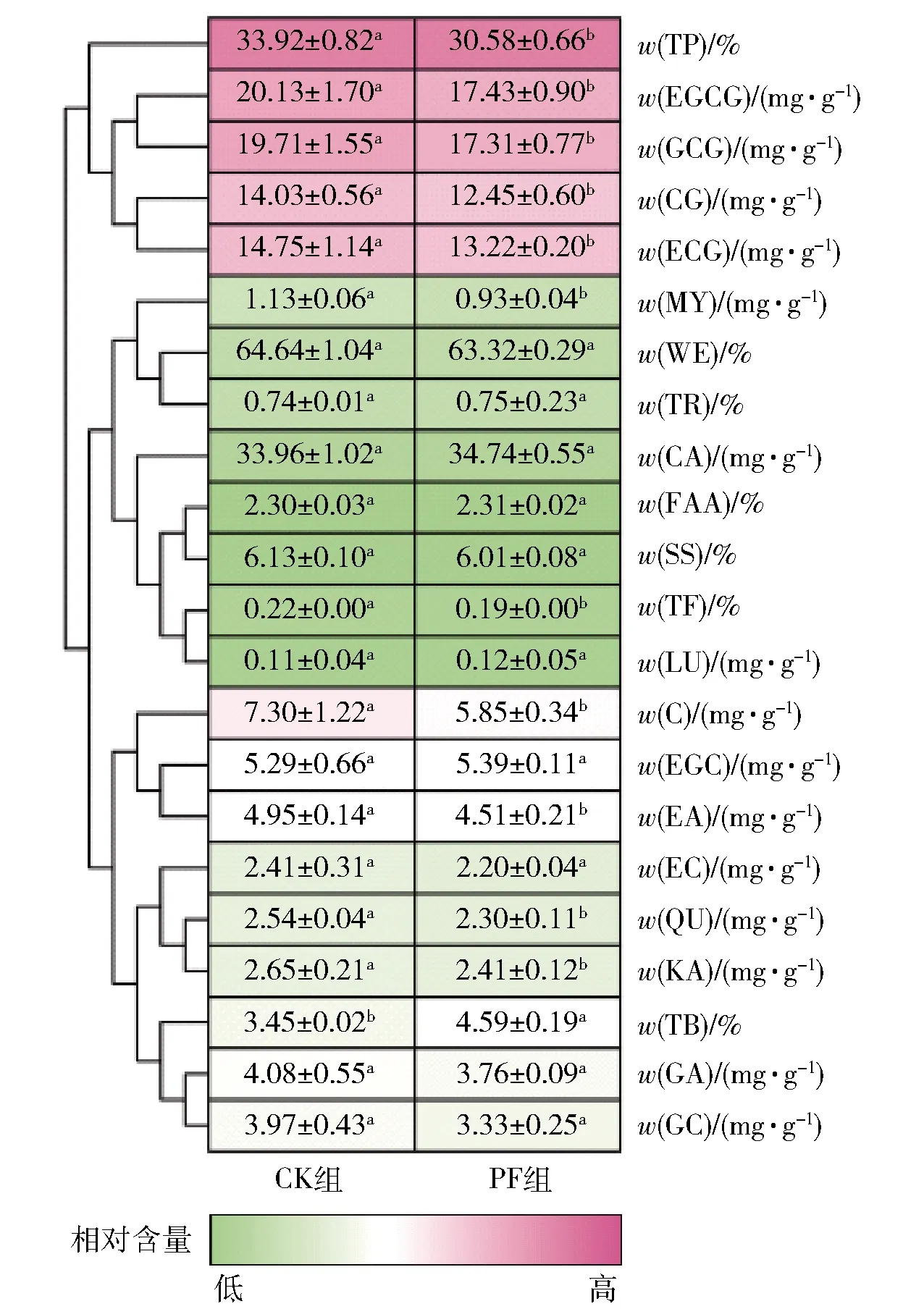
不同小写字母表示同行数据差异显著(P<0.05)。图3 纯菌发酵样品中茶叶特征成分聚类分析Fig.3 Cluster analysis of tea characteristic components in samples of pure fermentation
2.3 地衣芽孢杆菌L1强化发酵对茶叶品质的影响
对自然发酵及强化发酵样品进行感官审评,结果见表1和图4。经NF和EF处理后,茶汤均呈红褐色、滋味回甘、香气纯正,但EF组茶汤颜色更深,滋味更加醇厚,香气带有怡人的陈香。色差仪测定2组茶汤颜色结果见图5。由图5知,EF组的a*值(25.70±0.68)和b*值(77.06±1.07)较高,而L*值(71.58±0.83)较低。9位评茶员审评茶汤的滋味评分见图6。由图6可知,EF组的甜味(3.33±0.78)和厚重感(6.11±0.71)分值较高,而苦味(1.33±0.50)、涩味(0.67±0.50)和酸味(0.33±0.44)分值较低,进一步说明了EF组样品具有更深的红褐色和更愉悦的滋味。
NF组和EF组茶叶特征成分差异见图7。由图7可知,EF组中TB、TR和SS质量分数显著高于NF组(P<0.05),与感官审评EF组具有更深的红褐色和更显著的甜味的结果相符;聚类分析结果也显示TB、TR和SS聚为一类。而EF组的C、CG、EC、GCG、EGCG和EGC质量比显著低于NF组(P<0.05),验证了EF组的苦涩度较NF组更低。因此,地衣芽孢杆菌L1强化发酵可提高普洱茶的感官品质。
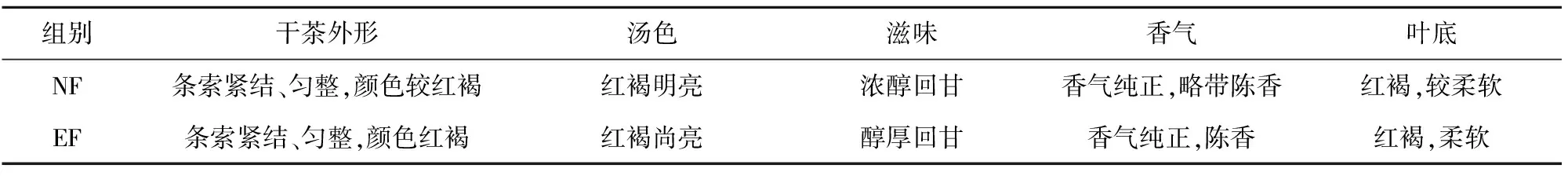
表1 自然发酵与强化发酵样品的感官审评结果Tab.1 Sensory evaluation results of samples of normal and enhanced fermentation
此外,NF组和EF组中GA的质量比相对于CK组显著降低(P<0.05),与吴桢[26]、Zhao等[6]发现GA的含量在发酵结束后升高的结果不符,推测可能与原料和发酵工艺有关。折改梅等[27]的研究显示嫩芽晒青茶(多酚类物质含量较低)生产的普洱茶GA含量在发酵结束后是降低的,表明原料可以影响GA含量。本团队研究发现同一家企业的两款普洱茶,其GA含量相差约4倍[28];另外,本团队前期研究揭示了单宁酶对于茶叶酯型儿茶素的代谢作用,发现GA可被进一步氧化为鞣花酸或被降解,其含量与工艺控制相关[29]。

图4 自然发酵与强化发酵后干茶、茶汤、叶底变化Fig.4 Changes of tea leaves, infusion and infused tea leaves after normal and enhanced fermentation
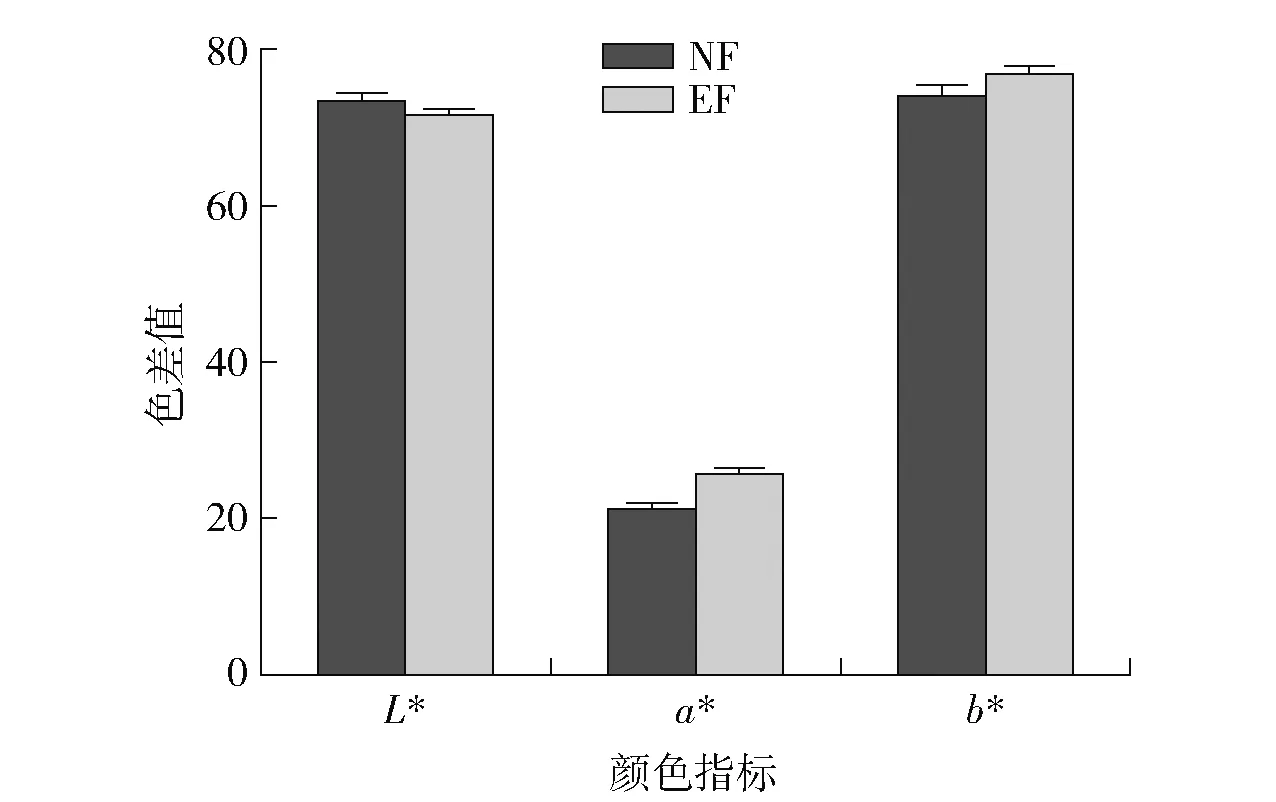
图5 自然发酵与强化发酵样品茶汤的色差值Fig.5 Color difference values of samples infusion of normal and enhanced fermentation
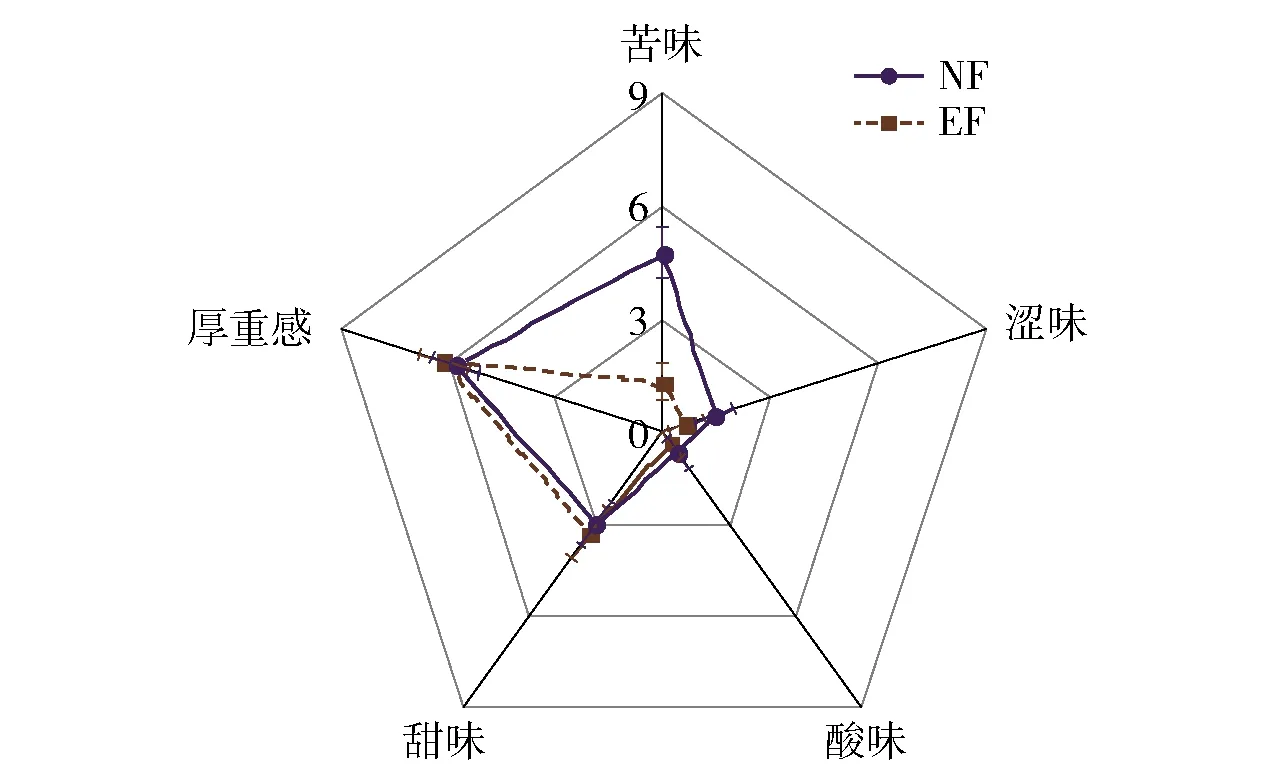
图6 自然发酵与强化发酵样品的滋味评分Fig.6 Taste scores of samples of normal and enhanced fermentation

不同小写字母表示同行数据差异显著(P<0.05)。图7 自然发酵与强化发酵样品中茶叶特征成分的聚类分析Fig.7 Cluster analysis of tea characteristic components in samples of normal and enhanced fermentation
2.4 地衣芽孢杆菌L1强化发酵对微生物群落结构的影响
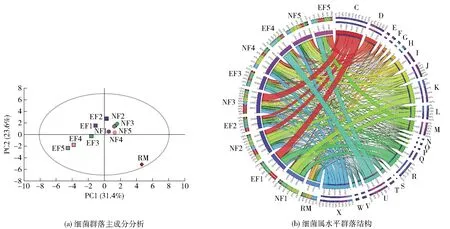
经过QIIME软件检查并剔除嵌合体序列等疑问序列后,得到54 330~103 310个序列,归类为482~1 603个细菌OTUs、503~833个真菌OTUs,结果如表2。由表2可知,随着发酵的进行,EF组中细菌及真菌的丰富度和多样性先显著增加(P<0.05),在发酵中后期(EF3~EF5)又显著下降(P<0.05),与NF组微生物的丰富度和多样性在发酵中后期(NF3~NF5)继续上升形成差异。EF组和NF组的细菌和真菌群落结构分析见图8和图9。由图8(a)和图9(a)可知,在发酵过程中EF组和NF组的微生物群落结构动态变化,且在各个阶段均存在差异,尤其在发酵中后期差异显著。主要原因是发酵过程中化学成分与环境条件(温度、湿度、pH值)的不断变化,以及微生物之间的相互作用(如共生和拮抗作用)[30]。
茶叶样品中细菌属水平群落结构如图8(b),原料晒青茶(RM)的优势细菌主要是肠杆菌(Enterococcus, 20.94%)、金黄杆菌(Chryseobacterium, 16.65%)和假单胞菌(Pseudomonas, 6.90%)。在强化发酵过程中,芽孢杆菌(Bacillus, 25.08%~39.81%)和假单胞菌(17.20%~32.36%)是发酵中前期(EF1、EF2)的优势细菌,随着发酵的继续进行,短状杆菌(Brachybacterium, 14.02%~29.28%)、考克氏菌(Kocuria, 9.52%~26.57%)和葡萄球菌(Staphylococcus, 11.49%~56.59%)共同成为发酵中后期(EF3~EF5)的优势细菌。主要原因是整个发酵过程处于开放状态,环境中的微生物也会进入发酵系统。因此,一些适合在茶叶上生长的微生物会在这种发酵体系中生长并大量繁殖。在传统自然发酵过程中,发酵前期(NF1)的优势细菌主要是埃希氏菌(Escherichia, 32.41%)、克雷白氏菌(Klebsiella, 27.41%)和假单胞菌(24.54%);芽孢杆菌(37.07%)在发酵中期(NF3)成为优势细菌;而在发酵后期(NF5),埃希氏菌(16.46%)再次成为优势细菌。
茶叶样品中真菌种水平群落结构如图9(b),在RM中优势真菌为Brunneoclavisporabambusae(41.50%)、黑曲霉(Aspergillusniger, 21.18%)和马克斯克鲁维酵母(Kluyveromycesmarxianus, 17.27%)。在强化发酵样品中,微小根毛霉(Rhizomucorpusillus, 64.50%)是发酵初期(EF1)的优势真菌,随着发酵进行,食腺嘌呤芽生葡萄孢酵母(Blastobotrysadeninivorans, 12.95%~57.95%)迅速生长繁殖,在发酵中后期(EF3~EF5)与微小根毛霉(12.88%~24.70%)共同成为优势真菌;另外黑曲霉(17.92%~32.73%)在整个发酵阶段均为优势真菌。作为对比,在传统自然发酵过程中黑曲霉始终是优势真菌(26.64%~37.40%);此外,在发酵初期(NF1)的优势真菌还包括马克斯克鲁维酵母(31.28%),随着发酵的进行,微小根毛霉(37.48%~61.22%)迅速繁殖,与黑曲霉共同组成发酵中后期(NF2~NF5)的优势真菌。
茶叶样品微生物群落结构线性判别分析见图10。根据LEfSe分析结果,普洱茶通过发酵降低了原料中金黄杆菌(Chryseobacterium)、土地杆菌(Pedobacter)、Aureimonase、甲基杆菌(Methylobacterium)、根瘤菌(Rhizobium)、鞘氨醇单胞菌(Sphingomonas)、肠杆菌、假柠檬酸杆菌(Pseudocitrobacter)、假单胞菌、克鲁维酵母、Chytridiumolla、Phlyctochytriumaureliae和Gromochytriummamkaevae的相对丰度。尽管在强化发酵的中后期(EF3~EF5),地衣芽孢杆菌L1(0.2%~0.5%)不再是优势细菌,但相对于NF组,茶叶中其他微生物的相对丰度显著变化,短杆菌(Brevibacterium)、食腺嘌呤芽生葡萄孢酵母和Rogersellagriseliniae的相对丰度显著增加(P<0.05),无色杆菌(Achromobacter)、伯克氏菌(Burkholderia)、柠檬酸杆菌(Citrobacter)、欧文氏菌足杆菌(Erwinia)、埃希氏菌、克雷白氏菌和微小根毛霉的相对丰度显著降低(P<0.05)。微生物相对丰度的变化解释了强化发酵样品的茶叶特征成分和感官特征变化的原因。
3 结 论
将地衣芽孢杆菌L1接种于灭菌或未灭菌的晒青茶中,分别进行纯菌发酵与强化发酵。纯菌发酵后茶叶中茶多酚质量分数和5种儿茶素(C、GCG、EGCG、ECG、CG)质量比显著降低(P<0.05),茶褐素质量分数显著增加(P<0.05)。强化发酵后茶褐素、茶红素和可溶性糖质量分数显著高于传统自然发酵(P<0.05),而C、CG、EC、GCG、EGCG和EGC质量比显著降低(P<0.05);茶汤的感官特征随之发生变化,a*值、b*值及甜味和厚重感的感官评分增加,L*值及苦味、涩味和酸味感官评分降低。虽然地衣芽孢杆菌L1在强化发酵中后期不再是优势细菌,但其促使了其他几种主要微生物相对丰度的显著变化(P<0.05),如增加了短杆菌、食腺嘌呤芽生葡萄孢酵母和Rogersellagriseliniae的相对丰度,降低了无色杆菌、伯克氏菌、柠檬酸杆菌、欧文氏菌足杆菌、埃希氏菌、克雷白氏菌和微小根毛霉的相对丰度。因此,接种地衣芽孢杆菌L1进行的强化发酵可通过与其他微生物的协同作用改变普洱茶茶叶的特征成分,从而提高普洱茶的感官品质。

表2 发酵茶叶样品微生物群落的丰富度与α多样性指数Tab.2 Richness and α diversity indexes of microbial communities in fermented tea samples
C:芽孢杆菌(Bacillus),D:短状杆菌(Brachybacterium),E:短杆菌(Brevibacterium),F:伯克氏菌(Burkholderia),G:金黄杆菌(Chryseobacterium),H:肠杆菌(Enterobacter),I:肠球菌(Enterococcus),J:欧文氏菌(Erwinia),K:埃希氏菌(Escherichia),L:克雷白氏菌(Klebsiella),M:考克氏菌(Kocuria),N:甲基杆菌(Methylobacterium),O:微杆菌(Microbacterium),P:苍白杆菌(Ochrobactrum),Q:拟杆菌(Paenibacillus),R:假单胞菌(Pseudomonas),S:罗尔斯顿菌(Ralstonia),T:鞘氨醇杆菌(Sphingobacterium),U:葡萄球菌(Staphylococcus),V:结核杆菌(Tuberibacillus),W:Xylella,X:其他细菌。图8 茶叶样品中细菌群落结构分析Fig.8 Structure analysis of bacterial communities in tea samples

C:微小根毛霉(Rhizomucor pusillus),D:食腺嘌呤芽生葡萄孢酵母(Blastobotrys adeninivorans),E:黑曲霉(Aspergillus niger),F:Brunneoclavispora bambusae,G:马克斯克鲁维酵母(Kluyveromyces marxianus),H:烟曲霉(Aspergillus fumigatus),I:Paraphysoderma sedebokerense,J:疏绵状嗜热丝孢菌(Thermomyces lanuginosus),K:Cyberlindnera sp. RODW5,L:Rogersella griseliniae,M:布兰克假丝酵母(Candida blankii),N:Endogone corticioides,O:Monoblepharis hypogyna,P:Gonapodya polymorpha,Q:阿曲霉(Aspergillus amstelodami),R:其他真菌。图9 茶叶样品中真菌群落结构分析Fig.9 Structure analysis of fungal communities in tea samples
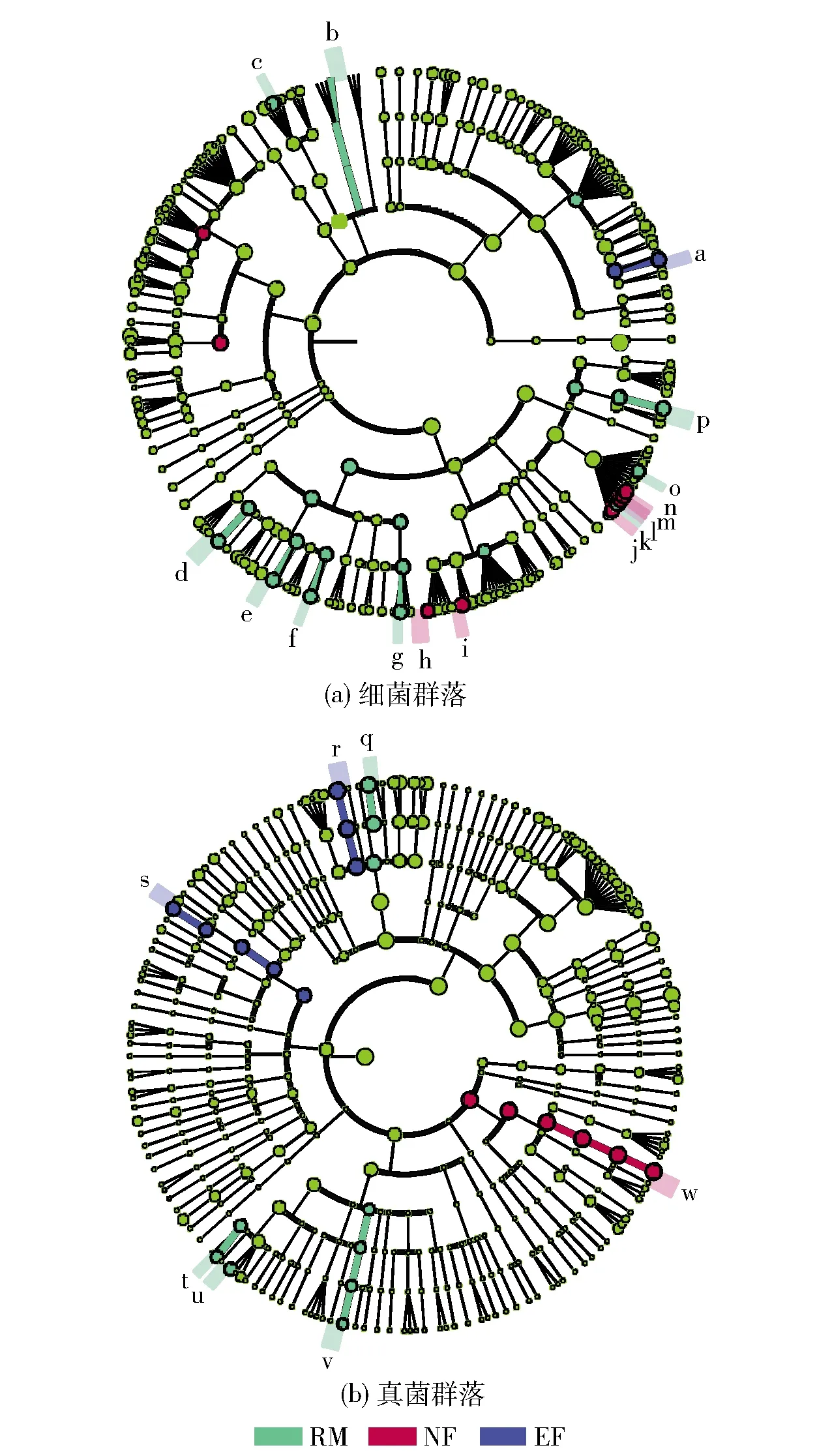
a:短杆菌,b:金黄杆菌,c:土地杆菌(Pedobacter),d:Aureimonase,e:甲基杆菌,f:根瘤菌(Rhizobium),g:鞘氨醇单胞菌(Sphingomonas),h:无色杆菌(Achromobacter),i:伯克氏菌,j:柠檬酸杆菌(Burkholderia),k:肠杆菌,l:欧文氏菌足杆菌(Enterobacter),m:埃希氏菌,n:克雷白氏菌,o:假柠檬酸杆菌(Pseudocitrobacter),p:假单胞菌;q:克鲁维酵母,r:食腺嘌呤芽生葡萄孢酵母,s:Rogersella griseliniae,t:Chytridium olla,u:Phlyctochytrium aureliae,v:Gromochytrium mamkaevae,w:微小根毛霉。图10 茶叶样品中细菌与真菌群落的线性判别分析Fig.10 Linear discriminant analysis of bacterial and fungal communities in tea samples

