丁香酚麻醉斑点叉尾鮰在不同无水保活温度下的生理生化变化
,, , , ,
(1 湖北省农业科学院农产品加工与核农技术研究所,湖北省农产品辐照工程技术研究中心,湖北 武汉 430064;2 四川省原子能研究院辐照保藏四川省重点实验室,四川 成都 610101)
斑点叉尾鮰(Ictaluruspunctatus),叉尾鮰属,是一种温水性淡水鱼类,其肉质鲜美、易养殖、抗病能力强,是中国淡水养殖和出口的重要品种之一,拥有广阔的国内外市场,2016年全国总产量达28.58万t,并逐年稳步上升[1]。中国90%以上的水产品以鲜销为主,通常由于养殖区域与销售市场距离遥远,保活运输成为水产品鲜销的关键环节[2]。传统活鱼运输技术成本高、鱼体死亡率大、水处理困难[3]。随着消费者对水产品鲜活度的要求越来越高,开发新的水产品保活运输方法, 确保水产品在运输和销售过程中的保活、食用安全,已成为亟待解决的问题[4]。
无水保活是一种新型的活鱼运输方法,具有活鱼运载量大、低污染、低成本、低损耗、质量高的特点,在水产品保活运输中得到越来越多的关注[5-6]。鱼类运输常使用麻醉剂降低鱼类应激反应,减少对鱼的损伤而提高运输质量。丁香酚是一种高效安全、残留期短的麻醉剂,澳大利亚、智利、芬兰、新西兰等多国认为其是合法的水产麻醉剂[4]。丁香酚作为麻醉剂长距离保活运输单色鲷,可以降低其代谢率,减少氨氮排放量[7];经丁香酚麻醉的美洲鲥幼鱼运输应激反应明显低于对照组[8];丁香酚还可以显著缓解海葵鱼和双带双锯鱼的运输应激[9]。斑点叉尾鮰在离水或受应激的状态下,硬鳍会竖起,对其他鱼体及其自身都会造成伤害,其无水保活过程对麻醉及环境温度有较高要求,而丁香酚麻醉斑点叉尾鮰的无水保活运输目前鲜有报道。
本文研究了在无水保活过程中,不同保活温度对斑点叉尾鮰的保活时间、存活率和血液生理生化和鱼肉品质指标的影响;通过对斑点叉尾鮰机体生理生化指标的分析,探索其最佳无水保活工艺技术,从而确定最适宜无水保活条件,明确使用丁香酚对鱼肉营养品质的影响,为实际应用提供理论依据。
1 材料与方法
1.1 材料与设备
中小型斑点叉尾鮰为试验对象,购自嘉鱼三湖渔业有限责任公司,选取的鱼大小规格相近,体格健康,平均体质量(526.23±10.56)g,体长(28.3±3.2)cm。
丁香酚(≥98%)购自Sigma-Aldrich公司;硼酸、硫酸、氢氧化钠、盐酸等试剂均为分析纯,购自上海国药集团化学试剂有限公司。谷草转氨酶试剂盒(100管/96样)、谷丙转氨酶试剂盒(100管/96样)、尿素氮试剂盒(100管/50样)、肌酐试剂盒(100管/50样)均购自南京建成生物工程研究所,在酶标仪及紫外可见分光光度计上进行检测。
Sigma 3k15高速冷冻离心机(美国Sigma 公司);FD5-Serious真空冷冻干燥机(GOLD SIM 仪器公司);LRH-250CL低温生化培养箱(上海一恒科学仪器公司);TA XT Plus质构仪(英国SMSTA公司); HITACH UH5300紫外可见光光度计(日本日立公司);TECAN SPARK酶标仪(瑞士TECAN仪器公司);K9860全自动凯氏定氮仪(济南海能仪器公司)。
1.2 试验设计
将斑点叉尾鮰置于充分曝气的自来水中暂养2 d,水温(18±0.5) ℃,pH(7.6±0.5),暂养期间停食。本试验对斑点叉尾鮰无水保活短途运输条件进行研究,设定保活时间5 h。配置丁香酚溶液质量浓度为60 mg/L,将禁食暂养的斑点叉尾鮰浸浴在丁香酚溶液中麻醉,观察不同阶段试验鱼(指代斑点叉尾鮰,下文同)的状态。麻醉10 min后待试验鱼基本进入深度麻醉状态,将其装入塑料袋中,充入纯氧后密封,置于生化培养箱中于不同温度下模拟无水保活运输。保活5 h后,将休眠中的试验鱼转移至暂养水体中复苏24 h,观察其复苏状态。为研究丁香酚麻醉保活过程中各阶段斑点叉尾鮰的生理生化指标及肌肉营养成分变化情况,分别测定保活前(对照组)、保活5 h后、复苏24 h后(清水中复苏24 h)各指标的变化,设置3个重复,每个重复15条鱼。
1.3 无水保活较佳温度的确定
丁香酚麻醉斑点叉尾鮰无水保活5 h后,以试验鱼存活率为指标,研究其无水保活较佳温度范围。调节生化培养箱温度为0 ℃、2 ℃、4 ℃、6 ℃、8 ℃,每隔30 min观察试验鱼生存状态。若在麻醉≤5 h鱼就苏醒,则直接置于清水中,停止观察。保活5 h后,如果鱼鳃无明显张合,刺激无反应,将鱼置于暂养清水中复苏,记录复苏24 h后存活鱼的数量。存活率计算公式:
S= 100%×A2/A1
(1)
式中:S—存活率;A1—初始鱼条数;A2—清水复苏24 h后存活鱼条数。
1.4 测定指标及方法
1.4.1 血液指标的测定
取血方法 每组鱼采用尾部静脉取血,注入10 mL离心管中,每毫升血液用20U肝素抗凝[10],在4 ℃下静置3 h后,3 000 r/min转速离心10 min,取上层血浆于-20 ℃冰箱中备用[11]。
血液指标测定方法 谷丙转氨酶(ALT)、谷草转氨酶(AST)采用紫外-赖氏法测定,肌酐(CREA)采用紫外-苦味酸法测定,尿素氮(BUN)含量采用紫外-脲酶法测定。以上指标均用南京建成生产的试剂盒测定[12-13]。
1.4.2 肌肉指标的测定
肌肉取样 每组鱼取血后,取其背部肌肉,一部分留待质构测量,一部分用高速绞肉机搅碎并混匀,真空冷冻干燥后粉碎,过40目筛,装在若干独立包装袋中密封于-40 ℃保存备用。
营养成分测定 蛋白质含量采用GB 5009.5—2016[14]中自动凯氏定氮仪法进行测定,脂肪含量采用GB 5009.6—2016[15]中索氏抽提法进行测定,冻干肉粉中水解氨基酸含量参照GB 5009.124—2016[16]中食品中氨基酸的测定法,用氨基酸分析仪(茚三酮柱后衍生离子交换色谱仪)测定。
质构测定 采用TA XT Plus质构仪来测定鱼肉弹性、硬度以及咀嚼性。取鱼背部肌肉,将鱼肉切成20 mm×20 mm×10 mm的方块,使用平底柱形探头P/36R,样品垂直于其厚度方向平放,每次测1个样品,每组样品测定8个平行样,取平均值。测试条件:测试前速率1.0 mm/s,测试速率1.0 mm/s,测试后速率3.0 mm/s,压缩比50%,停留时间间隔5 s。
1.6 数据处理
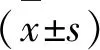
2 结果与分析
2.1 无水保活较佳温度范围的确定
保活温度对斑点叉尾鮰保活时间及存活率的影响见表1。由表1可知,在保活温度为0 ℃、2 ℃、4 ℃、6 ℃时,可以达到无水保活5 h;当保活温度升到8 ℃时,无水保活2 h后试验鱼全部苏醒,放入清水中,停止观察,该组终止试验。当保活温度较低(0 ℃)时,保活5 h后在清水中复苏24 h,试验鱼存活率只有60%;保活温度为2 ℃、4 ℃、6 ℃时,置于清水中复苏24 h后,存活率可以≥80%。结果表明,2 ℃~6 ℃下保活,保活效果较好,完全满足保活5 h且存活率≥80%的要求。当保活温度较低时,水温从18 ℃降至较低温度,温差大,短时间内温度变化大,对鱼体造成强烈瞬间应激,造成鱼体损伤,故在较低温度下(0 ℃)保活5 h后,试验鱼存活率较低。而温度较高时,无水保活过程中周围环境温度较高,鱼体新陈代谢速率较快,且丁香酚属于较易挥发的麻醉剂,高温加快了丁香酚在鱼体内的循环代谢速率,使麻醉剂被很快排出体外,失去麻醉效果,保活时间显著缩短[6]。

表1 不同保活温度对斑点叉尾鮰保活时间和存活率的影响
2.2 丁香酚麻醉保活对斑点叉尾鮰血液生化指标的影响
2.2.1 对谷丙转氨酶的影响
若鱼体肝脏受损,则肝脏中谷丙转氨酶(ALT)会释放到血液中,ALT显著性上升[4,17]。如图1,血液ALT活性在保活5 h后都显著上升(P<0.05)。在0 ℃下,ALT增量最大(105.4%);2 ℃下增量最小(47.82%)。在清水中复苏24 h后,0 ℃和2 ℃保活组恢复至21.53和12.52 U/L,而4 ℃和6 ℃下仍较高。说明在较高温度下保活,肝脏发生不可逆损伤,而低温下的恢复性较好。这可能是由于在丁香酚麻醉斑点叉尾鮰无水保活过程中,试验鱼在保活温度较高时,麻醉不完全,鱼较易苏醒,代谢较强,肝脏受损严重,ALT含量显著上升,且较难恢复。聂小宝等[18]研究不同温度下无水保活鲟鱼,在2 ℃无水保活环境下保存效果最佳,对肝脏损伤最小。

图1 不同温度条件下血液谷丙转氨酶活性变化
2.2.2 对谷草转氨酶的影响
谷草转氨酶活性可以反映鱼体心肌细胞及肝脏受损和代谢程度,是机体组织细胞膜完整性的一个重要标志[19-20]。由图2可知,麻醉保活后,谷草转氨酶(AST)活性升高,且保活温度越高,AST升高越明显,6 ℃组AST增加了44.91 U/L。在清水中复苏24 h后,2 ℃组完全恢复到16.13 U/L,4 ℃、6 ℃组有一定程度的恢复,但0 ℃组持续增加至57.91 U/L。
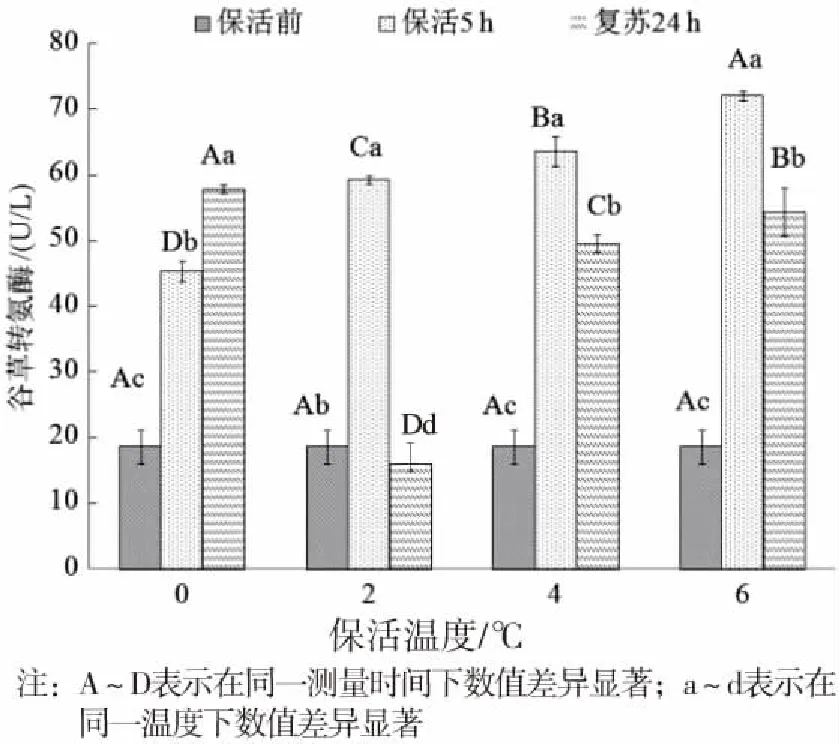
图2 不同温度条件下血液谷草转氨酶活性变化
在丁香酚麻醉保活过程中,保活温度越高,AST活性越大,这可能是由于在较高温下麻醉应激及代谢程度较高,对心肌损伤较大,但随着在清水中的复苏,损伤得到一定程度的恢复。保活温度太低(0 ℃),低温应激对鱼体造成不可逆的损伤,很难恢复。这可能是由于长时间低温无水环境使鱼心肌收缩力加强,心肌细胞代谢加快,负荷超重,受损严重[21-22]。研究发现,鲫鱼无水保活一定时间后,AST显著升高,在清水中会有一定程度复苏[23]。
2.2.3 对肌酐的影响
由图3可见,保活5 h后,肌酐(CREA)含量显著上升(P<0.05),尤其在0 ℃、6 ℃下,分别升高了58.51%和100.8%,复苏24 h后仍高达87.67 μmol/L 和97.17 μmol/L; 2 ℃保活组,肌酐由保活前的66.57 μmol/L升高到保活后的80.89 μmol/L,而清水中复苏24 h后恢复至64.35 μmol/L。斑点叉尾鮰在低温无水条件下保活,肾功能会受到一定程度的损伤,肾脏对肌酐的过滤或排泄功能将弱化,导致肌酐含量显著升高[24],这也是长时间保活会导致鱼体死亡的原因之一[25]。温度是影响其损伤程度的重要因素,较高和较低温度皆不利于斑点叉尾鮰的无水保活。

图3 不同温度条件下血液肌酐含量变化
2.2.4 对尿素氮的影响
尿素(BUN)氮同肌酐类似,是表征肾脏功能的重要指标[26]。由图4可知,麻醉保活5 h后,尿素氮含量显著升高(P<0.05),升高率达40.3%~193%,尤其4 ℃和6 ℃组。不同保活温度下,尿素氮含量差异显著(P<0.05),但变化趋势相同。结合肌酐含量变化趋势,麻醉无水保活过程会对肾脏造成不可逆的损伤,在清水中复苏后也很难恢复。究其原因,在无水保活过程中,鱼体肾功能机能发生障碍,肾脏代谢废物功能受到抑制,血液中代谢产物不能被有效排除到体外,导致尿素氮和氨氮含量升高,引起氨氮中毒,进一步加深损害程度,且这一损伤很难通过鱼体自身调节恢复,使得整个保活及恢复过程中尿素氮都呈现上升趋势[27-28]。
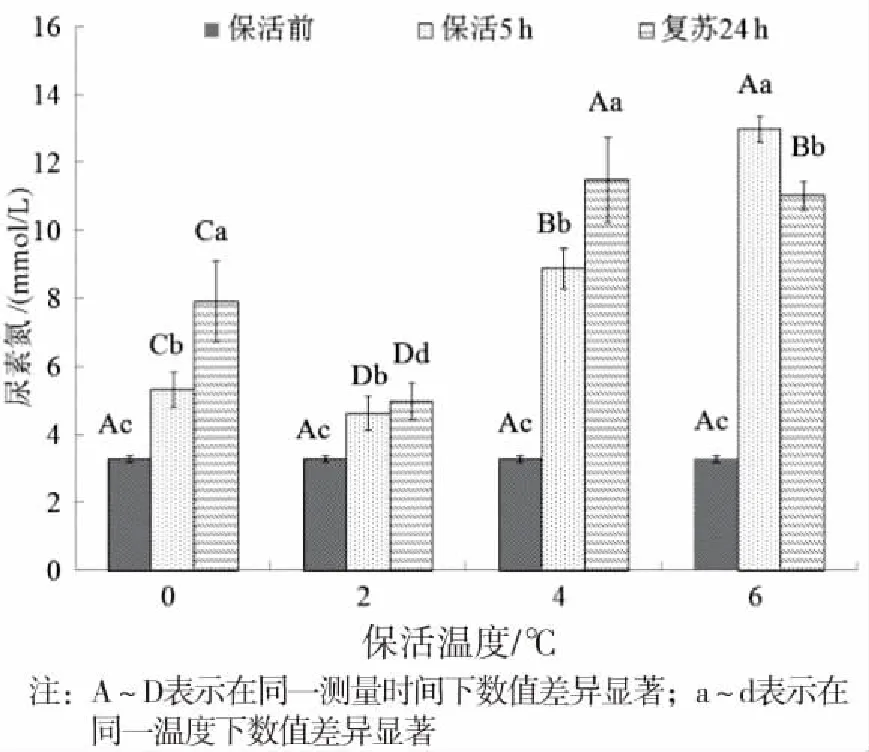
图4 不同温度条件下血液尿素氮活性变化
2.3 丁香酚麻醉保活对斑点叉尾鮰机体营养成分和质构的影响
由表2可知,经过5 h的无水保活,总蛋白含量降低率达0.9%~8.5%,尤其是6 ℃组。粗脂肪含量在无水保活后显著下降(P<0.05),6 ℃组下降了18.98%,而 2 ℃组下降幅度只有3.46%。据推测,造成鱼体蛋白质和脂肪等功能物质含量降低的原因,是由于鱼在无水保活过程中还有一定的能量消耗,在没有外部能量补充的情况下,蛋白质和脂肪作为能源物质被消耗。保活温度较高时,丁香酚麻醉下的鱼体未能进入深度麻醉,代谢旺盛,能量消耗加剧,而温度降低到0 ℃时,由于保活前(18 ℃)到保活的低温环境温差较大,温度骤降,使鱼的应激要强于其他组,鱼体对能量的消耗增加,促进供能物质蛋白质减少[22],而在2 ℃下,温度造成的能量消耗达到最低。
食品的质构特性是体现鱼肉质量的重要指标[29],可以表征无水保活过程对鱼肉在食用口感特性方面的影响。由表2可知,经过5 h无水保活, 0 ℃保活组,硬度、弹性和咀嚼性分别下降21.4%,38.8%,16.4%,在清水中恢复24 h后,分别恢复至保活前的92.4%,58.5%和93.0%。6 ℃保活组质构参数变化趋势最小。究其原因,可能是因为在较低温度下鱼体肌肉活动受限,但维持代谢需要消耗体内供能物质,肌肉蛋白质在不断被降解,肌肉细胞间的结合力在逐渐降低,成分发生变化,造成硬度、弹性和咀嚼性参数下降[29]。研究表明,鱼类在受到应激反应时会导致肌肉组织的软化[30];Hultmann等[31]通过对鳕鱼刺激发现,应激会使硬度值显著减小。

表2 丁香酚麻醉斑点叉尾鮰在不同保活温度下鱼肉品质的变化
注:A-D表示在同一测量时间下数值差异显著;a-c表示在同一温度下数值差异显著
2.4 丁香酚麻醉保活对斑点叉尾鮰机体水解氨基酸含量的影响
由表3可知,水解氨基酸总量在无水保活后低于初始水平,但在2 ℃保活组,人体所需的7种必需氨基酸Lys、Met、Leu、Ile、Thr、Val、Phe值均较保活前大幅度提高,显示斑点叉尾鮰在2 ℃保活有较高的蛋白质营养价值。
表3 丁香酚麻醉斑点叉尾鮰在不同温度下无水保活5 h鱼肉中水解氨基酸含量的变化
曾鹏等[32]研究发现,鲫鱼冰温离水储藏后,必需氨基酸值大幅提高,多种氨基酸水解含量都高于对照组鲜鱼,有利于营养吸收。4 ℃和6 ℃下,各氨基酸成分都有所下降,温度越高,下降幅度越大。在2 ℃下,各必需氨基酸的增加可能与低温保活冷适应后鱼体抗冻能力增加,鱼体为抵御低温和重新适应正常环境体内正常的代谢活动所致[33]。有文献指出[34],生活在极地的鱼类通过产生抗冻糖肽起到降低冰点抗冻的作用,而4 ℃和6 ℃下无水保活,氮基酸含量降低,可能是在此温度下保活,斑点叉尾鮰代谢率较低温(0 ℃、2 ℃)要高,食物蛋白质经过消化吸收获得氨基酸并参与体内代谢,氨基酸为试验鱼基础代谢提供能量物质而消耗。据报道,支链氨基酸可以作为硬骨鱼提供能量代谢的物质,可为低温下活鱼的代谢提供能量[35]。
3 结论
丁香酚麻醉斑点叉尾鮰成功无水保活5 h且存活率≥80%的温度范围为2 ℃~6 ℃;无水保活5 h后,AST、ALT活性均有显著升高,而在清水中复苏24 h后,2 ℃保活组可恢复至对照组值;肌酐和尿素氮在保活5 h后显著增加(P<0.05),对肾脏造成的不可逆的损伤,在6 ℃下影响最大;蛋白质和脂肪等作为能源物质被消耗,保活5 h后显著下降(P<0.05),温度越高,下降越明显;质构指标中,硬度、咀嚼性会显著下降(P<0.05),但在清水中复苏24 h后显著上升(P<0.05),弹性较难恢复;2 ℃下保活时,8种必需氨基酸含量增加。综上表明,2 ℃下保活,丁香酚麻醉斑点叉尾鮰无水保活对鱼肉的生理生化指标影响较小,且基本可以恢复到初始水平,是较适宜的无水保活温度。该研究结果揭示了以丁香酚作为麻醉剂,斑点叉尾鮰无水保活运输过程中不同温度下的生理生化特点,为进一步研究保活过程中斑点叉尾鮰新陈代谢特点提供数据支撑和参考。
□

