青海湖裸鲤放养密度对养殖池塘浮游动物群落结构的影响
,,, ,
(1 青海湖裸鲤救护中心,青海 西宁 810016;2 青海省青海湖裸鲤繁育与保护重点实验室,青海 西宁 810016)
放养密度是影响放养水体生产力的一大要素[1]。高密度的养殖模式可以增加单位水体产量,但由于投饲量过大,造成残饲和养殖动物粪便等有机物大量积累,导致水中耗氧量增加,水体缺氧现象严重。高密度养殖作为一种环境胁迫因子,极易导致养殖生态系统负荷过高,不利于鱼类的生长。浮游动物是重要的次级生产者,是食物链的关键环节,在生态系统结构、功能和生源要素循环中起着重要作用[2]。浮游动物不仅能反映水体生态环境状况[3-4],而且也是一些经济水产动物的主要饵料[3],其种类和数量的变化可以影响到整个生态系统的稳定。目前有学者通过调查浮游生物群落结构的方法对罗非鱼、鳙鱼等养殖水环境进行研究[5-7],但对青藏高原地区养殖池塘以及青海湖裸鲤(Gymnocyprisprzewalskii)养殖中浮游动物群落结构鲜有报道。本试验研究了不同养殖密度下青海湖裸鲤养殖池塘中浮游动物 (轮虫、枝角类、桡足类) 的群落结构,综合反映养殖水体的生态状况,以期为青海湖裸鲤养殖模式的优化和管理供理论依据。
1 材料和方法
1.1 试验材料
试验于2015年7月—2016年7月在青海湖裸鲤救护中心进行,试验选用当年繁殖的青海湖裸鲤鱼苗,初始体长(1.5±0.35)cm、初始体质量(0.03±0.005)g。养殖池选取9个面积均为0.32 hm2(4.8亩)的青海湖裸鲤原种场养殖池塘,用生石灰彻底清塘,晒塘后备用。2015年7月初注水,水深1 m。2015年7月18日、22日分批放养青海湖裸鲤鱼苗。试验设置低、中、高3个密度组,分别放养青海湖裸鲤鱼苗60万尾、80万尾、100万尾,3个密度组各设3个平行。下塘前3 d泼洒豆浆。每月随机选30条鱼为样本,测量其全长、体长、体质量。低密度组池塘编号为D1、D2、D3,中密度组池塘编号为Z1、Z2、Z3,高密度组池塘编号为G1、G2、G3。
1.2 试验方法
试验期间每60~65 d对浮游动物采样1次,共采样7次。采样选择晴天上午10:00进行。水质理化因子于2015年7月鱼苗下塘后至2016年6月底,每隔7 d测量水质理化因子指标一次。使用2.5 L有机玻璃采水器采集浮游动物样品[8],采取各个采样点水样3次共7.5 L ,随后用 25 号浮游生物网浓缩,将过滤样品放入采样瓶中,并加入5%甲醛现场固定[9-11]。
裸鲤鱼苗测量在鱼苗开始于投喂点摄食后,时间为2015年9月—2016年6月,每月对裸鲤采样1次,由于2015年11月底—2016年3月初为青海湖裸鲤池塘的冰封期,未能进行采样。共计采样5次。种类鉴定参照相关文献[12-14]。浮游动物计数采用 1 mL计数框计数,将样品充分摇匀,吸取 1 mL的样品注入计数框,在 10×10 倍的显微镜下全片计数,每个样品一般计数2片,取其平均值,每片大约计数 50~100 个视野。每个标本重复3次取平均值[11-13]。池塘水样釆集地点与浮游动物采样点相同,采集后立即带回实验室进行化学测定。
1.3 数据分析
采用浮游动物优势度指数(Y,Mcnaughton index)和多样性指数多样性指数(H′,Shannon-Weiner)来分析浮游动物的多样性[13-14]。数据采用Excel 2010和SPSS19.0软件处理。
2 结果
2.1 放养密度对青海湖裸鲤生长指标的影响
青海湖裸鲤鱼苗生长情况与养殖密度有关。如图1所示,低密度养殖组2016年6月的全长及体质量明显大于中密度和高密度组,在2016年5月6日至30日的生长增重率也远高于其他两组。2015年10月7日起,低密度组与中、高密度组体质量开始出现显著差异(P<0.05),中、高密度组之间差异不显著(P>0.05)。

图1 不同放养密度条件下青海湖裸鲤全长与体质量的增长情况
2.2 放养密度对水中主要理化因子的影响
如图2所示,试验期间不同放养密度下养殖水体中的溶氧量:低密度>中密度>高密度,在养殖后期各密度养殖池均呈现下降趋势。低密度与中、高密度养殖组水中溶氧量差异显著(P<0.05),但中、高密度组之间溶氧量差异不显著(P>0.05)。水中pH在整个养殖周期内在一定范围内波动,各密度组pH相近,变化趋势相同。各密度组水体中pH均呈显著差异(P<0.05)。水体中各密度养殖水体初期的氨氮质量浓度波动较大,随着养殖时间增加均呈现先下降后回升的趋势。低密度养殖水体与中、高密度水体的氨氮质量浓度差异显著(P<0.05),但中、高密度水体间差异不显著(P>0.05)。低密度养殖水体的氨氮质量浓度差异不明显,而中、高密度的氨氮质量浓度随着时间增加呈增长趋势。磷酸盐质量浓度随放养时间在一定范围内波动,但各组磷酸盐均有下降的趋势,高密度组磷酸盐质量浓度波动较低,中密度组波动较大。各密度养殖水体中磷酸盐质量浓度均呈显著差异(P<0.05)。
2.3 养殖池塘浮游动物群落结构的变化
2.3.1 浮游动物的种类组成及优势种
试验期间共测定出浮游动物38种(表1),其中轮虫24种,枝角类8种,桡足类6种,浮游动物主要是轮虫,其数量加起来占整个浮游动物种类的61.5%。以优势度指数Y≥0.02定位优势种,青海湖裸鲤鱼苗养殖池塘浮游动物的优势种为矩形龟甲轮虫(KeratellavalgaEhrenberg)、角突臂尾轮虫(BrachionusangularisGosse)、刺簇多肢轮虫(PolyarthratriglaEhrenberg)、顶生三肢轮虫(Filiniaterminalis)、萼花臂尾轮虫(BrachionuscalyciflorusPallas)、褶皱臂尾轮虫(BrachionusplicatilisO.F.Müller)、卜氏晶囊轮虫(AsplanchnabrightwelliGosse)、无节幼体(nauplius)、象鼻溞(Bosminia)。经过鉴定,各密度养殖池塘独有动物种类的均值相差不明显。低密度组的浮游动物种类随着时间的增加而增多,中、高密度组在2016年1月至3月期间浮游动物的种类均出现下降(图3)。
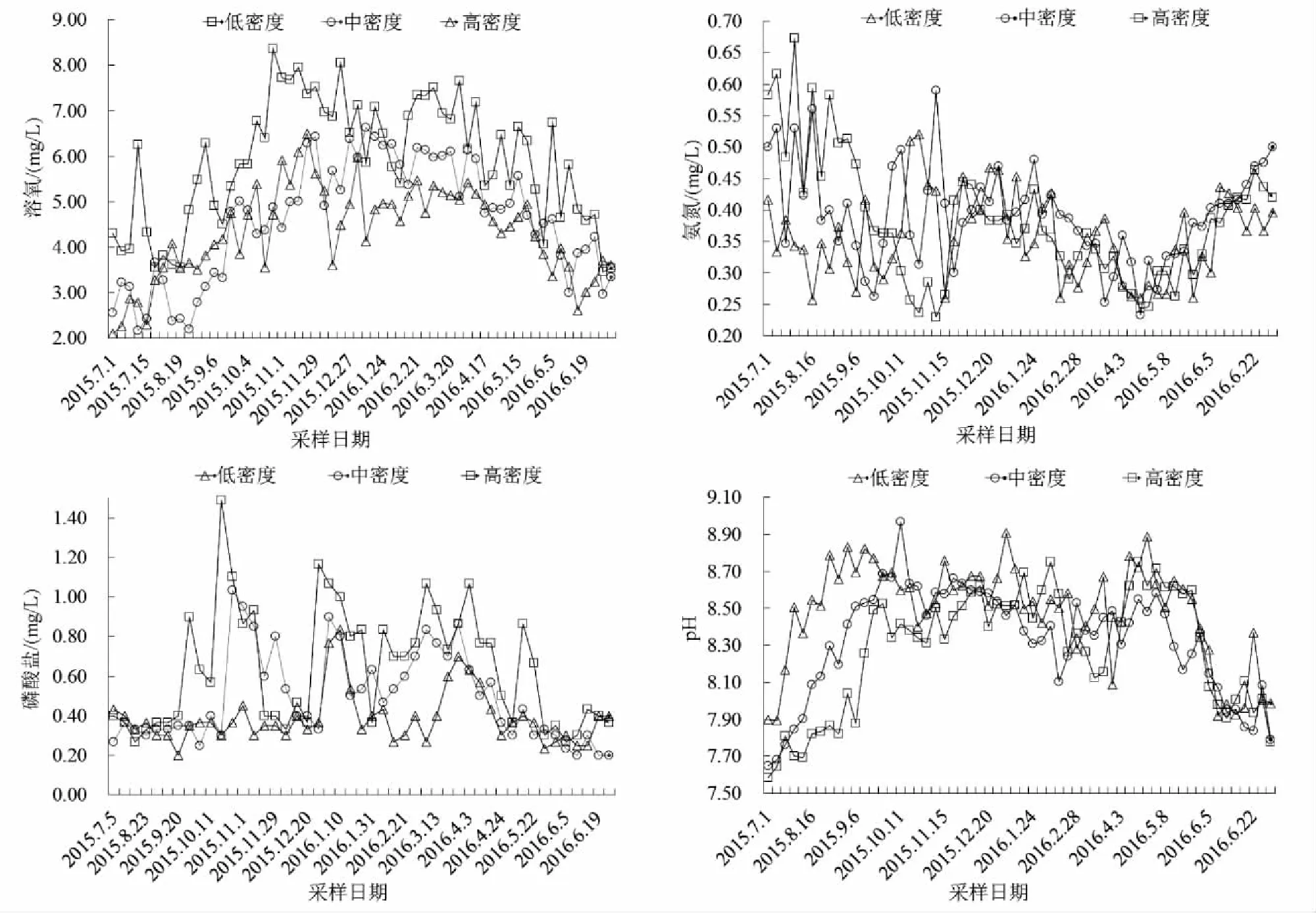
图2 不同放养密度池塘水体的理化因子

分类种类轮虫顶生三肢轮虫(Filinia terminalis)、长三肢轮虫(Filinia longiseta Ehrenberg)、萼花臂尾轮虫(Brachionus calyciflorus Pal-las)、壶状臂尾轮虫(Brachionus urceus Linnaeus)、矩形臂尾轮虫(Brachionus leydigi Cohn)、角突臂尾轮虫(Brachionus an-gularis Gosse)、蒲达臂尾轮虫(Brachionus budapestiensis Daday)、褶皱臂尾轮虫(Brachionus plicatilis O.F.Müller)、刺簇多肢轮虫(Polyarthra trigla Ehrenberg)、舞跃无柄轮虫(Ascomorpha saltans Bartsch)、卜氏晶囊轮虫(Asplanchna brightwelli Gosse)、盖氏晶囊轮虫(Asplanchna girodi de Guerne)、前节晶囊轮虫(Asplanvhna priodonta Gosse )、奇异六腕轮虫(Hexarthra mira )、螺形龟甲轮虫(Keratella cochlearis Ehrenberg)、矩形龟甲轮虫(Keratella quadrata O.F.Müller)、曲腿龟甲轮虫(Keratella valga Ehrenberg)、卵形鞍甲轮虫(Lepadella ovalis Müller )、钝角狭甲轮虫(Colurella obtusa Gosse)、瘤甲腔轮虫(Lacane nodosa Hauer)、大肚鬚足轮虫(Euchlanis dilatata Ehrenberg)、蹄形腔轮虫(Lecane ungulata)、钩状狭甲轮虫(Colurella uncinata O.F.Müller )、棒状水轮虫(Epiphanes clavulatus Ehrenberg)枝角类肋形尖额溞(Alona costata Sars)、方形尖额溞(Alona quadrangularis O.F.Müller)、直额裸腹溞(Moina rectiris Leydig)、蚤状溞(Daphnia pulex Leydig emend,Scourfield )、矩形尖额溞(Alona rectangula Sars)、平突船卵溞(Scapholeberis mucr-onata O.F.Müller)、象鼻溞(Bosmina)、简弧象鼻溞(Bosmina coregoni Baird)桡足类剑水蚤幼体(Nauplii of Cyclops)、大型中镖水蚤(Sinodia ptomus sarsi Rylov)、英勇剑水蚤(Cyvlops strenuus Fischer)、锯缘真剑水蚤(Eucyclops serrulatus Fischer)、湖泊美丽猛水蚤(Nitocra lacustris schmankewitsch)、无节幼体(Nauplii)

图3 低、中、高密度组养殖池塘浮游动物组成变化
2.3.2 浮游动物密度和生物量的变化
低密度组,浮游动物密度58~3 623.4 ind/L,生物量0.22~8.52 mg/L;中密度组,浮游动物密度32~4 124 ind/L,生物量0.14~5.03 mg/L;高密度组,浮游动物密度12.8~4 550 ind/L,生物量在0.04~8.90 mg/L(图4、图5)。

图4 池塘浮游动物密度的变化

图5 浮游动物生物量的变化
随着养殖周期的增长,高密度组相较于其他两组,其浮游动物的密度及生物量最先达到最大值。在2016年1月(冰封期),各密度组的浮游动物密度及生物量均降至最低值,高密度组降幅最大。养殖后期,浮游动物密度及生物量均为高密度组<中密度组<低密度组。
2.3.3 浮游动物多样性的变化
青海湖裸鲤养殖池塘高密度组的多样性指数变化范围0.347~3.144,中密度组0.581~2.698,低密度组1.119~2.730。各组的浮游动物多样性指数呈逐渐下降的趋势(图6)。在试验初期,各组浮游动物多样性在一定范围内上下波动,幅度不大,2015年11月至2016年3月期间,各组池塘浮游动物多样性浮动较小,2016年5月至2016年6月,各组池塘浮游动物的多样性指数骤降。

图6 池塘浮游动物多样性指数的变化
3 讨论
3.1 放养密度对青海湖裸鲤生长的影响
本试验条件下,随着放养密度的降低,青海湖裸鲤的增重率提高,低密度组的终末体质量较其他两组高,而中、高密度组的终末体质量和终末体长差异没有中、低密度组的差异显著(P<0.05)。这表明拥挤胁迫对于裸鲤的生长会产生负面影响。
3.2 放养密度对水中理化因子指标的影响
养殖池塘是一个相对较为封闭的生态系统,随着养殖时间的增加,不同密度养殖组水体中部分理化因子指标差异明显,其中氨氮、磷酸盐的质量浓度与放养密度正相关,溶氧量与放养密度呈负相关,这与刘国玲兴[15]试验结果一致,但相关性均不显著(P>0.05)。
3.3 放养密度对浮游动物种类数的影响
在整个试验周期内,中、高放养密度养殖池内浮游动物种类呈现先下降后回升现象。在试验后期,中、高密度养殖组的浮游动物以轮虫为主。2016年3月以后枝角类和大型桡足类的密度降低,并且出现频率很低,一般认为鱼类对浮游动物的捕食具有选择性,在同等能量消耗下,会优先选择个体较大的种类[16-18]。这也是高密度养殖组浮游动物趋于小型化的原因。
3.4 放养密度对浮游动物密度和生物量的影响
养殖池塘内浮游动物的密度和生物量皆随养殖时间的增加呈现先增多后减少的趋势,低密度组浮游动物的密度和生物量为最高。随着水体富营养化程度的增加,浮游动物的密度和生物量均增加,中小型浮游动物的增长尤为迅速[19-20]。养殖后期,尤其是2016年1月至3月处于冰封期,投喂量减少,浮游动物密度和生物量骤减,养殖密度越高的降幅越大,低密度组浮游动物生物量与中、高密组呈显著性差异(P<0.05),说明青海湖裸鲤鱼苗放养量超过水体承载力的上限,迫于摄食压力,轮虫的生物量也急剧减少。鱼类对浮游动物形成的捕食压力与鱼类的放养密度呈正相关性[21-22]。青海湖裸鲤鱼苗对其养殖池塘的浮游动物存在摄食压力,并且在高养殖密度条件下摄食压力凸显[23]。因此,本试验条件下,低密度放养量最适于浮游动物的生长和繁殖。
3.5 放养密度对浮游动物生物多样性指数的影响
生物多样性指数能够综合反映物种的丰富性。养殖水体中浮游动物的多样性指数越低,物种越单一,对外来变化的缓冲能力越弱。多样性指数越大,对稳定养殖水环境的生态系统具有重要意义[24]。试验初期,浮游动物的多样性指数均差值不大;试验中期,由于处在冰封期,投喂量减少,各养殖密度组浮游动物多样性指数均出现降低的趋势,高密度组的多样性指数降幅最大,这种情况往往由养殖生物的摄食造成[5]。而低密度组池塘的生物多样性指数未受到放养密度的显著影响,高养殖密度引起浮游动物群落结构的稳定性降低[25]。
4 结论
对青海湖裸鲤养殖池塘不同放养密度水体中浮游动物群落结构的影响进行研究。试验期间共测定出浮游动物38种,其中轮虫24种,枝角类8种,桡足类6种。低密度组,浮游动物密度58~3 623.4 ind/L,生物量0.22~8.52 mg/L;中密度组,浮游动物密度32~4 124 ind/L,生物量0.14~5.03 mg/L;高密度组,浮游动物密度12.8~4 550 ind/L,生物量在0.04~8.90 mg/L。低密度组浮游动物的密度和生物量为最高。
养殖水体中氨氮、磷酸盐的质量浓度与放养密度正相关,溶氧量与放养密度呈负相关,相关性均不显著(P>0.05),但低密度组与中、高密度组间差异显著(P<0.05)。
多样性指数的变化范围高密度组0.347~3.144,中密度组0.581~2.698,低密度组1.119~2.730。随着养殖密度的增加,裸鲤鱼苗的体质量增幅降低,低密度组与中、高密度组间呈显著差异(P<0.05);浮游动物的多样性指数降幅增大,提高养殖密度引起浮游动物群落结构的稳定性降低,摄食压力升高,对浮游动物的密度和生物量的增长限制加剧,浮游动物种类减少呈现小型化趋势,不利于养殖水环境的稳定。从环境效益角度分析,低密度养殖更优。
□

