昆虫对CO2 感受机制的研究进展
陈秋燕, 刘 杨, 王桂荣
(中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室, 北京 100193)
二氧化碳(carbon dioxide, CO2)是自然环境中普遍存在的一种无色无味的气体,是空气的重要组分(占大气总体积的0.03%~0.04%),它既是植物光合作用的主要原料之一,也可以作为寄主、天敌释放的化学信号,参与昆虫的觅食(Takken and Knol, 1999; Thometal., 2004; Dekkeretal., 2005)、产卵(Stange, 1999)和躲避天敌(Suhetal., 2004; Faucheretal., 2006)等多种生命活动。此外,CO2还是引起温室效应的主要温室气体之一。自工业革命以来,人类活动向大气中排入的CO2逐年增加,造成了前所未有的全球变暖(曲建翘和吴义梅, 2020)。有研究者预计到2050年,大气中CO2浓度可能会上升到0.55‰(Kanle Satishchandraetal., 2018)。昆虫的嗅觉器官上分布有特定的感器,能够感受环境中极低浓度的CO2。目前,已经在多种昆虫中鉴定到对CO2敏感的嗅觉神经元,并对其电生理功能和超微结构进行了研究(Stange and Stowe, 1999)。近些年来,随着科学技术的不断创新与发展,对昆虫感受CO2机制的研究越来越深入,这些研究主要集中在CO2受体基因的鉴定、CO2在外周神经水平上的传导及CO2在昆虫脑部的加工整合机制等方面。解析昆虫感受CO2的分子和神经机制不仅可以为害虫监测和防治提供新的策略,同时可以为后续的相关研究提供新的思路。本文综述了CO2对昆虫的重要性,CO2信号的传导机制以及CO2受体基因相关的研究进展,以期为昆虫感受CO2的机制研究提供参考。
1 CO2在昆虫生命活动中的重要性
CO2对昆虫的影响可分为两个方面:一方面是直接作用,另一方面是间接作用(吴亚和金翠霞, 1993)。直接作用主要是指昆虫生活的微生境和人为产生的CO2对昆虫行为、生理、代谢和生存的影响,例如:社会性昆虫巢穴内CO2浓度升高引起其扇风行为;植食性昆虫和吸血昆虫以寄主释放的CO2作为觅食和产卵的重要线索;人为使用高浓度CO2改变昆虫的行为活动和生理代谢状态(吴亚和金翠霞, 1993)。间接作用主要是指大气环境CO2浓度升高引起的温室效应及植物代谢的改变,对昆虫产生的广泛影响(吴亚和金翠霞, 1993),例如:提高寄主植物生长环境中的CO2浓度,棉铃虫Helicoverpaarmigera幼虫取食和成虫繁殖都会受到影响(Wuetal., 2006; Chenetal., 2007);大气CO2浓度升高会降低亚洲玉米螟Ostriniafurnacalis幼虫成活率,并且延长亚洲玉米螟幼虫和蛹的发育历期(赵磊等, 2015);大气环境中CO2浓度增加,温室效应明显,会影响蝗虫的形态和番茄潜麦蛾Tutaabsoluta的生长发育(沙威等, 2016; Kanle Satishchandraetal., 2018)。在大气环境CO2浓度逐年升高的背景下,有关CO2对昆虫的间接作用范围较广,因此本文中我们主要关注CO2对昆虫的直接影响。
1.1 CO2在昆虫觅食行为中的作用
CO2在双翅目昆虫蝇类和蚊类的觅食行为中都起着重要作用。传播昏睡症的舌蝇Glossinapaltidipes以CO2为重要线索进行寄主搜寻,此外,有研究发现将CO2与寄主释放的丙酮或辛烯醇混合时能显著增加对舌蝇的吸引效果(Torr, 1990)。黑腹果蝇Drosophilamelanogaster受到胁迫时会释放一种气体混合物Drosophilastress odorant (dSO),dSO能够引起同种黑腹果蝇强烈的逃避反应(Suhetal., 2004)。CO2是dSO的重要组分,当CO2单独存在时,其浓度低至0.1%就能够引起黑腹果蝇强烈的逃避反应(Suhetal., 2004)。但随后研究者发现黑腹果蝇对CO2的行为反应还取决于周围的气体环境(Faucheretal., 2006)。研究发现,发酵和过熟的水果能释放较高浓度的CO2,但却对黑腹果蝇具有吸引作用,这是因为发酵和过熟的水果能释放较高浓度的正己醇和2,3-丁二酮等物质,它们能够抑制黑腹果蝇感受CO2的神经元的活性,进而改变黑腹果蝇对CO2的行为反应(Turner and Ray, 2009)。有报道发现在风洞实验中高浓度CO2对黑腹果蝇有吸引作用,而这一吸引作用与黑腹果蝇自身状态相关,例如进行饥饿处理的黑腹果蝇对CO2会更敏感,能够被CO2吸引(van Breugeletal., 2018)。CO2在蚊类觅食中的重要性很早就有报道(Gillies, 1980; Bowen, 1991; Takken and Knols, 1999),因为脊椎动物呼出的CO2可以帮助吸血昆虫定位寄主(Gillies, 1980; Eiras and Jepson, 1991; Gibson and Torr, 1999; Lehane, 2005)。此外,左乳酸、氨、辛烯醇、羧酸和壬醛等寄主气味能够增强CO2对蚊子的吸引力,而这些寄主气味单独使用时对蚊子的引诱力较差(Smallegange and Takken, 2010)。
除双翅目昆虫外,CO2在很多鞘翅目昆虫幼虫、鳞翅目昆虫幼虫和成虫的觅食中也发挥着重要作用。CO2是鞘翅目玉米根萤叶甲Diabroticavirgifera幼虫定位腐烂玉米根的主要线索(Bernklau and Bjostag, 1998)。鳞翅目的棉铃虫幼虫偏好选择CO2含量高的食物资源(Rasch and Rembold, 1994)。南美玉米苗斑螟Elasmopalpuslignosellus幼虫在寻找食物资源的过程中同样能被CO2吸引(Huang and Mack, 2001)。很多鳞翅目昆虫喜欢取食花蜜,研究者猜想花朵中含有较高浓度的CO2,而访花昆虫以CO2为觅食信号定位富含花蜜的花朵(Hewetal., 1978; Seymouretal., 2003)。Guerenstein等(2004b)证实了曼陀罗花朵的花蜜含量和CO2的释放量呈正相关,并且烟草天蛾Manducasexta授粉的概率也与这两者呈正相关。此外,有报道证实烟草天蛾会偏好取食释放较高浓度CO2的曼陀罗花朵(Thometal., 2004)。
1.2 CO2在昆虫产卵行为中的作用
目前已有大量报道直接或间接地证明CO2能够影响昆虫的产卵行为(Guerenstein and Hildebrand, 2008)。昆士兰实蝇Bactroceratryoni通常将卵产到水果表面的病变处,因为这些病变处会释放包括CO2在内的挥发性化合物,但是在无病变处单独释放CO2时也能吸引怀卵雌蝇在上面产卵(Stange, 1999)。这表明CO2很可能是吸引昆士兰实蝇产卵的信号源。此外,夜行性蛾类仙人掌螟蛾Cactoblastiscactorum的产卵行为也受到CO2的影响(Stangeetal., 1995; Guerenstein and Hildebrand, 2008)。当提高仙人掌螟蛾寄主缩刺仙人掌Opuntiastricta生存环境中的CO2浓度时,仙人掌螟蛾在仙人掌上的产卵量显著降低,可能是环境中CO2浓度的升高降低了仙人掌螟蛾感受到寄主植物释放CO2信号的概率,这也说明了CO2信号在仙人掌螟蛾产卵行为中的重要作用(Stange, 1997)。在烟草天蛾中的研究同样证明了寄主植物周围环境中CO2浓度的升高会减少其雌蛾的产卵量(Abrelletal., 2005)。
1.3 CO2在昆虫其他行为中的作用
CO2除了影响昆虫的取食和产卵行为以外,也会影响昆虫的其他行为。研究发现,CO2也是社会性昆虫调节巢穴内气候条件的重要指标。当巢穴内CO2浓度过高时,西方蜜蜂Apismellifera会通过振翅扇风将多余的CO2等气体排出巢穴外(Seeley, 1974; Southwick and Moritz, 1987)。所以蜜蜂的扇风行为与巢穴内CO2的浓度相关,蜜蜂数量多的蜂巢能将CO2浓度控制在4.4‰的平均水平下(Seeley, 1974; Guerenstein and Hildebrand, 2008)。欧洲熊蜂Bombusterrestris也可通过扇风行为控制巢穴内的气候条件,并且扇风的熊蜂数量会随着CO2浓度的增加而增加,当巢穴内CO2浓度达到16‰时,具有扇风行为的熊蜂数量能增加到120头(Weidenmülleretal., 2002; Weidenmüller, 2004)。芭切叶蚁Attavollenweideri可以通过调节巢穴通风口的形状来保证巢穴内的CO2浓度低于28‰(Kleineidam and Roces, 2000; Kleineidametal., 2001)。
此外,高浓度CO2会影响棉铃虫对性信息素的感受(Choietal., 2018):将棉铃虫在CO2浓度较高的环境中连续饲养3代后,利用风洞行为学试验测试雄性棉铃虫对性信息素的行为反应,结果发现与正常环境下饲养的棉铃虫相比,高浓度CO2环境下的雄性棉铃虫对性信息的反应明显减弱。
2 昆虫在外周神经水平上感受CO2机制的研究进展
2.1 昆虫的CO2受体神经元
不同昆虫感受CO2的器官不完全相同,例如果蝇主要通过触角感受CO2,蚊子感受CO2的器官是下颚须,而鳞翅目昆虫感受CO2的器官是下唇须。在这些器官中均存在高度灵敏的CO2受体神经元,研究者通过电生理记录结合超微结构观察对这些受体神经元进行了功能验证(Stange and Stowe, 1999)。典型的CO2受体神经元位于薄壁的感器中,有薄片状结构或者分支的树突(Stange and Stowe, 1999; Kleineidametal., 2000; Zhaoetal., 2013)。
在以果蝇和蚊类为代表的双翅目昆虫中,有关感受CO2的受体神经元的研究较为透彻。果蝇感受CO2的感器位于触角上(de Bruyneetal., 2001)。果蝇触角上的感器可分为锥形感器(sensilla basiconica)、毛形感器(sensilla trichoid)和腔锥形感器(sensilla coeloconica)(Venkatesh and Singh, 1984),其中锥形感器数量最多。根据感器大小,锥形感器又可分为大锥形感器和小锥形感器(de Bruyneetal., 2001)。通过感器的电生理功能鉴定,大锥形感器分为antennal basiconic 1(ab1), ab2和ab3 3类,每个ab1感器中包含4个受体神经元,分别为ab1A, ab1B, ab1C和ab1D,其中ab1C特异性感受CO2,其他3种受体神经元则对不同的气味有反应(de Bruyneetal., 2001)。与果蝇不同,蚊子的CO2受体神经元位于下颚须上(Grantetal., 1995; Grant and O'Connell, 2007)。尽管不同种类蚊子的下颚须形态和感器分布有差异(例如:冈比亚按蚊Anophelesgambiae下颚须有5节,第2-4节分布有单一类型的感器;致倦库蚊Culexquinquefasciatus下颚须有4节,第2-4节分布有两种类型的感器),但都存在乳突状感器(capitate peg, cp),也称作棒状锥形感器(club-shaped olfactory basiconic sensilla),每个乳突状感器中有3类神经元,分别为cpA, cpB和cpC,其中cpA类神经元对CO2有强烈的电生理反应(Luetal., 2007; Syed and Leal, 2007)。
在鳞翅目昆虫中,感受CO2的受体神经元集中分布于一个特殊的器官——下唇须陷窝器(labial-palp pit organ, LPO)中。LPO位于下唇须的第3节顶端凹陷内,其中包含很多感器,根据昆虫种类从几根到上千根不等(Kentetal.,1986; Stange and Stowe, 1999)。目前已报道的大多数鳞翅目昆虫LPO中的感器根据其形态大致可以分为两类,即毛状感器(hair-shaped sensilla)和棒状感器(club-shaped sensilla),毛状感器分布于LPO的上半部分,棒状感器分布于LPO的下半部分(Stangeetal., 1995; Zhaoetal., 2013; 董钧锋等, 2014; Chen and Hua, 2016)。大多数毛状感器和棒状感器中都只包含1个感觉神经元,少部分感器含有2个感觉神经元,并且棒状感器中神经元树突通常有分支和薄片状结构(Zhaoetal., 2013)。尽管具有分支和薄片状结构的树突是典型CO2受体细胞的特征,但因为下唇须陷窝器的特殊结构和技术限制,并没有证据表明只有棒状感器中含有感受CO2的受体神经元。相反,根据灯蛾Rhodogastria(Bogneretal., 1986)、仙人掌螟蛾(Stangeetal., 1995)、烟草天蛾(Guerensteinetal., 2004a)和棉铃虫(Ningetal., 2016)中对LPO感器的电生理记录结果,并未发现LPO中感器对除CO2外的其他气味化合物有反应,因此推测LPO中这些感器只含有专一感受CO2的神经元(Bogner, 1990; Guerensteinetal., 2004a)。
膜翅目昆虫有关CO2受体神经元的研究进展集中在蜜蜂和蚂蚁等社会性昆虫,其CO2受体神经元位于触角上的瓶形感器(sensilla ampullacea)中(Kleineidam and Tautz, 1996; Stange and Stowe, 1999; Kleineidametal., 2000)。瓶形感器普遍存在于膜翅目昆虫中,一般集中在触角的端部,这类感器的形态与其他嗅觉感器不同,它的感觉毛位于壶腹(ampulla)里边,只通过一个窄的导管与外界相连(Kleineidametal., 2000)。研究者利用电生理记录和单感器染色等技术,证明了南美切叶蚁Attasexdens的瓶形感器能够感受CO2,并且每个瓶形感器只包含单个含有很多树突分支的CO2受体神经元(Kleineidametal., 2000)。
除上述昆虫外,其他昆虫感受CO2受体神经元的研究较少。鞘翅目昆虫赤拟谷盗Triboliumcastaneum感受CO2的神经元可能位于触角上,因为切断触角会影响其对CO2的感受,而切掉下唇须对CO2的感受并无影响(Stange and Stowe, 1999)。蜻蜓目昆虫豆娘Ischnuraelegans感受CO2的神经元位于触角鞭节上(Piersantietal., 2016)。
2.2 昆虫的CO2受体
2.2.1CO2受体基因的鉴定:昆虫的CO2受体基因最先在黑腹果蝇中得到鉴定。研究者利用钙离子成像和电生理记录等技术鉴定得到表达GR21a的神经元可能是黑腹果蝇中唯一感受CO2的受体神经元(Scottetal., 2001; Suhetal., 2004)。随后,又有报道证明另一个受体基因GR63a在感受CO2的神经元上与GR21a共表达,并且只有在GR21a和GR63a共同表达的情况下,才会对CO2产生反应(Jonesetal., 2007; Kwonetal., 2007)。因此,黑腹果蝇的CO2受体基因有两个,分别是GR21a和GR63a,它们均属于味觉受体(gustatory receptor, GR)基因家族。
在果蝇CO2受体基因的研究基础上,研究人员通过同源比对的方法鉴定了传播疟疾的冈比亚按蚊中感受CO2的受体基因AgGR22,AgGR23和AgGR24,并且运用原位杂交技术确定了这3个受体基因在下颚须cpA神经元中共表达(Jonesetal., 2007; Luetal., 2007)。此后,与此3个基因同源的CO2受体基因在其他蚊类,如埃及伊蚊Aedesaegypti(Kentetal., 2008)、尖音库蚊Culexpipiens(Robertson and Kent, 2009)、致倦库蚊、中华按蚊Anophelessinensis和Anophelescoluzzii中陆续得到鉴定(Coutinho-Abreuetal., 2019)。
在鳞翅目昆虫中,如棉铃虫(Spaethe and Briscoe, 2004; Liu NYetal., 2014; Xu and Anderson, 2015)、粘虫Mythimnaseparata(Briscoe, 2000; Liuetal., 2017)、烟青虫Helicoverpaassulta(Zhangetal., 2015; Liuetal., 2017)、烟草天蛾(Liu YLetal., 2014)、家蚕Bombyxmori(Xu and Anderson, 2015; Liuetal., 2017)、红带袖蝶Heliconiusmelpomene中均鉴定出3个CO2受体基因,分别是GR1,GR2和GR3(Xu and Anderson, 2015)。鞘翅目昆虫赤拟谷盗(Robertson and Kent, 2009; Liuetal., 2017)、中欧山松大小蠹Dendroctonusponderosae(Anderssonetal., 2019)、光肩星天牛Anoplophoraglabripennis(Anderssonetal., 2019)的CO2受体基因也是GR1,GR2和GR3。
研究发现,不同昆虫基因组中CO2受体的数量并不完全相同(Jonesetal., 2007; Robertson and Kent, 2009; Erdelyanetal., 2012; Briscoeetal., 2013; Obieroetal., 2014; Terraponetal., 2014)。如蚊子、蛾类、蝶类、甲虫基因组都有3个CO2受体,但果蝇中只有2个。而采采蝇有4个CO2受体(Obieroetal., 2014),湿木白蚁Zootermopsisnevadensis(Terraponetal., 2014)中有5个与果蝇CO2受体基因同源的基因。在西方蜜蜂、人虱Pediculushumanus、豌豆蚜Acyrthosiphonpisum、阿根廷蚁Linepithemahumile和东亚飞蝗Locustamigratoria基因组中没有鉴定出同源的CO2受体基因(Robertson and Kent 2009; Terraponetal., 2014)。尽管已有报道证明蜜蜂(Lacher, 1964)和蚂蚁(Dumpert, 1972)对CO2有电生理反应,但在其基因组中却未鉴定到果蝇GR21a和GR63a的同源基因,说明它们可能存在其他感受CO2的通路。
随着生物技术的发展,很多昆虫的CO2受体基因通过测序和同源比对等方法得到了鉴定。表1统计了已鉴定的昆虫CO2受体基因的信息。研究人员将昆虫的CO2受体进行系统发育分析,从进化树中可以看出这些昆虫的CO2受体可以分为3个分支,分别为GR1分支、GR2分支和GR3分支。双翅目蚊类、鳞翅目蛾类和蝶类以及鞘翅目昆虫的3个CO2受体分别分布在GR1分支、GR2分支和GR3分支中,而双翅目蝇类的2个CO2受体分布于GR1分支和GR3分支中(Xu and Anderson, 2015)。

表1 已报道的昆虫CO2受体基因
2.2.2CO2受体基因的功能研究:CO2受体基因在多种昆虫中已有报道,但关于其功能的研究还主要集中在果蝇和蚊子中。CO2受体基因的功能鉴定已经通过异位表达(Jonesetal., 2007)、基因敲除(McMenimanetal., 2014)、RNA干扰(Erdelyanetal., 2012)和体外表达(Xuetal., 2020)技术进行了鉴定。将DmelGR21a和DmelGR63a在黑腹果蝇中进行异位表达,发现只有这两个基因共同表达时才能感受CO2,任何一个基因单独表达时都不能感受CO2(Jonesetal., 2007)。并且缺失DmelGR21a或DmelGR63a的突变体果蝇对CO2的电生理和行为反应消失,而沉默DmelGR21a在ab1C神经元上的表达也会使其对CO2的反应消失(Suhetal., 2004; Faucheretal., 2006; Jonesetal., 2007; Kumaretal., 2020)。与果蝇相比,蚊类在CO2受体基因的功能研究中还存在争议。将冈比亚按蚊的3个CO2受体基因AgamGR22,AgamGR23和AgamGR24在果蝇空神经元中进行表达,结果发现单拷贝的AgamGR22和AgamGR24在空神经元中共表达时对CO2没有反应,但是将这两个基因的拷贝量加倍时,则对CO2有反应。而将单拷贝的AgamGR23转到含有单拷贝AgamGR22和AgamGR24空神经元中共表达时对CO2有反应(Luetal., 2007)。 在埃及伊蚊中,RNA干扰AaegGR1或AaegGR3都会影响对CO2的感受,而干扰AaegGR2对CO2的感受没有影响(Erdelyanetal., 2012)。随后也有研究者证明AaegGR3突变体对CO2的电生理和行为反应都缺失(McMenimanetal., 2014),但近来有报道利用果蝇ab1C空神经元系统暗示了在埃及伊蚊CO2感受中发挥功能的是AaegGR2和AaegGR3组成的多聚体,AaegGR1则调控多聚体对CO2的反应(Kumaretal., 2020)。爪蟾卵母细胞结合双电极电压钳系统对致倦库蚊CquiGR1, CquiGR2和CquiGR3的体外功能,结果显示CquiGR2和CquiGR3组合表达时对碳酸氢钠溶液反应最大,而CquiGR1可能是调控因子;在爪蟾卵母细胞中表达冈比亚按蚊和埃及伊蚊的CO2受体基因时,其体外功能与至倦库蚊结果一致(Xuetal., 2020)。因此,蚊子中这3个CO2受体基因在感受CO2过程中各自发挥的功能还需要更多遗传和生化方面的研究进行揭示(McMenimanetal., 2014)。

续表1 Table 1 continued
与果蝇和蚊子相比,其他昆虫CO2受体功能的研究较少。将棉铃虫的3个CO2受体HarmGR1, HarmGR2和HarmGR3分别在Sf9细胞中表达,钙离子成像分析结果表明只有表达HarmGR3的细胞对碳酸氢钠溶液有明显反应(Xu and Anderson, 2015)。随后,也有研究者将棉铃虫的3个CO2受体单独地或以不同的组合形式(HarmGR1+HarmGR2, HarmGR1+HarmGR3, HarmGR2+HarmGR3和HarmGR1+HarmGR2+HarmGR3)在爪蟾卵母细胞中表达,双电极电压钳记录结果证明只有在HarmGR1和HarmGR3共表达的情况下,爪蟾卵母细胞才对碳酸氢钠溶液有反应(Ningetal., 2016)。因此,棉铃虫CO2受体基因的体外功能还存在争议。用RNAi技术分别干扰玉米根萤叶甲CO2受体基因DvvGR1,DvvGR2和DvvGR3的表达,结果发现DvvGR2在幼虫对CO2的趋向行为中发挥着重要作用(Arceetal., 2021)。
2.2.3CO2受体对气味物质的感受:随着对昆虫CO2受体功能研究的不断深入,一些挥发性气味物质作为CO2神经元的拮抗剂或激动剂在果蝇和蚊子中被发现(Luetal., 2007; Turner and Ray, 2009; Turneretal., 2011; Tauxeetal., 2013; MacWilliametal., 2018; Coutinho-Abreuetal., 2019)。这些挥发性气味包括正己醇(hexanol)(Turner and Ray, 2009)等醇类,2,3-丁二酮(2,3-butanedione)(Turner and Ray, 2009; Turneretal., 2011)、2-丁酮(2-butanone)(Turneretal., 2011)、环戊酮(Coutinho-Abreuetal., 2019)等酮类,反式-2-甲基-2-丁烯醛[(E)-2-methylbut-2-enal](Coutinho-Abreuetal., 2019)、正丁醛(butanal)(Turner and Ray, 2009)、丙醛(propanal)(Coutinho-Abreuetal., 2019)等醛类,丙酮酸乙酯(ethyl pyruvate)和丙酮酸甲酯(methyl pyruvate)等酯类(Tauxeetal., 2013),异丁酸(isobutyric acid)等酸类(Kumaretal., 2020),亚精胺(spermidine)和丁胺(butylamine)等胺类(MacWilliametal., 2018)物质。CO2神经元的拮抗剂可以使蚊类对皮肤气味的电生理反应和行为反应都显著下降,这一发现为驱蚊剂的制作提供了新的思路(Tauxeetal., 2013)。CO2神经元的激动剂对蚊类具有吸引作用,其引诱效果与CO2相近,为开发适用于发展中国家的蚊虫诱捕器提供了新策略(Tauxeetal., 2013)。那么感受这些挥发性气味物质的过程中是CO2受体在发挥作用,还是在CO2神经元上表达的其他受体在发挥作用?有报道利用果蝇空神经元系统证实了正己醇和2,3-丁二酮等抑制果蝇触角感受CO2神经元活性的气味物质只特异性地抑制表达果蝇CO2受体GR21a/GR63a的神经元(Turner and Ray, 2009),并且GR63a突变体果蝇对激活或抑制ab1C神经元活性气味物质的反应消失(Tauxeetal., 2013; MacWilliametal., 2018),类似的研究结果在蚊子中也被证实(Tauxeetal., 2013; MacWilliametal., 2018; Kumaretal., 2020)。这些研究结果表明昆虫CO2受体除了感受CO2以外,很可能也感受一些特殊的气味物质。
2.3 CO2信号在外周神经水平上的传导机制
CO2信号在昆虫CO2受体神经元中的传导机制目前仅有大致的推测,这一推测主要来源于黑腹果蝇和埃及伊蚊的相关研究结果。研究者利用RNA干扰技术揭示G蛋白在果蝇感受气味物质和CO2过程中的作用时,发现干扰Gαq和Gγ30A会减小GR21a/GR63a调控的CO2反应,并且Gαq对果蝇感受CO2神经元ab1C的发育和功能是必需的(Yao and Carlson, 2010)。随后又有报道称经典型瞬时受体电位通道(canonical transient receptor potential channel)(简称TRPC通道)及磷脂酶C(phospholipase C)(简称Plc21c)在果蝇GR21a/GR63a受体神经感受CO2的过程中也起着重要作用(Badshaetal., 2012)。能解释这些研究结果的最好假设是昆虫的CO2受体是被其他信号通路调控的配体阳离子通道,这个调控可能是通过磷酸化或其他一些转译后修饰(Nakagawa and Vosshall, 2009; Jones, 2013)。因此,研究者在黑腹果蝇中提出1个这样的CO2信号传导通路:涉及到Gαq的G蛋白信号(DmGα49B),激活磷脂酶C(Plc-ß)通路,通过DmPlc21c调控下游的Trps, DmTRP和DmTRPL(Hilletal., 2019)。在此基础上,通过测序技术鉴定得到与果蝇同源的Plcb, Trp和Gα49B在雌性埃及伊蚊下颚须中表达,且表达量很相近,这些基因可能在果蝇中行使一样的功能:位于CO2受体下游支持埃及伊蚊对CO2的正常反应,说明埃及伊蚊的CO2信号传导通路与黑腹果蝇相似(Bohbotetal., 2014)。近来,Hill等(2019)的研究结果支持了这一假设,因为在雌性埃及伊蚊中与CO2信号传导通路相关基因的转录本数量在雌蚊吸血后24 h减少,相应对CO2的电生理反应也减小。图1为推测的昆虫CO2信号传导通路模式图(Hilletal., 2019)。
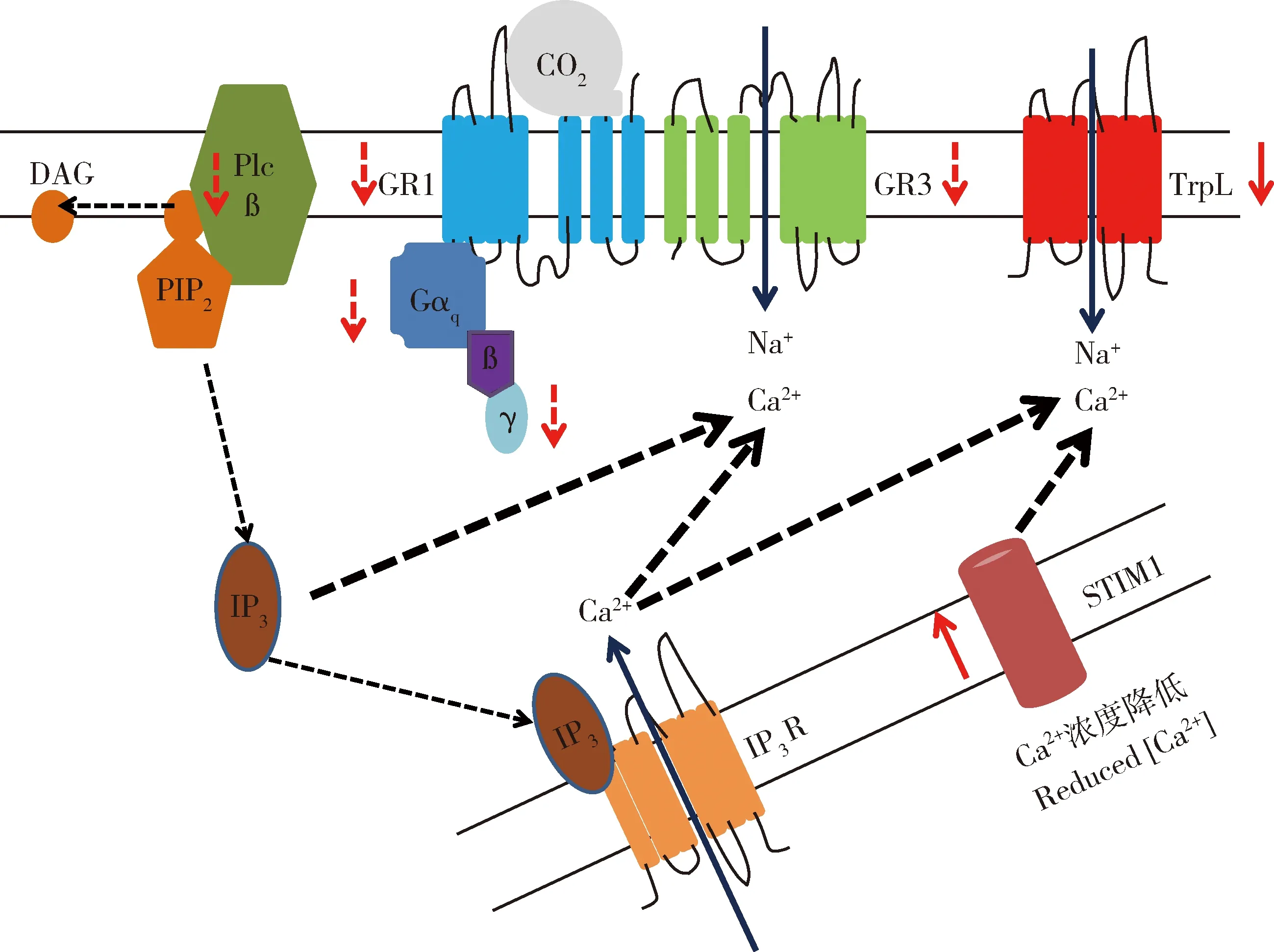
图1 推测的昆虫CO2信号传导通路模式图(仿Hill et al., 2019)
3 昆虫在中枢神经水平上感受CO2机制的研究进展
3.1 CO2信号在脑初级中枢触角叶中的处理
触角叶(antennal lobe, AL)是昆虫脑中处理CO2信息的初级神经中枢(Guerensteinetal., 2004a)。黑腹果蝇感受CO2的神经元投射到触角叶中一个单独的嗅小球,因为此嗅小球位于触角叶的最腹侧,因此被命名为嗅小球V(Suhetal., 2004)。在埃及伊蚊中,相应的CO2神经元投射到触角中1个位于背内侧的嗅小球中(Distler and Boeckh, 1997; Antonetal., 2003)。冈比亚按蚊的CO2神经最终投射到触角叶中的3个嗅小球,这3个嗅小球不接受来自触角的神经输入,但后期试验证明其中两个嗅小球可以接收伴随CO2信息的其他嗅觉信息(Ignelletal., 2005)。此外,与黑腹果蝇和埃及伊蚊不同,冈比亚按蚊的CO2神经投射是双边投射,既可以投射到同侧的触角叶,也可以投射到对侧的触角叶,而黑腹果蝇和埃及伊蚊的CO2神经元只投射到与身体同侧的嗅小球中(Antonetal., 2003; Anton and Rospars, 2004)。
与双翅目蝇类和蚊类的研究结果相似,棉铃虫(Zhaoetal., 2013; Maetal., 2017)、烟草天蛾(Guerensteinetal., 2004a)等鳞翅目蛾类的LPO感觉神经元也投射到触角叶一个单独的嗅小球中,它位于触角叶的最腹侧,被命名为下唇须陷窝器神经纤维球(labial pit organ glomerulus, LPOG)。LPOG除了接收来自CO2受体神经元的投射外,并不接收其他气味受体神经元的投射,因此猜测LPOG专门处理CO2信息。此外,蛾类的CO2神经元投射模式与冈比亚按蚊相同,都是双边投射(Kcetal., 2020)。
3.2 CO2信息在脑高级神经中枢的处理
昆虫嗅觉系统的神经投射在果蝇和蛾类中的报道较为详细,因为果蝇是模式昆虫,而蛾类的神经系统简单、可操作且嗅觉系统灵敏(Ianetal., 2016)。触角叶将接收的嗅觉信息经过初步处理后经由二级投射神经元投射到蕈形体冠(calyx, Ca)和侧角(lateral horn, LH)(Martinetal., 2011; Asoetal., 2014)。蕈形体冠为球状或杯状结构区,属于蕈形体(mushroom body, MB)的一部分,通常位于脑的后端,其功能主要是感知昆虫的嗅觉信息(Itoetal., 2014)。侧角位于腹外侧前脑的两侧,接收来自触角叶的单球和多球投射神经元的信息(Itoetal., 2014; Ianetal., 2016)。触角叶内的CO2投射神经元在LPOG内形成复杂的树突,然后这些投射神经元继续向脑的高级中枢投射到前脑的侧角,再向上投射到蕈形体冠(Ianetal., 2016)。
4 昆虫感受CO2的其他通路
蜜蜂和蚂蚁的基因组中并未鉴定到CO2受体基因的同源基因,但这两者对CO2的反应早有报道,这暗示了昆虫中可能存在其他感受CO2的通路。这一猜想在果蝇中得到了证实。果蝇喙上的味觉受体神经元对低浓度的水溶CO2和高浓度的气态CO2有反应,但之前已报道的CO2受体在这些味觉神经元中并不表达,并且味觉神经元的突变体并不影响果蝇对CO2的嗅觉感受,而GR63a突变体对水溶性CO2仍然具有味觉偏好性,说明味觉和嗅觉感受CO2的分子机制可能也是相互独立的(Fischleretal., 2007)。进化上保守的离子型受体(ionotropic receptor, IR)在果蝇的CO2感受中也可以单独起作用:利用CRISPR/Cas9技术分别对在果蝇唇味觉神经(labellar taste peg neuron)上表达的IR56d,IR25a和IR76b进行敲除,所得突变体对饱和碳酸溶液的电生理反应和行为学反应完全消失,说明IR56d, IR25a和IR76b在唇味觉神经中对感受CO2至关重要(Bentonetal., 2009; Sánchez-Alcaizetal., 2018)。此外,研究发现果蝇对CO2的反应由两条不同的神经通路调控,分别为CO2吸引果蝇的神经通路和果蝇逃避CO2的神经通路,而前者需要IR25a的参与(van Breugeletal., 2018)。并且,IR64a也参与了果蝇对较高浓度的CO2(>5%)的感受(Aietal., 2010)。尽管IR参与昆虫对CO2感受的研究主要集中在果蝇中,但是IR本身在进化中比较保守,因此推测IR很可能在其他昆虫中也参与了对CO2的感受。
5 小结与展望
CO2是环境中无处不在的一种化学信号,昆虫可以通过识别这一信号完成特定的生命活动。在大气CO2浓度日益增高的趋势下,昆虫的一些生物学特性肯定会受到影响,包括种群的发育和繁殖(Wuetal., 2006; 赵磊等, 2015)、某些昆虫特定行为的变化(吴华等, 2011)、甚至是昆虫外部形态的改变(沙威等, 2016)。围绕CO2对昆虫的影响和昆虫感受CO2机制展开研究不仅可以给昆虫的生态适应、预测预报等相关研究提供思路,还能够为害虫防治提供潜在的理论基础。昆虫感受CO2的机制研究在2007年首次鉴定得到果蝇CO2受体后取得了很大进展,这些进展主要集中在多种昆虫中CO2受体的鉴定、CO2受体的功能、感受CO2神经元在脑中的投射通路等方面。但在相关研究中仍然存在诸多问题未有定论,例如:除果蝇外其他昆虫中CO2受体的功能;CO2信息在外周的传导机制;在果蝇中报道的其他感受CO2通路是否普遍存在于其他昆虫中。这些问题为进一步探索昆虫感受CO2机制指明了方向。

