体外诱导获取利福平耐药结核分枝杆菌菌株及其稳定性研究*
司晓燕,陈俊林,施慧慧,瞿 梅,马 娟,顾德林
(南通市第六人民医院检验科,江苏 226011)
利福平(Rfp)是最重要的一线抗结核药物,是现代结核病化疗的基石。Rfp 通过与细菌RNA 聚合酶β 亚基(rpoB)结合,干扰细菌转录过程,实现杀菌效果。rpoB 基因核心区域发生突变时,Rfp 不能与RNA聚合酶β 亚基结合,导致细菌对利福平耐受。对Rfp耐药结核病的治疗方案需作重大调整,疗程大幅度延长,治愈率明显下降[1]。WHO 非常重视Rfp 耐药结核病,将其列入耐多药结核病诊治范畴[2]。目前诊断Rfp 耐药主要依靠表型药敏技术,如罗氏培养和比例法药敏技术[3]以及分子药敏技术,如基因芯片[4]、XpertMTB/RIF[5]、荧光PCR 熔解曲线法[6]等。但在实际应用中经常发现分子药敏和表型药敏检测结果存在一定差异[7],给临床诊断和治疗带来困惑。目前国内外对Rfp 异质性耐药机制研究主要集中在Rfp 耐药基因(rpoB 基因)不同位点突变与耐药水平的关系[8-9],也有对外排泵机制进行研究[10-11],但研究对象主要为临床分离结核分枝杆菌(MTB)菌株,获得的是静态结果,未能动态观察耐药演变过程,而体外耐药诱导试验可能会显示直观效果[12]。本课题组根据文献[13]采用MTB 标准菌株H37Rv 在体外进行耐药诱导,获取Rfp 耐药菌株,然后对外排泵功能基因Rv1457c、Rv1458c 在MTB 菌株耐药表型和rpoB 基因突变型中的表达量进行研究。
1 材料与方法
1.1 试剂和仪器 MTB 标准菌株(H37RvATCC27294,国家菌种保藏中心),iddlebrook 7H10 培养基干粉、OADC 营养添加剂(BDBecton Dickinson 公司,美国),Rfp(重庆华邦制药股份有限公司),GNP-92700隔水式培养箱(上海精宏实验设备有限公司),Gen eXpert 仪器、Xpert MTB/RIF 检测试剂盒(美国Cepheid 公司),24 孔变色硅胶微孔板及含Rfp 7HIO液体培养管(上海积彩医疗器械有限公司),MTB RNA 提取试剂盒、RNA 反转录试剂盒及real-time PCR 试剂盒(北京天根生化科技有限公司),结核分枝杆菌利福平耐药突变检测试剂盒(厦门致善生物科技股份有限公司),ABI 7500 型荧光定量PCR 仪(美国应用生物系统公司),罗氏培养基及7H9 液体培养基由本实验室自配。
1.2 方法
1.2 .1 将H37Rv 菌株在无菌生物柜中以7H9 液体培养基进行复苏。
1.2 .2 最低抑菌浓度(MIC)检测:Rfp 在液体培养基中药敏的耐药界值设定为1 μg/mL[14]。采用24 孔底部含变色硅胶的微孔板作为MTB 培养载体,具体方法参考文献[15]。先用二甲基甲酰胺溶解Rfp 配制成10 mg/mL,再用7H9 培养基稀释成各浓度含药培养液(0.016、0.032、0.064、0.125、0.25、0.5、1.0、2.0、4.0、8.0、16.0、32.0、64.0 μg/mL)。微孔板设阳性对照孔、阴性对照孔和测试孔。阴性对照孔不接种菌,阴性对照孔加不含药培养基0.8 mL,阳性对照孔加不含Rfp 培养基0.4 mL,接种0.4 mL 标本沉淀悬浊液,测试孔中分别加入0.4 mL 各终浓度Rfp 培养液,再接种0.4 mL 标本沉淀悬浊液。培养板用透明胶布封好装入密封袋,置于37 ℃温箱进行培养。从培养第2天起,每天观察微孔板底硅胶颜色是否由天蓝色逐渐变成黄色。当测试孔底硅胶先于或同时与阳性对照孔底发生颜色改变,说明测试孔内Rfp 不能抑制MTB 繁殖,判断该测试孔内为Rfp 耐药MTB;当阳性对照孔底硅胶颜色改变,而测试孔底硅胶在设定的时间颜色未改变,说明测试孔MTB 生长被Rfp 抑制,判为Rfp 敏感MTB。实验观察时间为21 天,超过21 天不生长需重复试验。
1.2 .3 体外Rfp 耐药间断性诱导试验:采用含7H10、pH 为6.9 的液体培养基的培养管作为培养诱导载体,将H37Rv 菌液配成2×104~105CFU/mL 浓度,取0.1 mL 接种在0.016 μg/mL Rfp 液体培养基中,接种5 支。3 周后将菌液收集在一起,一部分诱导菌株采用Xpert MTB/RIF 技术和荧光PCR 熔解曲线法检测rpoB 基因,另一部分转种到不含药固体罗氏培养基中,经过3 周修复期后收集在一起,再次转种在0.032 μg/L Rfp 培养基中。重复上述实验步骤,直至Rfp 最高浓度。每次诱导试验均设置不含药的对照组。
1.2 .4 MTB 总RNA 制备及反转录合成:刮取罗氏培养基中修复期的新鲜菌落,通过RNA 提取试剂盒提取总RNA,用DNaseI去除DNA 污染后,采用超微量紫外分光光度计测定总RNA 浓度和纯度,确定提取质量。参照试剂盒试剂使用说明书对提取的总RNA进行反转录,反应条件为37 ℃15 min,85 ℃5 s。
1.2 .5 外排泵基因检测[16]:利用实时荧光定量PCR方法(real-time PCR)检测不同浓度Rfp 诱导菌株药物外排泵基因Rv1457c、Rv1458c 的mRNA 表达量,进一步测算不同浓度Rfp 诱导菌株与标准菌株Rv1457c、Rv1458c 相对表达量比值。real-time PCR方法:采用Primer 5.0 软件设计Rv1457c、Rv1458c及内参基因Hsp65 引物序列,由上海生工生物工程有限公司合成。Rv1457c-F:GTAGCACCGAGTCGTTTG,R:ATCTCC ACCGCATTCACC;Rv1458c-F:CAGTCCAAGTACCTCAATG,R:GCGATACGGGTCAATAAC;Hsp65-F:TCGAGACCAAGGAGCAGATT,R:CACGAAGTACCCCGAGATGT。PCR 扩增参照试剂盒标准操作步骤进行,反应条件为95 ℃2 min,95 ℃10 s,60 ℃10 s,72 ℃40 s,循环50 次。采用2-ΔΔCt法分析数据(ΔCt=Ct目的基因-Ct内参基因),不同浓度Rfp 诱导成功菌株与标准菌株H37Rv 目的基因相对表达量的比值(2-ΔΔCt)表示该目的基因的表达水平,比值>2 代表该基因高表达。
1.2 .6 rpoB 基因检测:采用Xpert MTB/RIF 核酸扩增法,按检测试剂盒说明书操作[17],系统自动进行检测和结果判断,2 h 内判断MTB rpoB 基因(Rfp 耐药决定区,507-533 共27 个氨基酸密码子,81 bp)是否发生突变及突变位置。基因检测探针分别以probe A(密码子507-511)、probe B(密码子512-518)、probe C(密码子518-523)、probe D(密码子523-529)、probe E(密码子529-533)命名。
1.2 .7 Rfp 耐药突变检测:采用荧光PCR 熔解曲线法,按结核分枝杆菌利福平耐药突变检测试剂盒说明书操作[18],检测MTB rpoB 基因突变。
1.2 .8 连续传代培养:将Rfp 耐药菌株在无药罗氏培养基上连续培养10 代,检测MIC 的变化。
2 结 果
2.1 Rfp 耐药MTB 诱导菌株 诱导前H37Rv 菌株Rfp MIC 为0.032 μg/mL,因而从Rfp 0.016 μg/mL浓度开始诱导,经过连续浓度倍增法诱导到32 μg/mL浓度时,获得Rfp 耐药MTB 菌株。
2.2 Xpert MTB/RIF 及荧光PCR 熔解曲线法检测结果 MTB 标准菌株从0.016 μg/mL 诱导到16 μg/mL各代,Xpert MTB/RIF 及荧光PCR 熔解曲线法均未检测到rpoB 基因发生突变;诱导至32 μg/mL,Xpert MTB/RIF probe E 探针有反应,同时荧光PCR 熔解曲线法检测到531 位氨基酸密码子发生变化。
2.3 外排泵基因检测结果 real-time PCR 检测显示,随着Rfp 诱导浓度增加,菌株Rv1457c、Rv1458c相对表达量逐渐增加,与标准菌株(MIC 0.032 μg/mL)的初始Rv1457c、Rv1458c 相对表达量比值不断升高,当Rfp 浓度达到0.5 μg/mL 及以上时,该比值大于2,提示Rv1457c、Rv1458c 基因处于高表达状态。见表1。
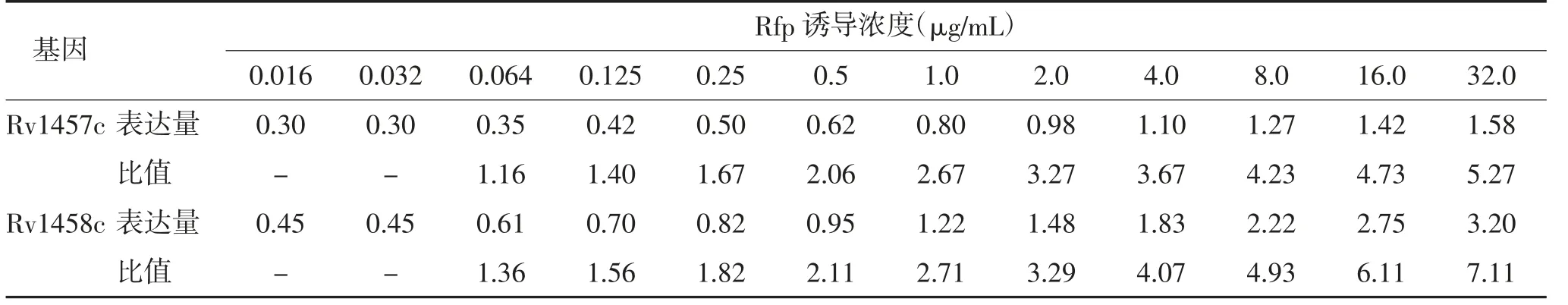
表1 不同浓度Rfp 诱导菌株与标准菌株Rv1457c、Rv1458c 相对表达量比值
2.4 连续传代培养后MIC 诱导前H37Rv MIC 为0.032 μg/mL,rpoB 基因发生突变前各相应浓度的Rfp 诱导菌株MIC 明显降低,而rpoB 基因发生突变的Rfp 诱导菌株MIC 降低不明显。见表2。
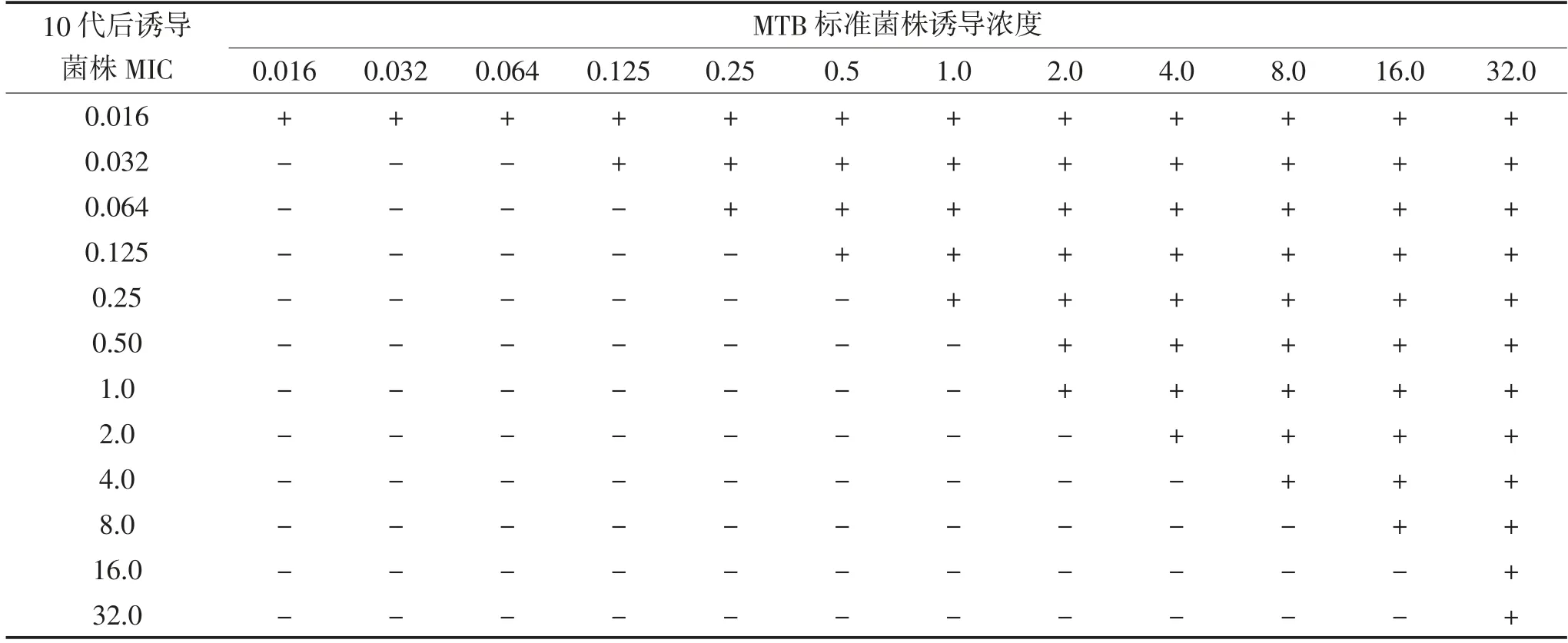
表2 Rfp 各浓度诱导菌株连续传代培养10 代后MIC 变化 μg/mL
3 讨 论
快速精准诊断Rfp 耐药结核病,及时调整治疗方案,不但能提高治愈率、减轻致残率,还能缩短无效治疗时间,减少社会传播风险。目前Rfp 耐药检测手段的有效率和一致性还存在一些问题,临床医生无法在第一时间作出准确判断。MTB 对Rfp 耐药机制较为复杂,近年来许多学者进行了相关研究[19-21]。既往Rfp 体外诱导试验采用固体培养基诱导加无药罗氏固体培养基修复模式,耗时较长[22]。本研究尝试利用含Rfp 液体培养基诱导加无药固体罗氏培养基修复模式,诱导试验获得成功。
rpoB 基因突变导致相应合成蛋白结构改变,从而影响Rfp 与靶标的结合,进而使MTB 产生耐药性[23]。本研究采用Xpert MTB/RIF 及荧光PCR 熔解曲线技术同时检测每个Rfp 浓度诱导菌株rpoB 基因是否发生突变,当Rfp 诱导浓度达到32 μg/mL时,Xpert MTB/RIF probe E 探针有反应,同时荧光PCR 熔解曲线法检测到rpoB 基因531 位氨基酸密码子发生变化,提示rpoB 基因发生突变,且为高浓度耐药位点突变。Xpert MTB/RIF A-E 5 个探针基因序列完全根据rpoB 基因序列设置且完全重合,因而能完整检测rpoB 基因片段的突变情况[24]。荧光PCR熔解曲线法主要根据rpoB 基因常见氨基酸突变位点设置野生型探针和突变型探针,可以高效精准地检测氨基酸突变位点。rpoB 基因531 位点以TCGTTG 突变为主,TCG-TGG 突变极少见,因此荧光PCR 熔解曲线探针用于检测rpoB 基因531 位氨基酸突变位点的野生型探针设置为rpoB-531TCG。突变型探针设置为rpoB-531TTG[25]。rpoB 基因测序步骤繁琐复杂,需要送专门机构检测,而Xpert MTB/RIF 及荧光PCR 熔解曲线法为全自动基因检测技术,可以替代基因测序,达到理想效果,并节省人力、时间和费用。
外排泵系统是生物体固有防卫系统,其中ABC转运蛋白超家族编码外排泵的功能基因在MTB 表型耐药演变过程中发挥重要作用,Rv1457c、Rv1458c高表达与MTB 对Rfp 表型耐药密切相关[16]。本研究real-time PCR 检测结果显示,随着Rfp 诱导浓度增加,MTB 药物外排泵基因Rv1457c、Rv1458c mRNA相对表达量逐渐增加,当诱导浓度达到0.5 μg/mL以上时,与标准菌株Rv1457c、Rv1458c mRNA 相对表达量的比值超过2,提示外排泵基因已处于高表达状态。当Rfp 诱导浓度达到1 μg/mL 以上,理论上MTB 已达到耐Rfp 状态,但尚未达到rpoB 基因发生突变的32 μg/mL 诱导浓度,这阶段耐药主要与外排泵基因高表达导致外排泵系统功能增强有关。
将不同浓度Rfp 诱导菌株在无药固体罗氏培养基上连续传代培养10 代再检测MIC,可以看到rpoB基因发生突变前各浓度Rfp 诱导菌株的MIC 明显降低,而rpoB 基因发生突变的Rfp 诱导菌株MIC 降低不明显,提示rpoB 基因发生突变前外排泵功能的增强导致MTB 诱导菌株MIC 升高,随着外生长环境杀菌药物缺失,压力减轻,外排泵系统功能逐渐减弱,但高浓度耐药位点rpoB 基因发生突变菌株的耐药性能获得稳定遗传。
综上所述,通过体外诱导实验可以获得Rfp 耐药MTB 菌株,但rpoB 基因片段突变位点单一,未能诱导出临床存在多点突变、甚至联合突变的耐Rfp菌株,可能和诱导条件有关。为保证诱导质量和评价标准,体外诱导实验均采用MTB 标准菌株,且在pH6.9、营养丰富的环境中诱导,而临床MTB 菌株一般在pH 值5.8 左右酸性环境中的巨噬细胞内生存,还受药物、人体免疫多重因素影响,导致体外诱导菌株与临床菌株基因突变位点存在差异,这为本课题组下一步研究提供方向。此外,药物外排泵基因表达与MTB 菌株诱导浓度相关,但仅有高浓度耐药位点rpoB 基因突变的MTB 菌株耐药性获得稳定遗传,提示高浓度耐药位点rpoB 基因突变以及药物外排泵功能在耐药机制中发挥主要作用,临床上可以采用分子药敏和微量MIC 串并联方案来解决MTB 对Rfp 异质性耐药问题[26-27]。

