雷公藤内酯醇对溃疡性结肠炎小鼠肠黏膜通透性的影响*
尤国莉,秦春峰,阮 云,沈剑波,朱笑林,周国雄
(1 建湖县人民医院消化内科,江苏 224700;2 南通市通州区中医院;3 南通大学附属医院消化内科)
炎症性肠病主要包括溃疡性结肠炎(UC)和克罗恩病,以慢性炎症为特征。肠黏膜机械屏障主要由肠上皮细胞和细胞间紧密连接构成,肌球蛋白轻链激酶(MLCK)调控肌球蛋白轻链(myosin light chain,MLC)磷酸化,介导肌动蛋白收缩,使相邻肠上皮细胞间隙增大,肠黏膜通透性增加[1]。肠黏膜屏障功能异常导致肠道致病菌群及有害成分更易入侵肠黏膜,激活体内免疫系统,释放促炎细胞因子和趋化因子,导致慢性炎症。有研究表明,肠黏膜通透性改变发生在肠道炎性改变前[2],肠道炎症加重时,肠黏膜通透性进一步增高。肠黏膜通透性改变与溃疡性结肠炎的发生有着紧密联系[3-4]。雷公藤内酯醇(triptolide,TL)是从中药雷公藤中提取的活性成分,是雷公藤二萜化合物中免疫抑制作用最强的单体[5-6]。研究发现,TL 对包括克罗恩病在内的多种自身免疫性疾病具有免疫抑制和抗血栓作用[7],TL 改善克罗恩病与抑制TLRs/NF-κB 信号通路相关[8]。抑制IL-6信号转导和转录激活因子3(STAT3)信号通路及下调IL-17 可改善结肠炎[9]。本研究旨在观察TL 对UC小鼠肠道炎症反应及肠黏膜通透性的影响,探讨TL是否具有治疗UC 的作用。
1 材料与方法
1.1 实验动物 SPF 级BALB/c 雄性小鼠80 只,体重20~22 g[北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2016-0006],饲养于南通大学实验动物中心[(SYXK(苏)2015-0016)],室内温度20 ℃±2 ℃,湿度50%~60%,照明12/12 h 明暗交替,自由采食和饮水,Co60辐照灭菌饲料(苏州双狮实验动物饲料科技有限公司)。本研究经过南通大学实验动物伦理委员会审核批准。
1.2 模型及分组 80 只小鼠随机分成8 组,其中10 只作为空白对照组(NC 组),自由饮用无菌水,其余70 只饮用5%葡萄糖硫酸钠(DSS)溶液,建立小鼠UC 模型[10-11]。第3 天将70 只UC 模型小鼠随机分成7 组,每组10 只:模型组(M 组),腹腔注射生理盐水0.2 mL/d;丙二醇组(PG 组),腹腔注射20%丙二醇0.2 mL/d;雷公藤内酯醇低剂量组(TLL 组)、中剂量组(TLM 组)及高剂量组(TLH 组)分别腹腔注射TL 0.10 mg/kg·d、0.20 mg/kg·d 和0.40 mg/kg·d;地塞米松组(D 组),腹腔注射地塞米松0.20 mg/kg·d;美沙拉嗪组(MS 组),美沙拉嗪灌胃,0.60 g/kg·d。第8 天处死小鼠,对小肠黏膜进行通透性实验、超微结构观察及MLCK、MPO 活性,TNF-α 及IL-10 含量检测。
1.3 主要试剂 99.78%雷公藤内酯醇(成都曼思特生物科技有限公司),DSS(南京普诺恩生物技术有限公司),美沙拉嗪肠溶片(葵花药业集团佳木斯鹿灵制药有限公司),注射用地塞米松硫酸钠(天津药业集团有限公司),异硫氰酸荧光素-葡聚糖(f1uorescein isothiocyanate-dextran,FITC-D)(南京普诺恩生物技术有限公司)。髓过氧化物酶(MPO)、IL-10、TNF-α 及MLCK 检测试剂盒(DL develop 公司),大便隐血(FOB)检测试剂盒[艾博生物医药(杭州)有限公司]。
1.4 小鼠一般情况观察 观察小鼠体重变化、大便性状及大便隐血等情况,参照丁氏Cooper 标准进行疾病活动指数(DAI)评分(表1)。DAI 评分=(体重下降百分比评分+大便性状评分+大便隐血评分)/3。

表1 小鼠DAI 评分表
1.5 小肠黏膜通透性检测 采用FITC-D 示踪法,参照文献方法略加改进[12-13]。将距回盲部5 cm 的末段10 cm 回肠两端用丝线结扎,向该段肠腔注入新鲜配制的FITC-D 溶液(20 mg/mL)0.5 mL。30 min后取门静脉血,肝素抗凝,3 000 g 离心10 min,分离血浆,PBS 稀释后测定荧光强度。激发光波长为485 nm,发射光波长为528 nm,根据标准曲线计算门静脉血FITC-D 含量。
1.6 小肠黏膜透射电镜检查 距回盲部1 cm 处取长度约0.5 cm 回肠段,置于预冷载玻片上,迅速滴4滴冰戊二醛溶液。切成面积为1 mm2左右小块,置于2.5%戊二醛溶液中,4 ℃固定6 h。PBS 洗涤3 次后用1%锇酸固定,4 ℃2 h。梯度酒精脱水,环氧丙烷透明30 min。在环氧丙烷和树脂等量混合液中浸泡2 h,再入纯树脂浸泡2 h。将组织取出后放入含有树脂的包埋液中,置60 ℃恒温箱中固化48 h。固化后的组织进行超薄切片(70 nm),柠檬酸铅染色,水洗干燥后透射电镜观察组织超微结构变化。
1.7 小肠黏膜MLCK、MPO 活性及炎症因子水平检测 参照试剂盒说明书,采用ELISA 法检测肠组织中MLCK、MPO 活性,TNF-α 及IL-10 水平。
1.8 统计学处理 应用Graphpad Prism 7.0 软件对数据进行分析处理并作图。计量资料以±s 表示,组间比较采用独立样本t 检验,多组间比较采用Oneway ANOVA 检验。P<0.05 为差异具有统计学意义。
2 结 果
2.1 大便隐血检测 除NC 组外,其余各组小鼠在饮用5% DSS 溶液后第5 天均出现不同程度的肉眼可见血便,隐血试纸测试阳性。
2.2 各组小鼠DAI 评分比较 NC 组DAI 评分接近0,饮用5%DSS 溶液后各组小鼠DAI 评分随着时间推移而逐渐增高。造模后第1,第2 天各组小鼠DAI评分比较,差异均无统计学意义(P>0.05)。MS 组从第3 天开始DAI 评分较NC 组显著升高(P<0.01)。第4 天TLL 组、TLM 组DAI 评分与M 组无显著差异,而从第4 天开始TLH 组DAI 评分较M 组显著降低(P<0.001),而MS 组DAI 评分显著高于其他组,该组小鼠死亡率最高。见图1。
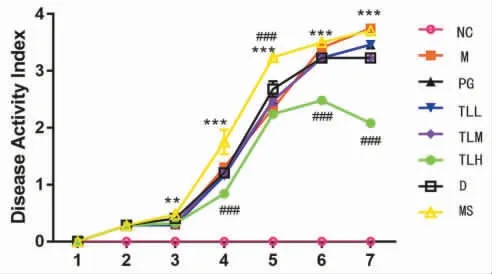
图1 各组小鼠DAI 评分
2.3 各组小鼠小肠黏膜通透性比较 与NC 组比较,M 组及PG 组小鼠血浆FITC-D 含量明显增高(P<0.01)。与M 组比较,TLL、TLM 及TLH 各组小鼠血浆FITC-D 含量均不同程度降低,但仅TLL 组的差异有统计学意义(P<0.05)。见图2。MS 组因死亡率较高,无统计价值。

图2 各组小鼠小肠粘膜通透性检测
2.4 各组小鼠肠黏膜超微结构观察 透射电镜下可见NC 组小鼠回肠黏膜上皮细胞超微结构正常,上皮细胞结构完整,呈高柱形;表面微绒毛密集,绒毛较粗、长,排列整齐,细胞间连接紧密,间隙很小(图3a)。M 组小鼠回肠可见部分上皮明显受损,微绒毛排列稀疏、萎缩、长短不一,细胞间连接复合体缩短、变宽,相邻上皮细胞间隙明显增大(图3b)。PG组、TLL 组及TLM 组小鼠回肠上皮细胞损伤程度接近M 组,微绒毛萎缩,细胞间隙扩大,与M 组比较未发现有明显改善(图3c-e)。TLH 组上皮细胞形态接近正常,微绒毛排列较为整齐、密集,细胞连接结构清晰,紧密程度较M 组显著增高(图3f)。MS 组及D组微绒毛结构有一定程度的改善(图3g、h)。

图3 透射电镜检测肠超微结构(6 000×)
2.5 各组小鼠肠组织中MLCK、MPO 活性,TNF-α及IL-10 含量比较 与NC 组相比,M 组肠组织中MLCK 活性显著升高(P<0.001);与M 组小鼠相比,经TL、D、MS 治疗后MLCK 活性显著降低(P<0.001)(图4A)。与NC 组相比,M 组MPO 活性升高,经TL、D、MS 治疗后,MPO 活性降低,但与M 组比较差异均无统计学意义(P>0.05)(图4B)。与NC 组相比,M组肠组织中TNF-α 含量升高,经TL、D、MS 治疗后降低,但与M 组比较,差异均无统计学意义(P>0.05)(图4D)。与NC 组相比,M 组肠组织中IL-10 含量降低,仅TLH 治疗后IL-10 含量有所升高,但与M组的差异无统计学意义(P>0.05)(图5C)。
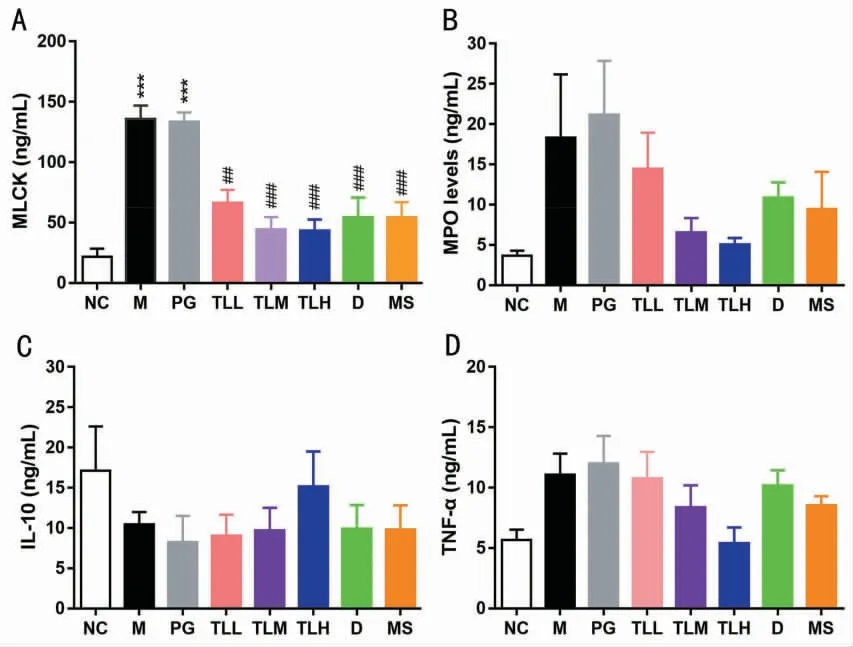
图4 肠组织中MLCK、MPO 活性,TNF-α 及IL-10 检测
3 讨 论
临床研究发现,溃疡性结肠炎患者肠黏膜中TNF-α、IFN-γ、IL-6 等炎性细胞因子表达增高,这些细胞因子通过不同途径改变肠上皮通透性,破坏肠上皮细胞屏障功能[14]。DSS 诱导的动物模型是目前应用最广泛的UC 模型,其症状、病变部位、病理形态学与人类UC 的发生发展过程极为相似。本研究中小鼠饮用5%DSS 溶液后第5 天出现明显便血,DAI 评分随时间推移显著增加,经不同剂量TL 治疗后均有不同程度改善,其中TLH 组效果最为显著。FITC-D 检测发现,M 组肠黏膜通透性显著升高,TL各治疗组肠黏膜通透性明显降低,MS 组因小鼠死亡率较高,差异性比较无统计学意义。本实验中电镜观察到MS 组未死亡小鼠肠黏膜上皮细胞超微结构有所改善,但该药的毒副作用可能是导致小鼠死亡率较高的原因。透射电镜观察显示,DSS 造模后小鼠肠上皮结构明显受损,微绒毛排列稀疏、萎缩、长短不一,细胞间连接复合体缩短、变宽,相邻肠上皮细胞间隙明显增大。经高剂量TL 治疗后,肠上皮绒毛排列及相邻细胞间隙均有显著改善,提示TL 可能通过改善肠上皮结构而降低通透性。
TNF-α 是重要的促炎因子,通过诱导上皮细胞凋亡而破坏上皮屏障,并促进肠上皮细胞释放炎症趋化因子,招募和活化中性粒细胞和巨噬细胞,激活肠道适应性免疫系统[15]。IL-10 主要功能是抑制炎症反应和细胞因子释放,有研究表明IL-10 基因敲除小鼠在无特定致病菌的条件下可发生与人UC 形态学上相似的结肠炎,并伴有炎症因子的增加。本研究结果显示,M 组小鼠肠组织中TNF-α 含量显著增高,IL-10 含量明显降低。低剂量TL 和地塞米松治疗对TNF-α 含量几乎无影响,美沙拉嗪组TNF-α含量有一定下降,TLM 组、TLH 组TNF-α 含量较M组明显降低,但差异无统计学意义(P>0.05)。
MPO 主要存在于中性粒细胞中,局部组织中MPO 含量反映中性粒细胞的浸润程度,可评价肠道炎症的严重程度。本研究中M 组小鼠肠组织中MPO活性显著增高,经TL、D、MS 治疗后MPO 活性降低,尤其中剂量和高剂量TL 的作用明显优于D 组和MS 组,表明TL 在抑制肠黏膜炎症反应、保护肠黏膜屏障中具有十分重要的作用。MLCK 是肠黏膜通透性最主要的钙调素激酶,MLCK 激活后可催化MLC磷酸化,介导肌动蛋白收缩,引起细胞骨架重排,破坏细胞紧密连接,导致细胞间隙增大。本研究M 组肠组织中MLCK 活性显著升高,经TL、D、MS 治疗后明显降低(P<0.001)。透射电镜观察到的超微结构结果与各组肠组织中MLCK 活性变化一致。

