再生障碍性贫血发生糖尿病危险因素分析
康虹阳, 刘 洁, 陈 哲, 佟长青, 吉慧姝, 李 琦, 张 斌
河北北方学院附属第一医院 1.血液科;2.检验科,河北 张家口 075000
再生障碍性贫血(aplastic anemia,AA)是由于多种原因导致的骨髓造血功能衰竭,临床以贫血、感染发热、出血为主要表现,其发病率呈逐年上升的趋势。本研究旨在分析AA患者发生糖尿病的危险因素,为临床治疗及预防提供帮助。现报道如下。
1 对象与方法
1.1 研究对象 选取自2017年6月至2021年6月于河北北方学院附属第一医院接受治疗的50例AA患者为研究对象,其中,非重型AA患者48例,重型AA患者2例,中位随访时间1.8年(1~3年)。2例重型AA患者随访时间分别为1.0年和1.2年,第1例重型AA患者因至其他医院就诊而失访,其余患者至末次随访均存活。根据患者是否患糖尿病将其分为观察组与常规组。观察组9例非重型AA患者均诊断为糖尿病,常规组41例患者均无糖尿病。本研究经医院伦理委员会批准。患者均签署知情同意书。
1.2 诊断标准 AA的诊断按2017年中国专家共识[1]确诊:(1)全血细胞减少,淋巴细胞比例增高;(2)多部位骨髓增生减低或重度减低;(3)骨髓活检,全切片增生减低,造血组织减少,脂肪组织和(或)非造血细胞增多;(4)除外其他骨髓造血衰竭综合征。糖尿病诊断标准:空腹血糖≥7.0 mmol/L或餐后2 h血糖≥11.1 mmol/L诊断为糖尿病[2]。
1.3 研究方法 AA的治疗措施:(1)所有患者给予环孢素、司坦唑醇、细胞因子等治疗,环孢素的用量为3~5 mg/(kg·d)。因经济原因,2例重型AA患者未选择抗胸腺细胞球蛋白或骨髓移植治疗。(2)对症支持治疗,血红蛋白<60 g/L者(老年或耐受力差者为80 g/L),给予红细胞输注;血小板<20×109个/L者,给予血小板输注。输注血制品前,常规使用扑尔敏预防输血反应。收集并比较两组患者的资料,包括年龄、性别、体质量指数、糖尿病家族史、环孢素浓度、血常规、空腹血糖、餐后2 h血糖、血清铁蛋白、甘油三酯及红细胞输注量等。
2 结果
2.1 AA合并糖尿病的发病情况 50例AA患者中,并发糖尿病者9例,发病率为18.0%(9/50),确诊AA至确诊糖尿病的中位时间为1.7年(0.8~2.6年);空腹血糖为(10.6±2.4)mmol/L,餐后2 h血糖为(17.4±4.8)mmol/L;6例患者无典型的糖尿病表现,仅3例出现口干、多饮、多尿、消瘦等症状。
2.2 AA合并糖尿病潜在危险因素的单因素分析 单因素分析显示,观察组与常规组患者的年龄、性别、体质量指数及血红蛋白浓度比较,差异无统计学意义(P>0.05);而两组患者的有糖尿病家族史患者比例、环孢素浓度、血清铁蛋白水平、甘油三酯水平及红细胞输注量比较,差异均有统计学意义(P<0.05)。见表1。
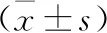
表1 AA合并糖尿病潜在危险因素的单因素分析
2.3 AA合并糖尿病危险因素的多因素分析 将糖尿病家族史、环孢素浓度、血清铁蛋白水平、甘油三酯水平及红细胞输注量等5项潜在危险因素纳入Logistic多因素回归分析,结果发现,环孢素浓度(相对危险度=1.46,95%可信区间1.21~1.63,P=0.004)、血清铁蛋白水平(相对危险度=1.32,95%可信区间1.14~1.58,P=0.005)、甘油三酯水平(相对危险度=1.09,95%可信区间1.02~1.15,P=0.011)及红细胞输注量(相对危险度=1.27,95%可信区间1.13~1.52,P=0.005)是引起糖尿病发生的危险因素,而糖尿病家族史则不是引起糖尿病的独立危险因素。
3 讨论
AA是一种免疫介导的造血功能衰竭性疾病,主要表现为造血组织被脂肪组织替代,导致外周血全血细胞减少[3]。我国AA年发病率为7.4/1 000 000,好发于青年及老年人。目前认为,AA的发病机制是活化的细胞毒T细胞直接损伤造血干细胞,同时分泌造血负调控因子(γ干扰素和肿瘤坏死因子等)抑制造血。在治疗方面,以免疫抑制剂、造血干细胞移植、促进造血及对症支持治疗为主,其中,环孢素是常用的免疫抑制剂之一,适用于各型AA。AA患者因全血细胞减少,免疫力低下,极易发生感染,一旦合并糖尿病,不仅会增加患者感染的风险,而且会因高血糖损伤多器官的功能,严重影响患者的生活质量。本研究中50例AA患者,糖尿病的发生率为18.0%。AA合并糖尿病的发生与多种因素有关。本研究结果发现,发生糖尿病的主要影响因素包括环孢素浓度、血清铁蛋白水平、甘油三酯水平及红细胞输注量。
环孢素是一种有效的钙调磷酸酶免疫抑制剂[4],其可致胃肠道反应、肝肾功能损害、血糖升高、高血压、多毛症、牙龈增生等不良反应,其中,糖尿病是较为严重的并发症。2018年发表的多中心研究结果显示,无糖尿病的肾移植患者应用环孢素1年后,糖尿病发生率约为6.3%[5]。其发生机制包括:(1)直接抑制胰岛β细胞的mRNA合成,导致β细胞功能障碍,从而抑制胰岛素分泌;(2)增加骨骼肌和脂肪组织中胰岛素抵抗,同时减少葡萄糖的利用[6-7]。另外,器官移植后新发糖尿病患者的环孢素用量和全血浓度显著高于非移植后新发糖尿病患者,且随着环孢素全血浓度的升高,糖尿病发生率也随之升高,两者呈正相关,因此认为环孢素全血浓度与糖尿病的发生关系密切[8]。本研究同样发现环孢素浓度为AA合并糖尿病的独立危险因素,因此应定期监测患者的环孢素浓度及血糖,预防并尽早发现糖尿病;同时对AA合并糖尿病的患者,应调整环孢素用量,找出最佳浓度,既可以治疗AA,又可以有效控制血糖。
铁蛋白是一种高分子量含铁蛋白,作为贮存铁复合物在体内发挥作用。部分AA患者因贫血严重,需要长期输血治疗,输血量的增加导致患者血清铁蛋白水平升高,甚至达到铁过载标准(铁蛋白>1 000 μg/L)。有研究报道,地中海贫血患者因长期输血导致铁过载,糖尿病的发生率较高,约为26.8%[9]。其发病机制考虑为由于铁元素沉积在胰腺、肝、心脏等多种器官,造成胰腺β细胞损伤,胰岛素分泌功能受损,同时因肝纤维化引起胰岛素抵抗,最终导致糖代谢紊乱[9-10]。机体铁储存量越多,发生葡萄糖耐量异常、糖尿病的风险就越大,因此,铁过载被认为是糖尿病发病的一个独立危险因素[11],与本研究结果一致。祛铁治疗可以降低铁负荷,有助于医治与铁负荷相关的胰岛素抵抗,提高胰岛素的敏感性,可更好地控制糖尿病患者的血糖水平,改善或逆转糖尿病的相关症状[12-14]。因此,对出现铁过载的AA患者,应严格掌握输血指征,积极予以祛铁治疗,减少糖尿病的发生。
有研究报道,高甘油三酯血症患者发生糖尿病的风险约是正常血脂者的2.30倍[15]。本研究结果显示,高甘油三酯是AA合并糖尿病的另一独立危险因素,其发生机制考虑与糖异生和胰岛素抵抗有关。当体内甘油三酯水平升高时,脂肪动员加强,经糖代谢途径异生为糖,导致体内血糖水平升高;同时,游离脂肪酸及其代谢产物水平增高,在肝、肌肉及胰岛β细胞内沉积,从而抑制胰岛素信号转导,导致胰岛素抵抗,最终出现糖尿病[16-17]。因此监测甘油三酯水平有助于评估胰岛素抵抗,识别糖尿病高危人群,提早干预,预防糖尿病的发生。
综上所述,AA患者易合并糖尿病,其中,环孢素浓度、血清铁蛋白水平、甘油三酯水平及红细胞输注量可能是影响糖尿病发生的危险因素。应定期监测AA合并糖尿病患者的环孢素浓度、血清铁蛋白水平及甘油三酯水平,及时调整环孢素用量,严格控制输血量,必要时予以祛铁及降脂治疗,预防糖尿病的发生。

