放疗前血红蛋白与红细胞分布宽度比值对Ⅲ、Ⅳ期非小细胞肺癌患者预后价值研究
王 畅, 房 咏, 周 洁, 徐 莹, 任 雪, 姜 曈, 阎 英
1.锦州医科大学 北部战区总医院 研究生培养基地,辽宁 沈阳 110016;2.北部战区总医院 放射治疗科,辽宁 沈阳 110016
目前,初诊非小细胞肺癌(non-small-cell lung cancer,NSCLC)患者中约20%为早期,约25%为局部晚期,约55%已发生远处转移[1-2]。放疗作为治疗肺癌的主要方法之一,为了在早期预测放疗疗效,寻找有效的预测指标来指导治疗和评估预后尤为重要。血红蛋白(hemoglobin,HB)、红细胞分布宽度(red blood cell distribution width,RDW)、中性粒细胞与淋巴细胞比值、血小板计数与淋巴细胞比值等指标易常规获取且经济实用,并能够有效预测肿瘤患者的预后,是近年来研究的热点[3-5]。HB与RDW的比值(hemoglobin-to-red blood cell distribution width ratio,HRR)与多种实体器官肿瘤的预后存在相关性,如头颈部肿瘤、胃癌、小细胞肺癌等[6-9],但有关HRR与肺癌放疗疗效和预后的研究鲜有报道。本研究旨在探讨放疗前HRR对Ⅲ、Ⅳ期NSCLC患者的预后价值。现报道如下。
1 对象与方法
1.1 研究对象 选取北部战区总医院放射治疗科自2014年1月至2019年6月收治的接受放疗的186例Ⅲ、Ⅳ期NSCLC患者为研究对象。纳入标准:经影像学、组织病理学证实为NSCLC;首次接受并完成放疗;东部肿瘤协作组体力状态评分为0~2分;放疗前1周内接受血常规检查,并计算得出HRR。排除标准:其他恶性肿瘤病史者;合并基础肝、肾、心脏疾病;合并血液系统疾病或自身免疫性疾病;曾接受长期激素治疗;在采集血液样本前感染。本研究经医院伦理委员会批准。所有患者均签署知情同意书。
1.2 治疗方法 所有患者均采用6 MV直线加速器X线进行胸部放疗。通过CT模拟机定位,CT图像传输至放射治疗计划系统后,进行肿瘤靶区勾画,处方剂量为50~69 Gy,分20~33次,单次剂量为1.8~3.0 Gy,1次/d,5次/周。靶区处方剂量应给在计划靶区上,并至少包括95%的计划靶区,其他正常器官限量在可接受范围内。主要化疗方案为以铂类为基础,联合依托泊苷/多西他赛/培美曲塞/紫杉醇的方案。化疗周期为2~6个周期(中位数为4个周期)。化疗时间间隔为3~4周,剂量均在标准剂量范围内。利用受试者工作特征(receiver operating characteristic,ROC)曲线确定HRR的最佳界值,并根据最佳界值将患者分为低HRR组(HRR≤1.037)与高HRR组(HRR>1.037)。
1.3 观察指标及疗效评价标准 所有患者的随访信息通过住院期间检查、门诊复查及电话随访获得,随访截止时间为2020年9月。观察并记录两组患者的生存情况,包括近期和远期疗效。近期疗效评价遵循RECIST 1.1标准[10]:完全缓解(complete response,CR),肺内所有病灶消失,至少维持4周;部分缓解(partial response,PR),与基线病灶相比,靶病灶最长径之和至少缩小30%;疾病稳定(stable disease,SD),靶病灶与基线病灶相比病灶长径总和有缩小但未达PR或有增加但未达PD;疾病进展(progressive disease,PD),靶病灶与基线病灶相比其长径总和增加超过20%或出现一个或多个新发病灶。远期疗效观察两组患者总生存期(overall survival,OS)与无进展生存期 (progression-free survival,PFS)。

2 结果
2.1 生存情况 截至2020年9月,患者中位OS为21.3(95%可信区间18.1~24.6)个月,中位PFS为8.7(95%可信区间6.8~10.6)个月。1、3、5年存活率分别为69.4%(129/186)、28.0%(52/186)、19.4%(36/186),1、3、5年无进展存活率分别为42.5%(79/186)、18.8%(35/186)、14.5%(27/186)。
2.2 放疗前HRR与肿瘤进展关系 ROC曲线最佳界值为1.037,见图1。根据HRR最佳界值将患者分为低HRR组(HRR≤1.037,n=144)与高HRR组(HRR>1.037,n=42)。
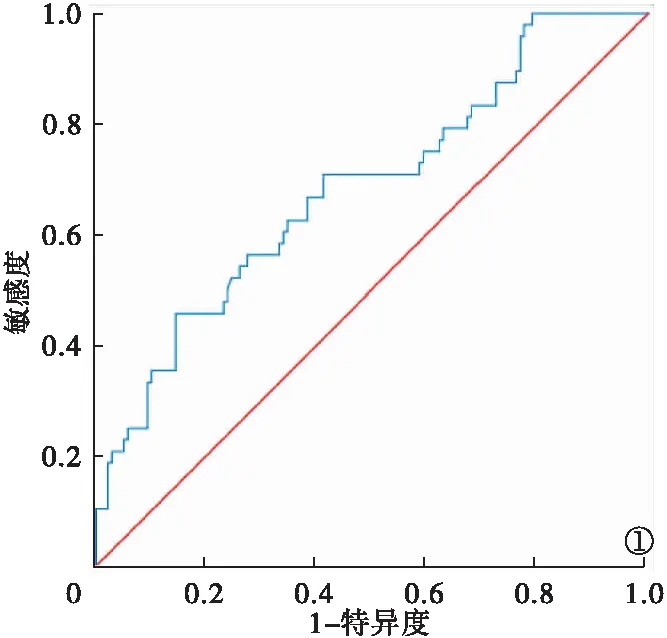
图1 放疗前HRR与肿瘤进展关系ROC曲线
2.3 放疗前HRR与临床病理特征关系ROC曲线 两组患者性别、T分期、治疗方式、放疗结束后4周近期疗效、放疗前HB、放疗前RDW比较,差异均有统计学意义(P<0.05);两组患者年龄、放疗剂量、吸烟、肿瘤原发位置、病理类型、N分期、临床分期比较,差异均无统计学意义(P>0.05)。见表1。

表1 放疗前HRR与临床病理特征关系/例(百分率/%)
2.4 两组患者OS、PFS比较 高HRR组的OS、PFS均长于低HRR组,差异均有统计学意义(P<0.05)。见图2~3。
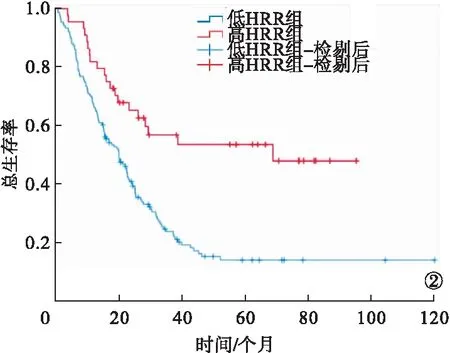
图2 低HRR组和高HRR组OS曲线
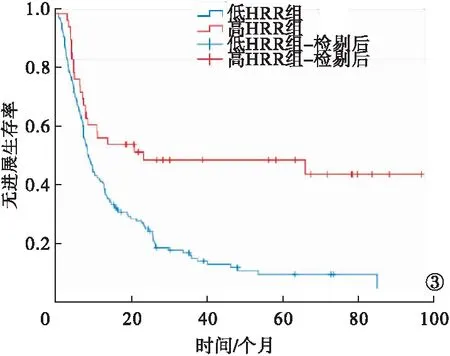
图3 低HRR组与高HRR组PFS曲线
2.5 单因素及多因素Cox 回归分析 单因素分析显示:T分期、N分期、临床分期、放疗前HB、RDW、HRR均与患者的OS有关(P<0.05);T分期、N分期、临床分期、治疗方式、HB、RDW、HRR均与患者的PFS有关(P<0.05)。多因素Cox 回归分析显示:临床分期、放疗前HRR为OS和PFS的独立预后因素(P<0.05)。见表2。
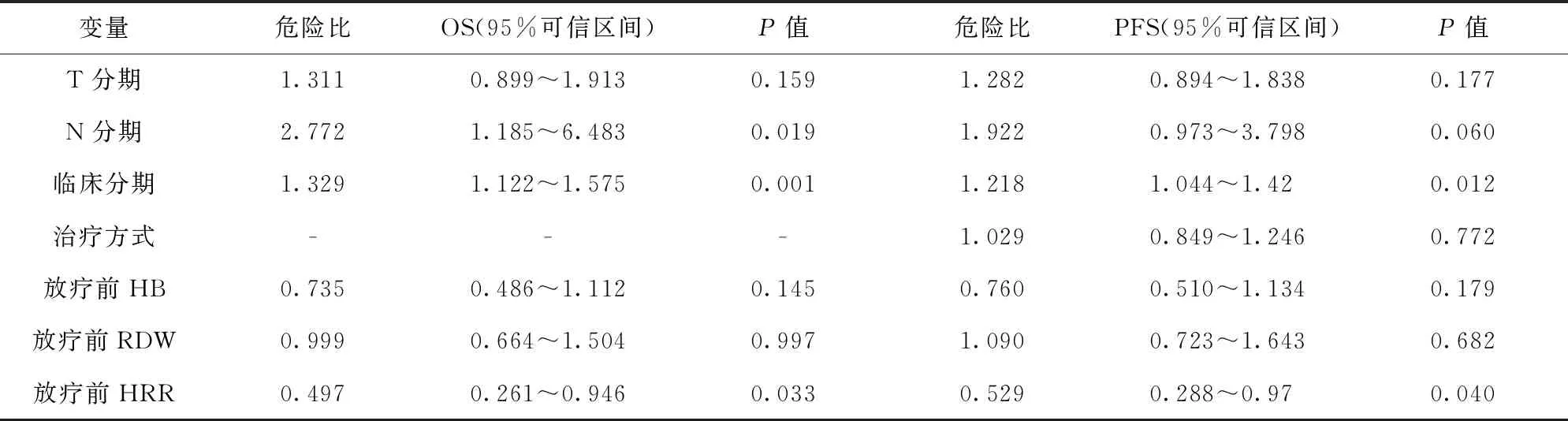
表2 NSCLC患者OS和PFS多因素Cox回归分析
3 讨论
肺癌为目前全球发病率与病死率较高的恶性肿瘤之一,每年约有超过160万死亡患者,给患者带来严重的生命健康威胁及经济压力[11-13]。近年来,放疗在治疗肺癌方面取得显著进展,但晚期患者存活率仍然较低,因此,我们需要有效的预测指标来指导个体化治疗,改善患者预后。癌症相关性贫血是一个与癌症的营养、代谢和免疫成分有关的多因素综合征,与癌症的进展及严重程度均相关[14]。贫血导致肿瘤患者预后较差的可能原因为HB是红细胞内携带氧气的主要分子,其浓度降低导致肿瘤细胞缺氧,通过调节基因表达,刺激肿瘤生长,促进肿瘤血管生成,并可能通过提升肿瘤细胞对放疗和化疗的抗性,降低治疗效果,从而导致癌症进展及患者OS缩短[15-16]。另外,肿瘤细胞分泌的细胞因子,如白细胞介素-6与肿瘤坏死因子-α等,通过诱导红系祖细胞处于低增殖状态,导致其分化和增殖不足,造成促红细胞生成素生成减少,从而使得HB水平降低[17-18]。
RDW对于预测肿瘤患者预后不良的潜在机制尚未明确,可能与全身炎症反应和营养状态有关[19-20]。有研究发现,RDW与多种炎症标志物密切相关,如C-反应蛋白、白细胞介素-6、肿瘤坏死因子等[21-22]。炎症通过影响铁代谢,抑制促红细胞生成素的合成,或通过缩短红细胞存活时间,削弱红细胞成熟度,改变红细胞循环半衰期和红细胞膜变形性,导致大量未成熟红细胞从骨髓进入外周血液循环,这一现象导致参与外周血液循环反应的红细胞大小发生变化,造成RDW水平升高[23-25]。肿瘤的发生和发展会使人体进入恶病质状态,以铁、叶酸和维生素B12缺乏为特征,进而影响体内RDW的水平[26]。
本研究结果显示,高HRR组的 OS、PFS均长于低HRR组,差异均有统计学意义(P<0.05)。这表明,两组患者预后相差较大,高水平的HRR生存预后较好。本研究结果显示,单因素分析显示:T分期、N分期、临床分期、HB、RDW、HRR均与患者的OS有关(P<0.05);T分期、N分期、临床分期、治疗方式、HB、RDW、HRR均与患者的PFS有关(P<0.05)。多因素分析结显示:放疗前HRR为OS和PFS的独立预后因素(P<0.05)。以上结果表明,HRR可作为评估NSCLC患者预后的有效预测指标,对指导患者个体化治疗具有重要临床意义。
综上所述,与HB和RDW相比,HRR可以最大限度地减少潜在的偏差,更客观地反映营养状态,在预测肺癌患者的OS和PFS方面具有更好的预后价值。但本研究样本量相对较小,容易导致选择偏差,未来还需要进行更多的前瞻性研究,进一步验证HRR的预后价值。

