CD28基因在爆震致肠道损伤中作用及机制
刘 颖, 丛培芳, 史秀云, 马瑞珩, 金红旭
北部战区总医院 急诊医学科,辽宁 沈阳 110016
爆炸可造成机体多器官损伤,其严重程度与爆炸物的类型和数量、距离爆炸点的距离、爆炸环境、受害者的防护情况及健康状况等有关[1]。爆炸瞬间冲击波作用于不同密度交界面后,通过内爆、剥落、惯性、负压等效应导致组织器官损伤,其中以空腔器官(如耳、肺、胃肠等)损伤最为严重[2-3]。0.3%~0.6%爆震伤幸存者会发生胃肠道损伤,出现不同性质和强度的疼痛、恶心、呕吐、腹泻、里急后重、便血、呕血、肠鸣音消失、压痛、反跳痛等。胃肠道冲击伤还会导致延迟性胃肠道穿孔。爆震致肠道损伤常被脑、胸部及四肢等严重损伤所掩盖,造成诊断延误。但目前对爆震致肠道损伤的特点、相关基因和蛋白在其中的作用及机制尚不清楚[4-5]。本研究旨在探讨CD28基因在爆震致肠道损伤中的作用及机制。现报道如下。
1 材料与方法
1.1 实验动物 16只健康雄性C577BL/6小鼠购自辽宁长生生物科技有限公司;16只健康雄性CD28基因敲除小鼠来自杰克逊实验室(萨克拉门托,美国)。小鼠体质量(22±3)g,适应性饲养7 d后,将C577BL/6小鼠随机分入正常对照组(n=8)和爆震伤模型组(n=8),将CD28基因敲除小鼠随机分入CD28基因缺失组(n=8)和PI3K抑制剂组(n=8)。模型建立时,爆震伤模型组、CD28基因缺失组、PI3K抑制剂组小鼠腹部直接接受冲击波损伤,实验瞬时冲击波超压为(342±32)PSI。PI3K抑制剂组Ly294002通过小鼠腹腔注射100 mM溶于100 μl生理盐水。
1.2 小鼠观察和体质量测量 模型建立前后每日观察小鼠状态,模型建立前后每日测量小鼠体质量2次并取得平均值,记录小鼠体质量变化趋势。
1.3 HE染色 爆震48 h后,取各组小鼠肠道组织,生理盐水清洗后置于福尔马林中固定,脱水包埋并切成5 μm厚组织切片,梯度脱蜡后,苏木素染色3.0 min,伊红染液染色1.5 min,二甲苯和梯度酒精透明,封片后显微镜下观察并拍照。
1.4 TUNEL检测 爆震48 h后,取各组小鼠肠道组织,生理盐水清洗后置于福尔马林中固定,脱水包埋并切成4 μm厚组织切片,根据TUNEL检测试剂盒说明书步骤进行染色,荧光显微镜下观察并拍照。
1.5 Western-blot检测 取冻存肠道组织提取总蛋白进行浓度测定后,进行SDS-聚丙烯酰胺凝胶电泳,转模封闭后,分别用丙二醛(malonaldehyde,MDA)(Rabbit monoclonal,1∶1 000)、超氧化物歧化酶(superoxide dismutase,SOD)-1(Rabbit monoclonal,1∶1 000)、SOD-2(Rabbit monoclonal,1∶1 000)、Phospho-PI3 Kinase p85(Rabbit monoclonal,1∶1 000)、AKT(Rabbit monoclonal,1∶1 000)、Nrf2(Rabbit monoclonal IgG,1∶1 000)及GAPDH(Mouse monoclonal IgG,1∶1 000)4℃孵育过夜,相应二抗室温孵育1.5 h后采用ECL发光系统进行蛋白显影及灰度测定。

2 结果
2.1 小鼠观察和体质量测量 建模前:各组小鼠状态良好,饮食和排便正常。建模后:爆震伤模型组小鼠活动减少,无排便或排便稀软;与爆震伤模型组比较,CD28基因缺失组小鼠活动状态和排便趋于正常;PI3K抑制剂组状态与爆震伤模型组接近。爆震伤模型组小鼠建模前和建模后24、48 h的体质量分别为(23.7±3.5)g、(19.3±2.8)g、(18.4±2.9)g,呈持续降低趋势(P<0.05);CD28基因缺失组小鼠建模前和建模后24、48 h的体质量分别为(23.1±2.6)g、(22.2±3.7)g、(23.8±3.3)g,先降低后升高,比爆震伤模型组更趋近于正常(P<0.05);PI3K抑制剂组小鼠建模前和建模后24、48 h的体质量分别为(23.5±3.2)g、(19.6±3.1)g、(18.9±2.5)g,变化趋势与爆震伤模型组相近(P>0.05)。
2.2 HE染色和TUNEL检测结果 爆震伤模型组小鼠肠道黏膜结构松散破坏,可见明显肠道损伤,绒毛发生萎缩和断裂,炎症细胞浸润明显,上皮样腺体数量减少;CD28基因缺失组小鼠肠道组织结构趋向于正常,形态结构相对整齐,与爆震伤模型组比较,炎症细胞浸润减少,肠道绒毛高耸,上皮、黏膜及绒毛损伤减轻;PI3K抑制剂组小鼠肠道变化趋近于爆震伤模型组。爆震伤模型组小鼠凋亡细胞的红色荧光强度高于CD28基因缺失组,即爆震可致小鼠肠道组织凋亡损伤;PI3K抑制剂组小鼠肠道组织凋亡损伤程度趋近于爆震伤模型组。见图1。
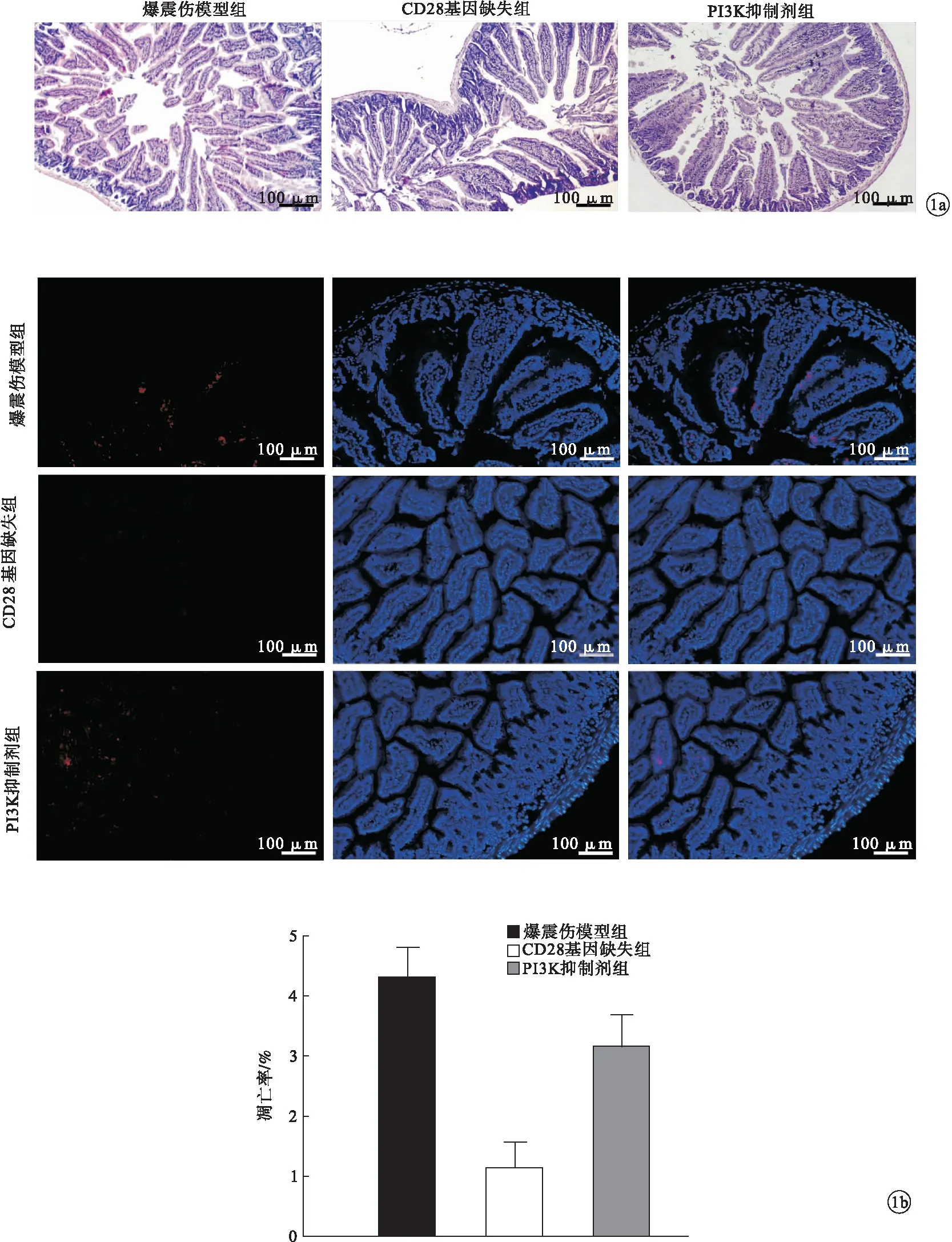
图1 HE染色和TUNEL检测结果(a.HE染色,b.TUNEL检测)
2.3 Western-blot检测 与正常对照组小鼠比较,爆震伤模型组肠道组织中MDA蛋白表达升高,SOD-1和SOD-2蛋白表达降低(P<0.05);与爆震伤模型组小鼠比较,CD28基因缺失组MDA蛋白表达降低,SOD-1和SOD-2蛋白表达升高(P<0.05);PI3K抑制剂组MDA、SOD-1、SOD-2蛋白表达趋近于爆震伤模型组(P>0.05)。见图2。与正常对照组小鼠比较,爆震伤模型组肠道组织中PI3K、AKT、Nrf2通路蛋白表达升高(P<0.05);与爆震伤模型组小鼠比较,CD28基因缺失组PI3K、AKT、Nrf2通路蛋白表达升高(P<0.05);PI3K抑制剂组小鼠PI3K、AKT、Nrf2通路蛋白表达低于CD28基因缺失组(P<0.05),趋近于爆震伤模型组(P>0.05)。见图3。
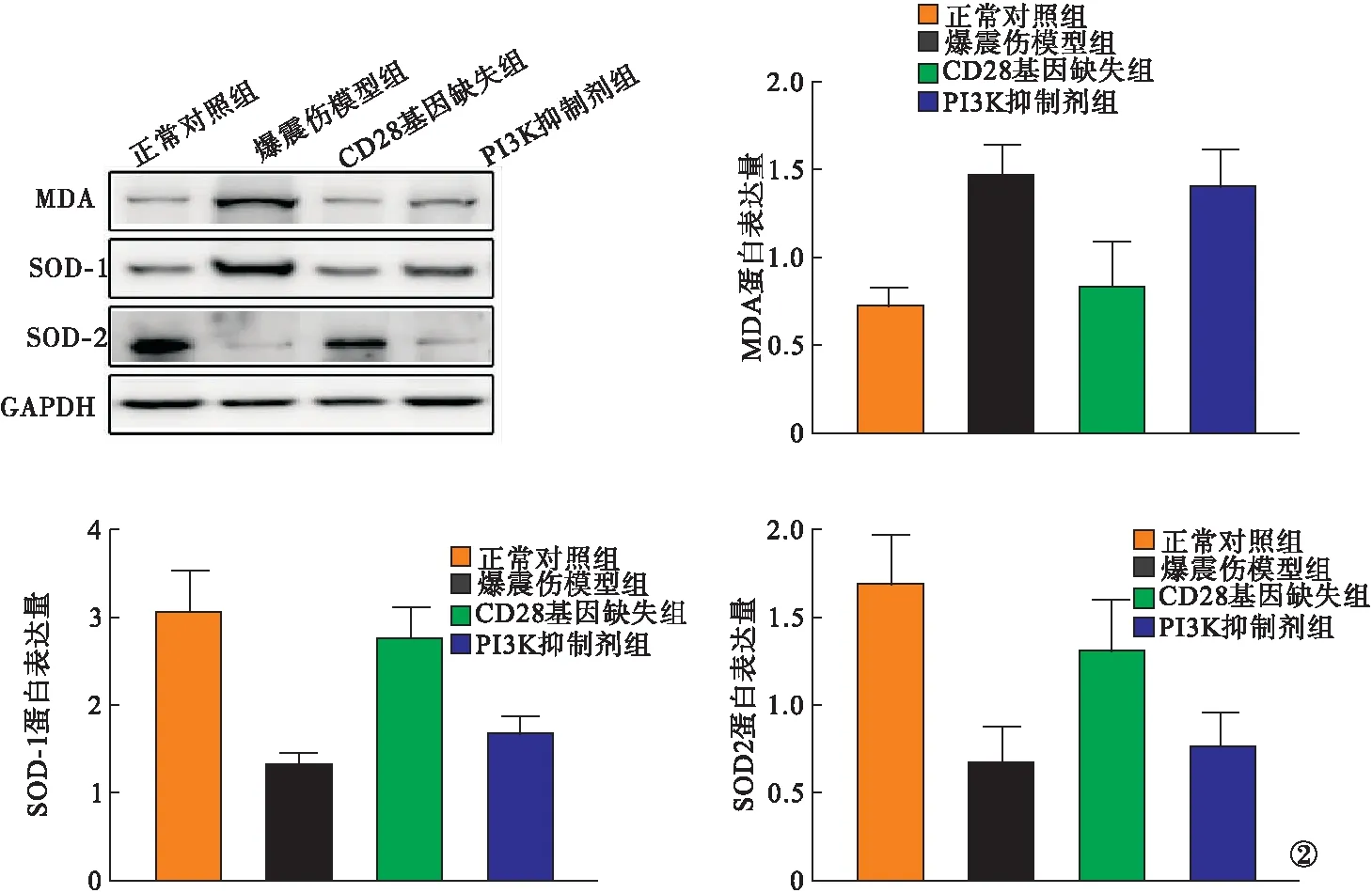
图2 各组MDA、SOD-1、SOD-2蛋白表达
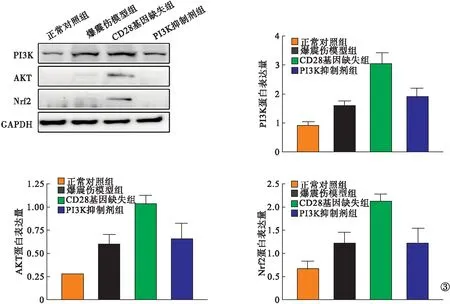
图3 各组PI3K、AKT、Nrf2通路蛋白表达
3 讨论
爆震受害者通常具有复杂的临床表现,因其伤害直接或间接地与爆炸产生的冲击波有关。这些伤害取决于爆炸装置的类型、爆炸时的环境、受害者的情况等[6]。爆震冲击波作用于机体可造成空腔脏器的严重损伤,机制较为复杂。体外的爆炸能转化为生物动力能,在超压下对腹部造成损伤;此外,当压力瞬态与机体相互作用时,部分激波被反射,但大多被吸收,软组织、血管及充满空气或液体的腔室(如肺、肠、脑等)之间的界面特别容易受到损伤。脏器发生损伤后,相关的蛋白改变同样在爆震损伤中发挥重要作用[7-8]。CD28是免疫应答启动、维持及下调中的关键因素。有研究表明,CD28可刺激T细胞,除T细胞受体外,还会为各种白细胞介素的产生提供强有力的信号,引发炎症反应瀑布[9]。CD28拮抗剂能够明显降低白细胞介素-6、环氧化酶-2的表达和巨噬细胞的数量,减轻辐射引起的小鼠肠道损伤。既往研究发现,CD28基因缺失可减轻胸部冲击波暴露导致的脑部损伤,因此,CD28基因在冲击波导致的炎症反应、继发的氧化应激和凋亡中均发挥重要作用[10]。本研究同样证实,CD28基因通过PI3K/AKT/Nrf2通路参与爆震致肠道氧化应激和凋亡损伤,且在给予PI3K抑制剂后相关作用减弱。作为细胞内信号转导酶的一个家族,PI3K参与多种细胞功能,如细胞增殖、分化、存活及细胞内运输等。作为一种上游信号,CD28能够募集PI3K、Grb2、Gads等相关蛋白,通过调节一系列抗氧化剂和细胞应激基因参与氧化应激和细胞凋亡反应[11-12]。正常条件下,Nrf2通过快速泛素化和蛋白酶体依赖性降解维持在低水平。活性氧的过度积累会影响多种细胞内信号通路,从而促进细胞解离Nrf2。随后,CAT、TRX、SOD、NADPH脱氢酶醌1等氧化剂和抗氧化酶被进一步激活[13]。本研究中,在爆炸暴露后,肠内氧化酶和抗氧化酶水平发生了明显变化,反映了肠组织中的氧化应激反应,而CD28基因敲除可以减弱这些变化。
综上所述,CD28基因在爆震致肠道损伤中发挥重要作用,其机制可能与PI3K/AKT/Nrf2通路有关,该通路相关蛋白可为爆震致肠道损伤的进一步救治策略研究提供相应基因和蛋白靶点。

