决明子总蒽醌调控Sirt1/PPARγ 通路对H2O2诱导人晶状体上皮细胞氧化损伤的影响
何宇,杨德,严宏
白内障是以晶状体进行性混浊为主要特征的致盲性眼病,是全球中老年群体致盲、视力损害的重要原因,而晶状体混浊主要由晶状体上皮细胞(lens epithelial cell,LEC)损伤引起[1]。研究[2-3]报道,细胞代谢产生的活性氧(reactive oxygen species,ROS)可引起氧化应激反应,造成LEC 损伤,最终导致晶状体细胞发生凋亡或结构改变。目前,手术是治疗白内障的唯一有效方法,但手术并发症、经济费用、地域技术水平限制了白内障手术的开展。因而,通过药物有效拮抗氧化应激引起的LEC 损伤防治白内障越来越引起人们重视[4]。决明子总蒽醌(cassia seed total anthraquinone,CSTA)是决明子的主要有效成分之一,具有降脂、降压、抗炎、抗氧化应激、抗衰老、增强免疫功能等作用[5]。研究[6-7]显示,CSTA 可激活抗氧化应激途径及抗炎途径,介导肝保护作用。沉默信息调节因子1(silent information regulator 1,Sirt1)是第Ⅲ类去乙酰化酶家族成员,可抑制过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARγ)活性发挥抗氧化应激、抗炎作用,参与白内障发病[8-10]。本研究将从Sirt1/PPARγ 通路角度探讨CSTA 对H2O2诱导人LEC 氧化损伤的影响。
1 材料与方法
1.1 试剂与仪器
人LEC 细胞系HLE-B3 细胞(美国ATCC 公司,H-HLE-B3),DMEM 培养基(北京索莱宝科技有限公司,90113),2%CSTA(兰州沃特莱斯生物科技有限公司,WTLS-061112),并由本实验室进一步提取,Sirt1 抑制剂EX527、四甲基偶氮唑盐比色法(methyl thiazolyl tetrazolium assay,MTT)试剂(上海吉至生化科技有限公司,E46900-5 mg、AM1020-500T),实时荧光定量PCR 试剂盒(quantitative real-time PCR,qRT-PCR)、Annexin V-FITC/PI试剂盒(北京百奥莱博科技有限公司,ALH197-VNA、WE0325-HYB),丙二醛(malonydialdehyed,MDA)、谷胱甘肽过氧化物酶(glutathioneperoxidase,GSH-Px)、超氧化物歧化酶(superoxide dismutase,SOD)、酶联免疫(enzyme-linked immunosorbent assay,ELISA)(上海哈灵生物科技有限公司,HL10336、HL10208、HL10249),兔抗Sirt1 抗体、兔抗甘油醛-3-磷酸脱氢 酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、羊抗兔IgG 二抗(美国abcam 公司,ab32441、ab181602、ab6721),兔抗p-PPARγ 抗体、兔抗PPARγ 抗体(美国Bioworld 公司,AP0688、BS4444)。
酶标仪(美国Thermo 公司,MK3),流式细胞仪(美国Millipor 公司,Guauasoft 6L),qRT-PCR 仪(美国QIAGEN 公司,Rotor-Gene Q),凝胶成像系统(美国Bio-Rad 公司,GS-800)。
1.2 细胞培养及分组
用含20%胎牛血清的DMEM 培养基培养HLE-B3 细胞,37℃、5%CO2培养箱中常规培养,细胞接近融合时传代,取对数期细胞进行实验。
HLE-B3 细胞分组和处理的2 种方式:①浓度筛选,分别加入不同梯度终浓度0、5、10、20、40、80、160 mg/L 的CSTA 处理24 h,加入100 μmol/L 的H2O2处理12 h,用于设定后续实验的CSTA 最佳处理浓度;②正式实验,分为对照组(control group,CG组),不进行任何处理;H2O2组,给予100 μmol/L H2O2处理12 h;CSTA 组,给予20 mg/L CSTA 处理24 h 后,再加入100 μmol/L H2O2处理12 h;Sirt1 抑制剂组(EX527 组),给予10 μmol/L EX527 预处理30 min 后,加入20 mg/L CSTA 处理24 h,再加入100 μmol/L H2O2处理12 h。
1.3 MTT 法检测HLE-B3 细胞活力
HLE-B3 细胞以1×105个/孔接种在96 孔板,分别按1.2 中①、②进行分组处理,培养24 h,每孔加20 μL 的MTT 试剂,培养4 h 后弃培养液,每孔加200 μL 二甲基亚砜溶液,常温震荡20 min,用酶标仪(490 nm 波长)测定各孔光密度值(optical density,OD),计算细胞活力。细胞活力=(OD实验组/OD对照组)×100%。
1.4 流式细胞仪检测HLE-B3 细胞凋亡情况
HLE-B3 细胞以1×105个/孔接种在96 孔板,按1.2 中分组②进行处理,培养24 h 收集,调整为1×106个/mL,加AnnexinV-FITC 试剂、PI 试剂各10μL,避光孵育20 min,用流式细胞仪检测细胞凋亡率。
1.5 ELISA 法检测HLE-B3 细胞内MDA、GSH-Px和SOD 表达
HLE-B3 细胞以1×105个/孔接种在96 孔板,按1.2 中分组②进行处理,培养24 h 收集,用细胞裂解液裂解20 min,离心分离上清,用MDA、GSH-Px、SOD 的ELISA 试剂盒处理,在酶标仪上检测MDA、GSH-Px 和SOD 含量。
1.6 qRT-PCR 法检测HLE-B3 细胞内Sirt1、PPARγ mRNA 表达
HLE-B3 细胞以5.0×105个/孔接种在24 孔板,按1.2 中分组②进行处理,培养24 h 收集,提取总RNA 并合成cDNA,按照qRT-PCR 试剂盒说明书配制反应体系,以GAPDH 为内参基因,于qRT-PCR仪上检测Sirt1、PPARγ mRNA 表达水平,结果以2-ΔΔCt法表示,引物序列如表所示(表1)。
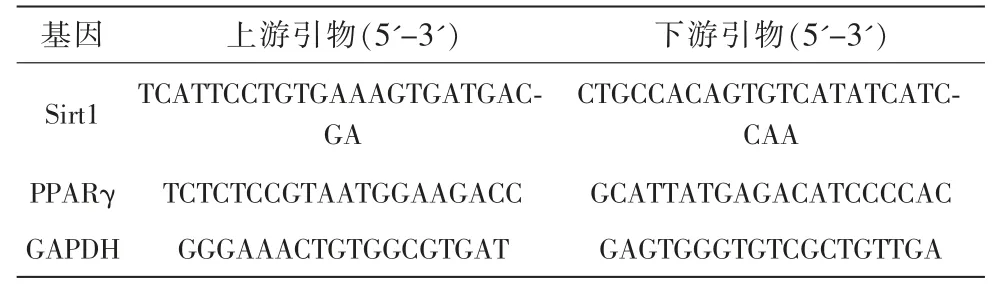
表1 引物序列
1.7 Western Blot 检测HLE-B3 细胞内Sirt1/PPARγ通路相关蛋白水平
HLE-B3 细胞以5.0×105个/孔接种在24 孔板,按1.2 中分组②进行处理,培养24 h 收集,提取总蛋白并定量,将蛋白样品变性、电泳、转膜、封闭后,加入一抗(兔抗Sirt1 抗体、兔抗p-PPARγ 抗体、兔抗PPARγ 抗体、兔抗GAPDH 抗体,稀释比例1∶500、1∶1,000、1∶1,000、1∶400),4℃孵育过夜后,加入二抗(羊抗兔IgG,稀释比例1∶1,000)室温孵育1 h,化学发光显影,扫描图像,以GAPDH 为内参,分析目的蛋白相对灰度值。
1.8 统计学分析
采用SPSS21.0 统计软件对数据进行分析,计量资料数据采用均数±标准差()表示,计量资料采用方差分析(ANOVA)进行多组变量间的相互比较,两两比较采用LSD-t 检验,当P<0.05 时被认为差异有统计学意义。
2 结果
2.1 不同CSTA 浓度对H2O2 诱导的HLE-B3 细胞活力的影响
不同CSTA 浓度组细胞活力比较,差异有统计学意义(F=60.402,P=0.000)。组间两两比较,与0 mg/L相比,5、10、20、40、80、160 mg/L CSTA 均可显著提高H2O2诱导的HLE-B3 细胞活力(t5=5.980,t10=10.261,t20=14.555,t40=16.334,t80=16.052,t160=15.091,均P=0.000)。随着CSTA 浓度的升高,H2O2诱导的HLE-B3细胞活力在0~20 mg/L 范围内两相邻浓度的变化差异有统计学意义(0~5mg/L:t=5.980,P=0.000;5~10mg/L:t=4.333,P=0.001;10~20 mg/L:t=3.934,P=0.003),在20 mg/L~160 mg/L 范围内两相邻浓度的变化差异均无统计学意义(P>0.05)。故选择20 mg/L 作为后续实验的CSTA 处理浓度(表2)。
表2 不同CSTA 浓度对H2O2 诱导HLE-B3 细胞细胞活力比较(,n=6)
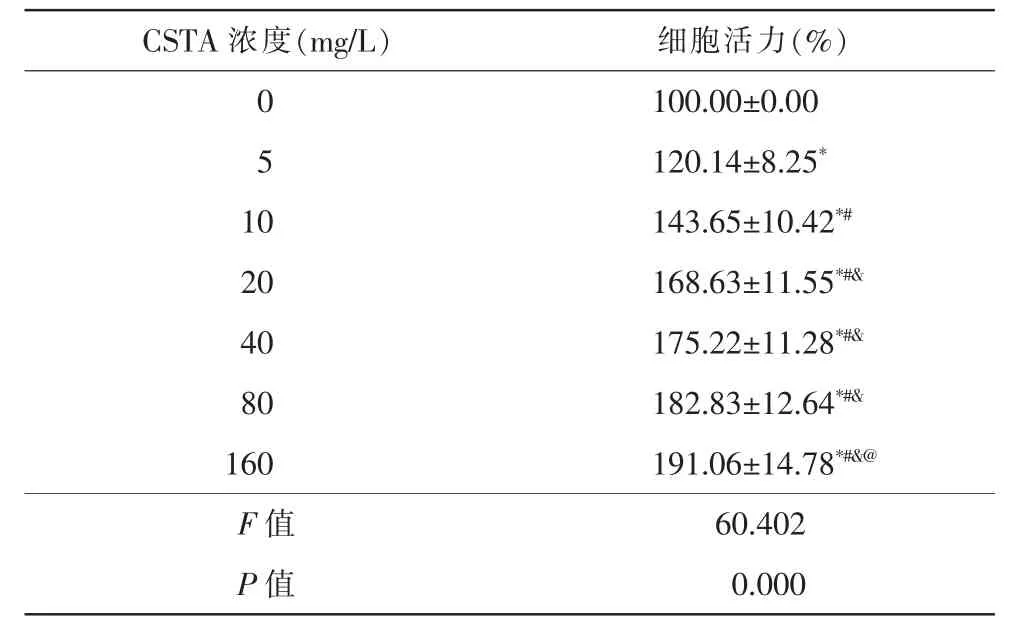
表2 不同CSTA 浓度对H2O2 诱导HLE-B3 细胞细胞活力比较(,n=6)
注:* 与0 mg/L 相比,P<0.05;# 与5 mg/L 相比,P<0.05;&与10 mg/L相比,P<0.05;@ 与20 mg/L 相比,P<0.05。CSTA 决明子总蒽醌
2.2 CSTA 对HLE-B3 细胞活力的影响
4 组细胞活力比较,差异有统计学意义(F=104.043,P=0.000)。组间两两比较,与CG 组(100.00±0.00)%相比,H2O2组HLE-B3 细胞活力(36.58±6.74)%显著降低(t=23.048,P=0.000);与H2O2组相比,CSTA 组(62.53±8.96)%显著升高(t=5.669,P=0.000);与CSTA 组相比,EX527 组(42.14±8.03)%降低(t=4.151,P=0.002),均有统计学意义。
2.3 CSTA 对HLE-B3 细胞凋亡的影响
4 组细胞凋亡比较,差异有统计学意义(F=143.552,P=0.000)。组间两两比较,与CG 组(7.32±1.96)%相比,H2O2组HLE-B3 细胞凋亡率(31.84±2.68)%显著升高(t=18.480,P=0.000);与H2O2组相比,CSTA 组凋亡率(19.01±2.15)%显著降低(t=9.670,P=0.000);与CSTA 组相比,EX527 组凋亡率(29.60±2.34)%升高(t=7.982,P=0.000),均有统计学意义(图1)。

图1 决明子总蒽醌对HLE-B3 细胞凋亡的影响。1A 对照组;1B H2O2 组;1C 决明子总蒽醌组;1D 沉默信息调节因子1 抑制剂组
2.4 CSTA 对HLE-B3 细胞内MDA、GSH-Px 和SOD表达的影响
4 组MDA、GSH-Px 和SOD 表达比较,差异均有统计学意义(FMDA=76.167,FGSH-Px=104.781,FSOD=100.392,均P=0.000)。两两比较,与CG组相比,H2O2组HLE-B3 细胞内MDA 含量显著升高(t=13.040,P=0.000),GSH-Px、SOD 含量显著降低(tGSH-Px=15.220,tSOD=14.930,均P=0.000)。与H2O2组相比,CSTA 组HLE-B3 细胞内MDA 含量显著降低(tCSTA=9.602,P=0.000),GSH-Px、SOD 含量显著升高(tGSH-Px=11.810,tSOD=11.150,均P=0.000)。与CSTA 组相比,EX527 组HLE-B3 细胞内MDA 含量显著升高(t=7.575,P=0.000),GSH-Px、SOD 含量显著降低(tGSH-Px=9.090、tSOD=8.783,均P=0.000),均有统计学意义(表3)。
表3 对HLE-B3 细胞内MDA、GSH-Px 和SOD 的影响(,n=6)
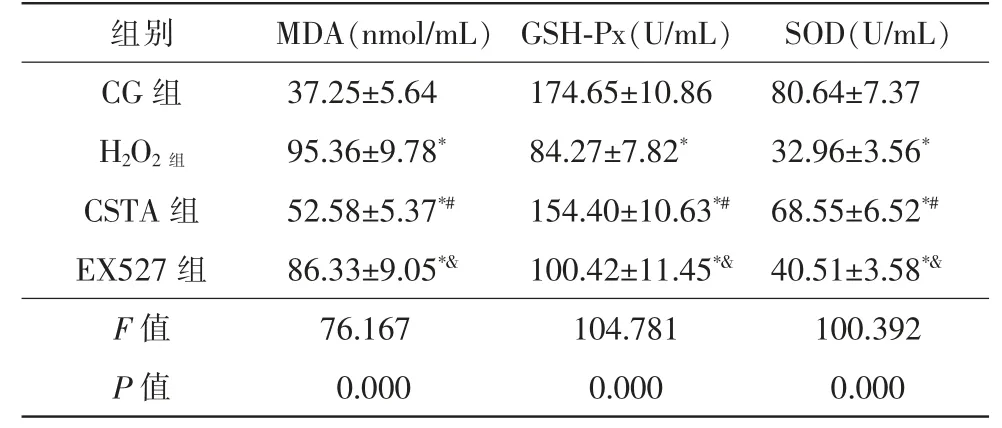
表3 对HLE-B3 细胞内MDA、GSH-Px 和SOD 的影响(,n=6)
注:* 与CG 组相比,P<0.05;# 与H2O2 组相比,P<0.05;&与CSTA 组相比,P<0.05。CG 对照组;H2O2 过氧化氢组;CSTA 决明子总蒽醌组;EX527 沉默信息调节因子1 抑制剂组;MDA 丙二醛;GSHPx 谷胱甘肽过氧化物酶;SOD 超氧化物歧化酶
2.5 CSTA 对HLE-B3 细胞内Sirt1、PPARγ mRNA表达的影响
4 组间HLE-B3 细胞内PPARγ mRNA 水平,差异无统计学意义(P>0.05)。4 组Sirt1mRNA 表达比较,有统计学意义(F=182.439,P=0.000)。与CG 组相比,H2O2组Sirt1mRNA 水平显著降低(t=33.803,P=0.000)。与H2O2组相比,CSTA 组Sirt1 mRNA 水平显著升高(t=13.561,P=0.000)。与CSTA组相比,EX527组Sirt1 mRNA 水平显著降低(t=10.312,P=0.000),均有统计学意义(表4)。
2.6 CSTA 对HLE-B3 细胞内Sirt1/PPARγ 通路相关蛋白表达的影响
4组间HLE-B3细胞内Sirt1蛋白表达比较,差异有统计学意义(F=54.370,P=0.000)。4组间p-PPARγ/PPARγ 蛋白表达比较,差异有统计学意义(F=127.554,P=0.000)。与CG组相比,H2O2组HLE-B3 细胞内Sirt1 蛋白水平显著降低(t=11.000,P=0.000),p-PPARγ/PPARγ 蛋白水平显著升高(t=16.410,P=0.000)。与H2O2组相比,CSTA 组HLE-B3 细胞内Sirt1 蛋白水平显著升高(t=7.667,P=0.000),p-PPARγ/PPARγ 蛋白水平显著降低(t=13.060,P=0.000)。与CSTA 组相比,EX527组HLE-B3细胞内Sirt1蛋白水平显著降低(t=6.333,P=0.000),p-PPARγ/PPARγ蛋白水平显著升高(t=10.630,P=0.000),均有统计学意义(图2、表4)。

图2 决明子总蒽醌对HLE-B3 细胞内Sirt1、p-PPARγ、PPARγ 蛋白表达的影响
表4 决明子总蒽醌对HLE-B3 细胞内Sirt1、PPARγ mRNA表达的影响(,n=6)
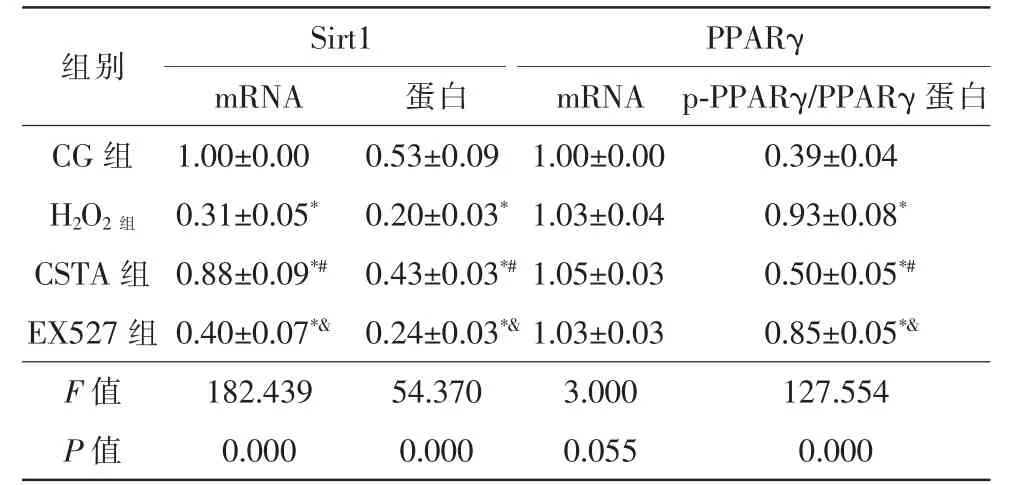
表4 决明子总蒽醌对HLE-B3 细胞内Sirt1、PPARγ mRNA表达的影响(,n=6)
注:* 与CG 组相比,P<0.05;# 与H2O2 组相比,P<0.05;&与CSTA 组相比,P<0.05。CG 对照组;H2O2过氧化氢组;CSTA 决明子总蒽醌组;EX527 Sirt1 抑制剂组;Sirt1 沉默信息调节因子1;PPARγ 过氧化物酶体增殖物激活受体γ
3 讨论
白内障是严重危害中老年人眼部健康的致盲性眼病,近年来随着老龄化社会的到来,其危害越来越受到人们重视。目前白内障发病机理尚不完全明确,相关假说有氧化应激损伤学说、细胞凋亡学说、醌体学说、琉基理论、离子转运障碍学说、内分泌紊乱学说等[11]。近年来,细胞凋亡在各种疾病的进展机制方面的研究取得了巨大进展。越来越多的证据表明,氧自由基损伤导致的LEC 凋亡是除了先天性白内障以外的各种类型白内障发生的共同机制[12]。在正常生理条件下,晶状体内氧自由基的生成与消除是平衡的。但发生氧化应激时,细胞内氧自由基清除能力明显下降,聚集过量会导致LEC 发生氧化损伤并触发细胞凋亡[13]。H2O2是引起氧化应激的危险因子之一,本研究以HLE-B3 细胞为研究对象,利用H2O2建立细胞的氧化损伤模型,观察CSTA 对该细胞氧化应激损伤的保护作用。
CSTA 是中药材决明子的主要有效成分之一,而现代药理学研究表明,决明子具有良好的抗炎、抗氧化、抗纤维化、降血压等多种生物学功能[14-16]。本研究通过浓度梯度实验选择20 mg/L 作为CSTA 的实验浓度,发现CSTA 能显著提高H2O2诱导的HLE-B3 细胞活力,降低细胞凋亡率,提示CSTA 对H2O2诱导的HLE-B3 细胞损伤具有保护作用。同时,CSTA 能显著提高H2O2诱导的HLE-B3 细胞内GSH-Px、SOD 含量,并降低MDA 含量,提示CSTA能加强HLE-B3 细胞内的抗氧化应激反应,对抗H2O2诱导的氧化应激反应,减轻HLE-B3 细胞氧化应激损伤,但具体作用机制尚需进一步探讨。
PPARγ 是配体激活依赖的核受体转录因子,调节多种因子的转录活性,在机体糖代谢、脂质平衡、炎症反应、氧化应激反应、免疫反应及细胞分化、增殖等方面均具有重要调控作用[17-18]。Sirt1 是具有烟酰胺腺苷二核苷酸依赖性的去乙酰化酶,能调节许多转录因子,发挥抗炎、抗氧化应激及调节细胞免疫等功能[19-20]。研究[21]发现,PPARγ 是Sirt1 的底物之一,Sirt1 可抑制PPARγ 活性,参与脂质代谢过程的调节。本研究显示,H2O2可降低HLE-B3 细胞内Sirt1 mRNA 及蛋白水平,提高PPARγ 磷酸化蛋白水平,提示Sirt1/PPARγ通路参与H2O2诱导的HLE-B3 细胞氧化应激损伤过程。使用CSTA 可提高H2O2诱导的HLE-B3 细胞内Sirt1 mRNA 及蛋白水平,并降低PPARγ 磷酸化蛋白水平,提示CSTA 能调节Sirt1/PPARγ 通路。进一步使用Sirt1 抑制剂后发现,HLE-B3 细胞内Sirt1 mRNA 及蛋白水平降低,PPARγ 磷酸化蛋白水平升高,同时HLE-B3 细胞活力及细胞内GSH-Px、SOD 含量降低,细胞凋亡率及细胞内MDA 含量升高,提示CSTA 可能通过调节Sirt1/PPARγ 通路,进而增强抗氧化应激反应,提高HLE-B3 细胞活力,减少细胞凋亡。
综上所述,CSTA 能增强H2O2诱导的HLE-B3细胞内的抗氧化应激反应,提高细胞活力并减少氧化应激损伤导致的细胞凋亡,其机制与调节Sirt1/PPARγ 通路有关。此发现可为临床研制白内障治疗药物提供新思路,但本研究仅能证明CSTA 对体外H2O2诱导HLE-B3 细胞氧化应激凋亡的影响,对白内障动物体内LEC 损伤的影响还需进一步开展动物实验进行研究。

