红景天苷抑制破骨细胞分化和极化的初步研究
易清清,梁鹏晨,孙苗苗,杨荣,梁冬雨,沙爽,常庆△
骨是一种矿化的结缔组织,破骨细胞和成骨细胞之间的信号传导在骨重塑和维持骨微环境稳态中起着重要作用[1]。骨质疏松症(osteoporosis,OP)是一种以骨量降低与骨微结构退化为特点的疾病,骨折是其最常见的并发症[2]。破骨细胞来源于造血干细胞,是由单核细胞融合分化而成,是唯一具有骨吸收功能的细胞。破骨细胞通过分泌组织蛋白酶K(CK)和基质金属蛋白酶-9(MMP-9)降解骨基质[3]。破骨细胞与骨组织接触的细胞膜区域具有特殊的黏附结构,形成封闭区,其中的细胞膜具有微绒毛结构样褶皱缘,两者形成相对独立的骨吸收间隙,从而完成细胞极化[4]。整合素(Integrin)能调节黏附、迁移及封闭区的形成,对破骨细胞分化和激活具有重要意义[5-6]。非受体酪氨酸激酶(c-Src)及其磷酸化产物p-Src 调节细胞极化、迁移及褶皱缘的形成,敲除c-Src的小鼠因体内破骨细胞无法形成正常伪足,导致产生骨硬化症[7-8]。红景天苷(Salidroside,SAL)为4-羟基-苯基-β-D-吡喃葡萄糖苷,是红景天属植物中广泛存在的酚苷类化合物,可从植物根、茎提取[9]。SAL具有保护心脑血管、调节免疫、抗肿瘤、促成骨等药理作用[10]。近年来研究表明,SAL 可促进骨折后的骨再生和血管生成[11]。有关SAL促成骨的研究多集中于促进成骨细胞和内皮细胞活性方面,关于SAL 和破骨细胞分化及极化关系的研究尚少见报道。本实验旨在研究SAL对可溶性核因子κB受体活化因子配体(sRANKL)诱导的破骨细胞分化和极化的影响,以期为SAL的临床应用提供理论依据。
1 材料与方法
1.1 材料 SAL购自成都瑞芬思生物科技公司,小鼠单核细胞RAW264.7 细胞株购自苏州赛尔飞生物科技公司,高糖DMEM 培养液、胎牛血清(FBS)均购自美国Gibco 公司,重组小鼠sRANKL购自上海赛戈生物科技公司,抗酒石酸酸性磷酸酶(TRAP)染色试剂盒购自北京索莱宝公司,鬼笔环肽购自美国Sigma公司,DAPI和茜素红染色液购自上海碧云天生物技术公司,兔源MMP-9、c-Src、CK、Integrin β3一抗及羊抗兔二抗购自美国Cell Signaling 公司,实时荧光定量逆转录聚合酶链反应(qPCR)引物购自上海捷瑞生物公司,RT-PCR试剂盒购自北京Takara公司。
1.2 方法
1.2.1 细胞培养 小鼠RAW264.7 细胞系用含10% FBS 的DMEM培养基于37 ℃、5%CO2条件下培养,隔天换液,细胞密度80%以上时于6 孔板中铺板培养。随后细胞用含10%FBS,100µg∕L sRANKL 的DMEM 培养基继续培养5 d。对照组不含SAL 的培养液,实验组分别加入含15、30 和60 mg∕L SAL 的培养液,于37 ℃、5%CO2条件下培养,隔日换液,连续培养5 d。本文中SAL 的质量浓度15、30、60 mg∕L 均为加到细胞培养基中的终浓度。
1.2.2 TRAP 染色 细胞培养5 d 后,弃培养基,PBS 洗2 次,每孔加入500 µL 4%多聚甲醛固定30 min,PBS 洗2 次,按TRAP 染色试剂盒说明书进行染色,显微镜下观察,对TRAP染色阳性细胞进行计数。
1.2.3 纤维形肌动蛋白(F-Actin)环染色 将生长状态良好的RAW264.7细胞系以1×105个∕孔的密度接种于6孔板中,细胞贴壁后分别更换含100µg∕L sRANKL 及0、15、30 和60 mg∕L SAL的DMEM培养基,于37 ℃、5%CO2环境下继续培养。培养48 h,弃培养基,PBS洗2次,4%多聚甲醛固定30 min,PBS洗2次,加入5 mg∕L 鬼笔环肽染色液,37 ℃避光孵育30 min,弃染色液,PBS洗2次,加入DAPI染色液染色5 min,PBS洗2次。显微镜下观察拍照,计数F-Actin环形成数。
1.2.4 茜素红染色 细胞以1×105个∕孔接种于6 孔板中,贴壁后分别换含100µg∕L sRANKL、成骨诱导液及0、15、30 和60 mg∕L SAL 的DMEM 培养基,于37 ℃、5%CO2环境下继续培养。培养14 d 后,吸除培养基,并用PBS 冲洗细胞,4%多聚甲醛中固定30 min,用茜素红染色30 min,显微镜下观察破骨细胞钙化情况。显微镜拍摄后,用10%十六烷基氯化吡啶溶解,562 nm处测定光密度(OD)值。
1.2.5 qPCR 检测MMP-9、c-Src、CK和Integrin β3的mRNA表达 0、15、30和60 mg∕L SAL干预细胞5 d,使用Trizol法冰上抽提总RNA,根据试剂说明书进行RNA的逆转录及cDNA的扩增。逆转录条件:42 ℃15 min,85 ℃5 s。扩增条件:95 ℃10 s;95 ℃3 s,60 ℃30 s,72 ℃34 s,循环40 次。以GAPDH 为内参,目的基因相对表达量采用2-ΔΔCt法计算。引物序列见表1。

Tab.1 Amplification of gene primers by qPCR表1 qPCR扩增基因引物序列
1.2.6 Western blot 检测MMP-9、c-Src 蛋白表达 0、15、30和60 mg∕L SAL 干预细胞5 d,在6 孔板中加入高效组织裂解液RIPA,冰上反复吹打,12 000 r∕min 离心10 min 后取上清液。上清液中加入上样缓冲液,95 ℃加热10 min 使蛋白变性,10%SDS-PAGE 分离蛋白后转至PVDF 膜上,5%脱脂奶粉封闭抗原1 h,按说明书稀释一抗MMP-9(1∶1 000)、c-Src(1∶1 000),内参GAPDH(1∶1 000),14 ℃孵育过夜,TBST 洗膜3 次,稀释二抗(1∶20 000),室温孵育1 h,TBST 洗膜3 次,加入ECL 化学发光液显影曝光。根据灰度值数据分析各组MMP-9、c-Src蛋白相对表达量。
1.3 统计学方法 采用GraphPad Prism 5.0软件进行数据分析,符合正态分布的计量资料采用均数±标准差(±s)表示,多组间均数比较采用单因素方差分析,组间多重比较采用Dunnet-t检验,体外细胞实验结果均重复3次。P<0.05为差异有统计学意义。
2 结果
2.1 SAL抑制RAW 264.7分化成TRAP 阳性破骨细胞 在sRANKL诱导下,各组RAW264.7细胞均分化成破骨细胞,TRAP染色阳性证实sRANKL诱导分化成功。与对照组相比,SAL 15、30 和60 mg∕L SAL 组TRAP染色阳性破骨细胞的数目逐渐减少,见图1。
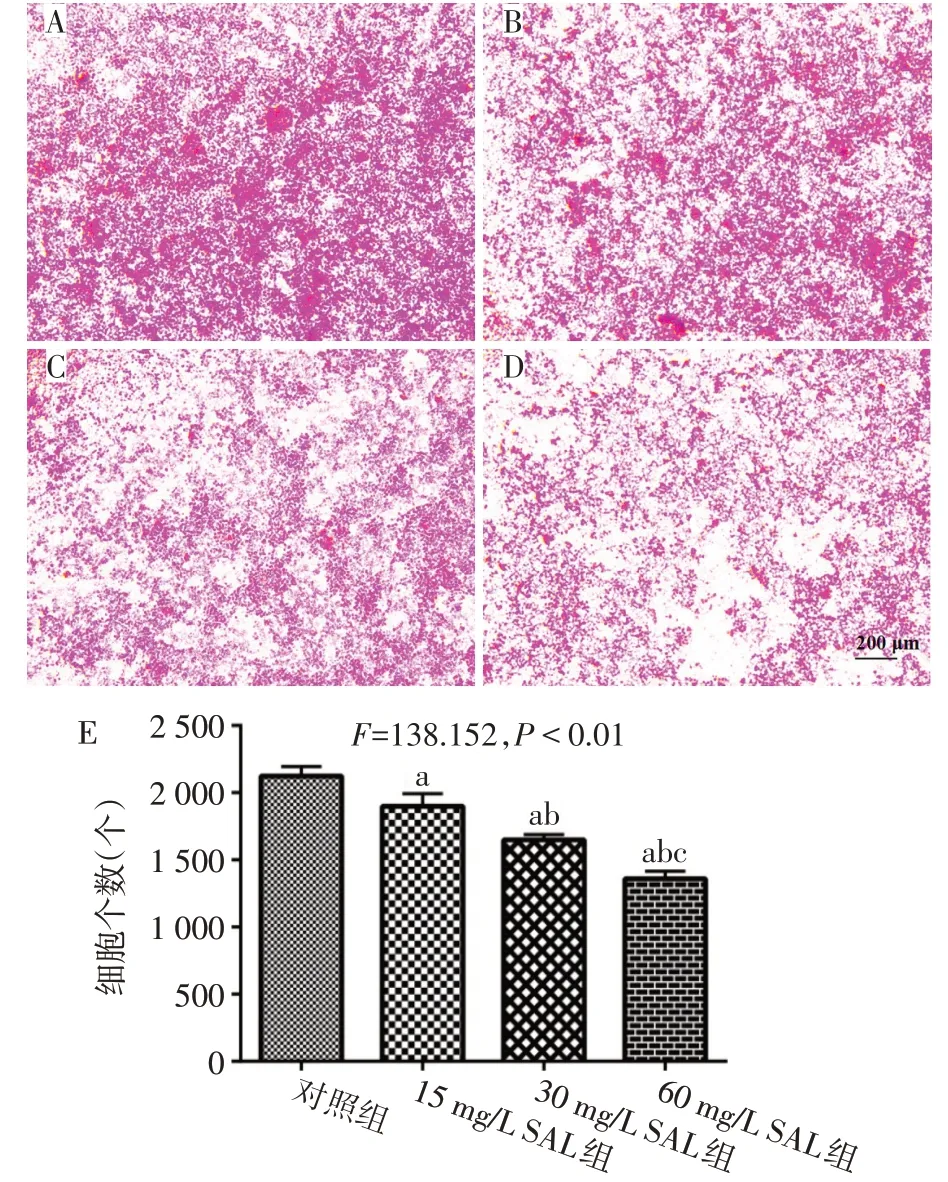
Fig.1 The effect of different concentrations of salidroside on the count of osteoclasts(TRAP staining,×100)图1 不同质量浓度SAL对破骨细胞计数结果的影响(TRAP染色,×100)
2.2 SAL 抑制RAW 264.7 分化破骨细胞F-Actin 环形成 对照组破骨细胞F-Actin环完整,SAL处理后,破骨细胞的F-Actin变细,甚至消失。随着SAL质量浓度增高,破骨细胞的F-Actin 环破坏更加严重,FActin环数量减少,破骨细胞的数目亦越少,见图2。
2.3 SAL促进破骨细胞钙化形成 随着SAL质量浓度增高,破骨细胞钙结节茜素红染色加深,SAL具有促进破骨细胞钙化的作用,见图3。
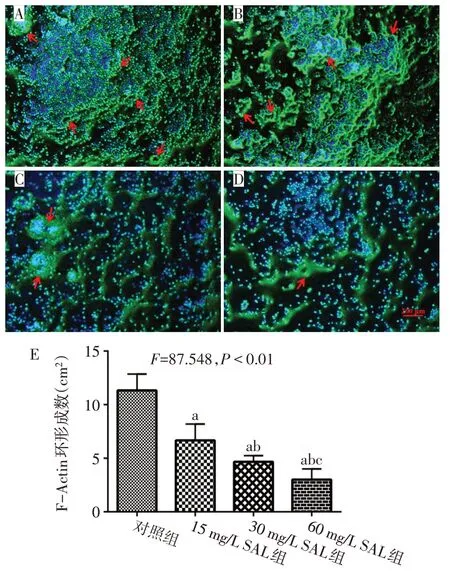
Fig.2 Effects of SAL on the formation of F-actin ring in osteoclasts图2 不同质量浓度SAL对破骨细胞F-Actin环形成的影响
2.4 SAL 抑制MMP-9、c-Src、CK、Integrin β3mRNA的表达 与对照组相比较,30 和60 mg∕L SAL 组的MMP-9、CKmRNA,15、30 和60 mg∕L SAL 组的c-SrcmRNA,15、30 mg∕L SAL 组的Integrin β3mRNA 表达量降低(P<0.05),见表2。
Tab.2 Comparison of mRNA expression levels of MMP-9,c-Src,CK and Integrin β3 between the four groups of osteoclasts表2 各组破骨细胞MMP-9、c-Src、CK、Integrin β3 mRNA表达水平比较 (n=3,±s)
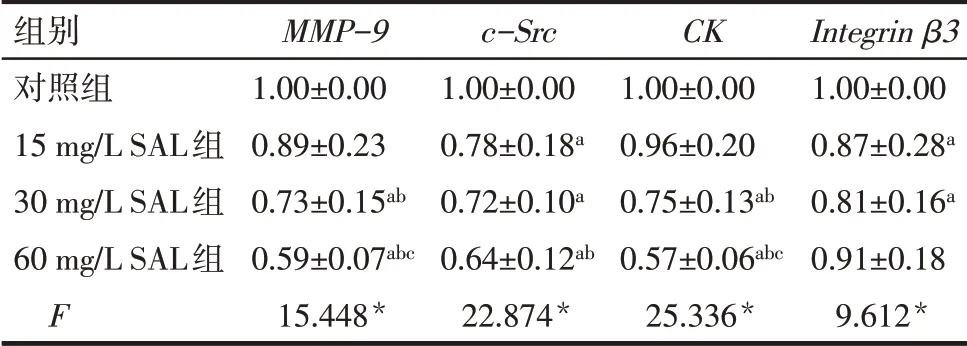
Tab.2 Comparison of mRNA expression levels of MMP-9,c-Src,CK and Integrin β3 between the four groups of osteoclasts表2 各组破骨细胞MMP-9、c-Src、CK、Integrin β3 mRNA表达水平比较 (n=3,±s)
*P<0.05;a 与对照组比较,b 与15 mg∕L SAL 组比较,c 与30 mg∕L SAL组比较,P<0.05。
组别对照组15 mg∕L SAL组30 mg∕L SAL组60 mg∕L SAL组F MMP-9 1.00±0.00 0.89±0.23 0.73±0.15ab 0.59±0.07abc 15.448*c-Src 1.00±0.00 0.78±0.18a 0.72±0.10a 0.64±0.12ab 22.874*CK 1.00±0.00 0.96±0.20 0.75±0.13ab 0.57±0.06abc 25.336*Integrin β3 1.00±0.00 0.87±0.28a 0.81±0.16a 0.91±0.18 9.612*
2.5 SAL 抑制破骨细胞MMP-9、c-Src 蛋白表达水平 与 对 照 组 比 较,15、30 和60 mg∕L SAL 组 的MMP-9、c-Src蛋白表达水平逐渐降低(P<0.05),见图4、表3。
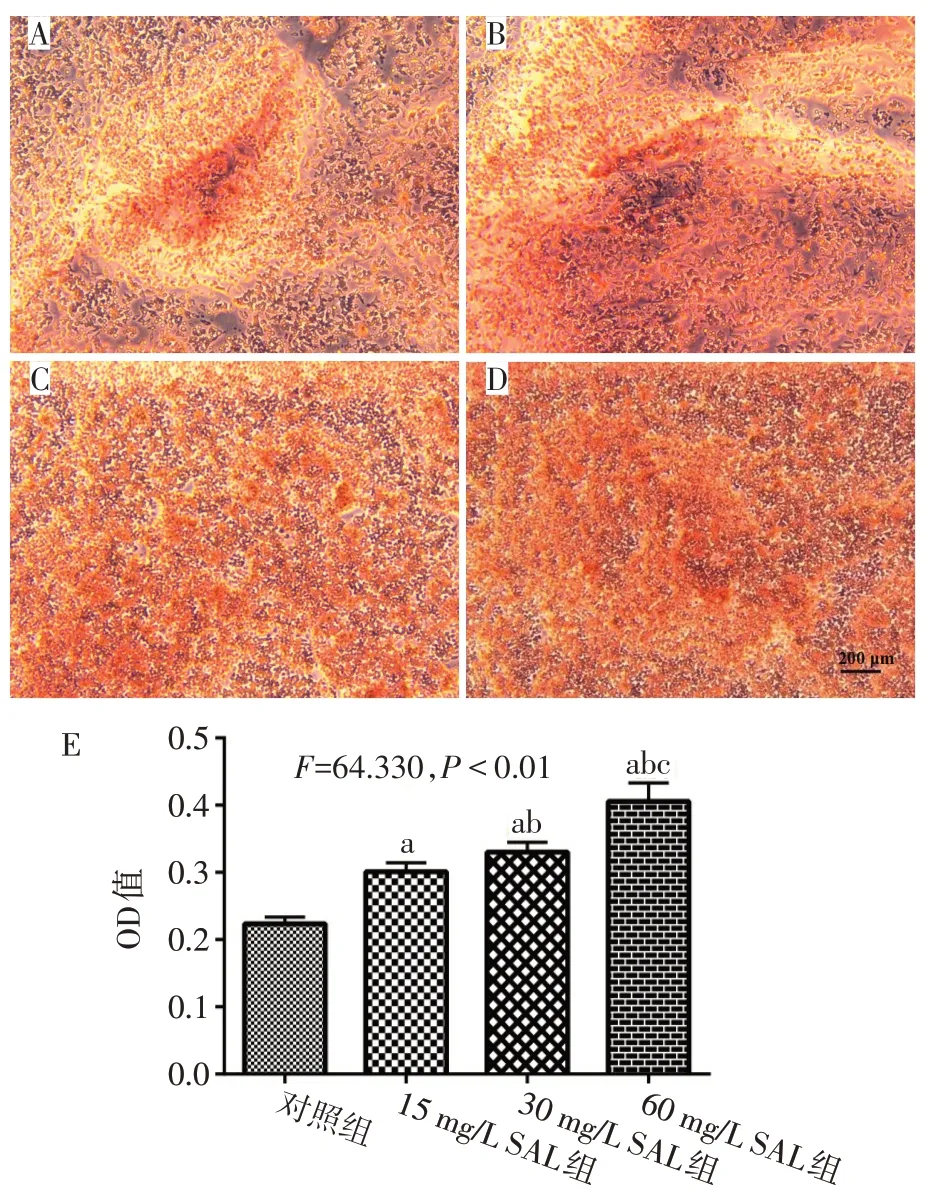
Fig.3 Effects of SAL on alizarin red staining of osteoclast calcium nodules图3 SAL对破骨细胞钙结节茜素红染色的影响
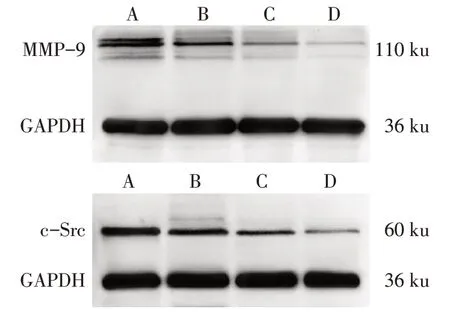
Fig.4 Effects of SAL on MMP-9 and c-Src protein expression图4 SAL对破骨细胞MMP-9、c-Src蛋白表达的影响
3 讨论
骨是一种具有矿化能力的结缔组织,在骨重塑和骨微环境稳态中,破骨细胞和成骨细胞之间存在信号传导现象[11]。破骨细胞可以通过空泡腺苷三磷酸(ATP)酶、补体C3a、微小RNA 等影响成骨细胞骨形成;同时,成骨细胞也可以通过骨保护素∕核因子受体活化因子∕核因子受体活化因子配体(OPG∕RANK∕RANKL)、死亡受体∕死亡配体(Fas∕FasL)等通路影响破骨细胞的分化与凋亡[12]。破骨细胞完成骨吸收主要是依靠其特有的超微结构,通过细胞骨架重组形成极化构象,将细胞表面膜分成封闭区、褶皱缘、基底外侧区和功能分泌区[13]。极化后的破骨细胞通过足质体贴附于骨表面,同时F-Actin环围绕褶皱缘形成独立的微环境,CK 和MMP-9 等水解酶的释放可以实现骨吸收[14]。
Tab.3 Comparison of relative expression levels of MMP-9 and c-Src protein between the four groups表3 各组MMP-9、c-Src蛋白相对表达量的比较(n=3,±s)
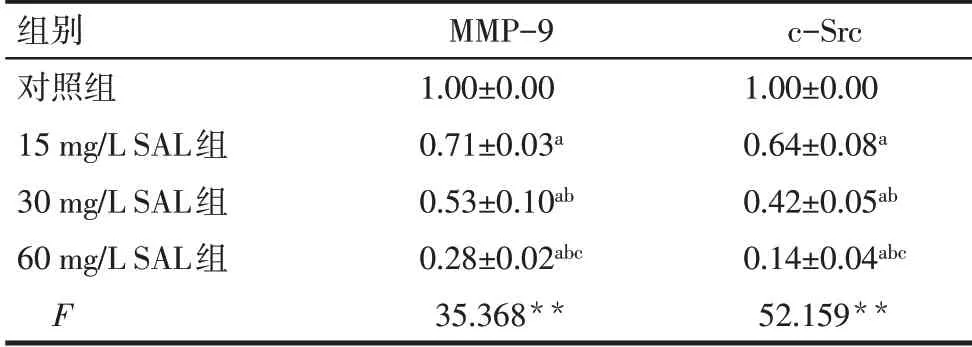
Tab.3 Comparison of relative expression levels of MMP-9 and c-Src protein between the four groups表3 各组MMP-9、c-Src蛋白相对表达量的比较(n=3,±s)
**P<0.01;a与对照组比较,b与15 mg∕L SAL 组比较,c与30 mg∕L SAL组比较,P<0.05。
组别对照组15 mg∕L SAL组30 mg∕L SAL组60 mg∕L SAL组F MMP-9 1.00±0.00 0.71±0.03a 0.53±0.10ab 0.28±0.02abc 35.368**c-Src 1.00±0.00 0.64±0.08a 0.42±0.05ab 0.14±0.04abc 52.159**
中药红景天具有补肾、扶正固本、理气养血和滋补强身等功效。现代研究结果表明,红景天含有40多种化合物,主要成分为SAL、酪醇等,具有抗缺氧、抗疲劳、抗肿瘤、抗病毒等作用[15-16]。研究还发现,其主要活性成分SAL具有上调成骨细胞骨形态发生蛋白-2的作用,能促进成骨性的骨生成[17]。本实验发现,SAL 能够抑制sRANKL 诱导的破骨细胞分化和极化、F-Actin环形成,促进钙结节形成,抑制破骨细胞骨吸收关键蛋白酶MMP-9、c-Src 的活性,显示出确切的抗骨质疏松作用。
基于SAL 确切的抑制骨吸收作用,本研究观察了其对破骨细胞分化、极化和骨吸收的影响。破骨细胞由sRANKL诱导巨噬细胞分化而成。在破骨细胞分化和极化过程中,破骨细胞特异性表达骨吸收标志蛋白MMP-9、c-Src 等[18]。MMP-9 为破骨细胞分泌的蛋白水解酶,参与细胞外胶原基质的降解,维持破骨细胞的骨吸收功能。MMP-9 在哺乳动物胚胎期软骨内成骨及骨重建时起到胶原酶的作用,是破骨细胞和血管内皮细胞侵入矿化组织所必须的生物因子,破骨细胞分化过程中MMP-9 表达上调,加速骨吸收[19]。因此,SAL可能通过抑制MMP-9的表达来增加钙结节茜素红染色程度。c-Src 及其磷酸化产物p-Src 参与调节破骨细胞极化及褶皱缘的形成。F-Actin 环是破骨细胞特有的进行骨吸收的细胞骨架蛋白,反映了破骨细胞的骨吸收功能[20]。本实验结果表明,SAL 能显著减少由sRANKL 诱导的破骨细胞数目,抑制破骨细胞的分化与极化,减少F-Actin 环形成,促进钙结节增多,降低破骨细胞的MMP-9 及c-Src 的表达,表明SAL 能够抑制破骨细胞骨吸收,减少骨丢失。
综上,本研究发现,SAL能够抑制破骨细胞的分化、极化和骨吸收作用,为SAL的开发和临床应用提供了依据。本研究的不足之处是仅观察了基因与蛋白水平的变化,尚未进行相关信号通路的深入研究。另外,本研究仅探究SAL 抑制体外破骨细胞的分化和极化,未通过体内实验证实,有待于后续研究进一步探讨。

