环状RNA对房颤患者的影响及其作用机制研究
卢洁,张芯,王涛,杨宁
近20年来,随着中国人口老龄化,心房颤动(房颤)发病率呈上升趋势[1]。房颤的主要症状为心悸、乏力、胸闷气短、头晕或晕厥等,也有很多房颤患者无临床症状,但发生血栓栓塞性疾病和心力衰竭等并发症的风险依然存在[2]。目前,已被证实的房颤的发病机制主要有心房的结构重构和电重构过程、自主神经功能紊乱及离子通道的异常,另外还有心肌电传导的折返学说、异位局灶触发机制假说等[3-4]。
环状RNA(circRNA)为一种非编码RNA,通过反向剪接共价结合的方式形成具有特征性的环状闭合结构,具有结构稳定、表达丰度高及存在组织或细胞特异性等特征[5-6]。circRNA在多种疾病的病理和生理过程中发挥重要作用,如circRNA 可通过与转录因子和生长因子相互作用,参与肿瘤发生的生物学过程[7]。circRNA可以通过“微小RNA(miRNA)海绵机制”靶向结合特定的miRNA等参与部分基因的表达和调控,进而发挥部分生物学功能,促进或抑制靶基因的表达[8]。circRNA 可与RNA 结合蛋白相互作用,在疾病的进展或分子信号通路传递过程中发挥作用[9]。circRNA 可与真核生物PolⅡ相互作用,参与其亲本基因的转录或调节剪接过程[10]。另有研究证实,circRNA 还具有蛋白质编码功能,如circRNA 的m6A 修饰可以促进其自身的翻译,说明circRNA 在外部刺激下可以编码蛋白质或多肽[11]。circRNA 具有特殊的闭合结构以及多种生物学功能,这些特性赋予其成为疾病的诊断、预测及治疗新靶点的潜能。
1 circRNA参与调控心房的结构和电重构
心房肌细胞纤维化是房颤患者发生心房结构重构的基础,主要表现为细胞增大、线粒体形状和功能改变、肌浆网断裂、胶原蛋白和糖原积聚等超微结构改变,致使心房肌细胞结构和功能发生改变,细胞外基质沉积,进而引起心肌纤维化,最终导致心肌细胞间传导减慢、电压降低而出现电传导异常,发生房颤[12]。既往研究证实,circRNA 参与调控心肌纤维化过程[13]。比如心肌细胞中高表达的circRNA_000203 通过靶向结合miR-26b-5p 和miR-140-3p导致GATA4表达上调而促进心肌细胞肥大[14];房颤患者血浆中低表达的hsa_circ_0004104 可以激活转化生长因子(transforming growth factor,TGF)-β信号通路,TGF-β已被证实能够促进心肌细胞纤维化,故低水平的hsa_circ_0004104 能够作为房颤持续性的潜在调节剂和生物标志物[15]。circRNA POSTN通过特异性结合miR-96-5p 来调控BNIP3,进而影响心肌细胞的纤维化过程[16]。不同的circRNA分子通过直接或间接调控心肌细胞、成纤维细胞、内皮细胞以及平滑肌细胞等细胞间相互作用的信号通路,使心脏微环境稳态失衡,造成细胞和分子水平上的心脏结构重塑[17]。敲低的mmu_circ_0005019 通过“海绵机制”靶定结合miR-499-5 而抑制其靶基因KCNN3的表达,而抑制KCNN3后能够抑制编码小电导钙活化钾通道3,延长动作电位持续时间,从而抑制房颤的发生,因此,下调mmu_circ_0005019 能够抑制心肌细胞的电重构[18]。另有研究认为,circRNA 能够参与房颤的发病过程,并强调circRNA 可以作为房颤诊疗及预后评估的潜在靶点[19]。因此,circRNA可以通过多条信号通路参与调控心房的结构和电重构过程。
2 circRNA调控自主神经紊乱
心脏的自主神经系统包括交感神经和副交感神经,由一系列嵌套式相互作用的反馈回路中的复杂神经层次结构组成,可控制心脏的传导系统和心肌收缩组织、调节心房组织的自主性及触发电生理活动。心脏的自主神经系统与房颤的发生及维持关系密切,并且其异常活动可能会诱导心房重构[20]。心脏自主神经功能紊乱将会导致心房组织的兴奋性增强,既而发生房颤。研究证实,房颤发作时亦会造成心房自主神经的不均匀分布,使心房自主神经发生重构,而自主神经重构可增加房颤的发生率和持续时间,因此自主神经功能紊乱与房颤的发生及维持互为因果[21]。研究显示,采取针对心房电活动的自主神经干预治疗可以降低房颤的发生率[22]。心房神经节中存在神经调节蛋白-1(Neuregulin-1,NRG1)∕红细胞白血病病毒癌基因同源物(erythroblastic leukemia viral oncogene homolog,ErbB4)通路,该通路的激活可通过抑制心房神经节活动,延长心房不应期而减慢心房电传导能力,延缓心房电重构过程,从而降低房颤的发生率,提示通过干预心房神经节中NRG1∕ErbB4 通路的活性有益于房颤的治疗[23]。心脏内皮细胞自分泌NRG1∕ErbB4 信号能够减弱心房肌细胞的肥大和纤维化,从而抑制心房结构重构过程,避免房颤的发生[24]。circ_ZNF609 可通过miR-615-5p∕MEF2A 通路参与调节内皮细胞功能[25]。circHIPK3 可通过miR-29a∕VEGFA 信号通路影响心脏内皮细胞的增殖、迁移及细胞周期,从而造成内皮细胞功能障碍,进而影响内皮细胞自分泌过程,间接影响房颤的发生[26]。越来越多的研究表明,circRNA 能够通过多条信号通路调控心脏内皮细胞的功能,推测某些特定的circRNA 分子能够间接参与房颤发病过程中自主神经功能的调控[27]。
3 circRNA与离子通道异常
心脏离子通道的正常开闭对于维持正常的心脏节律和功能至关重要,心肌细胞动作电位与其相应的离子通道间的正常生理活动障碍与房颤所导致的严重心脏恶性事件的发生有关[28]。离子通道结构和功能的异常可造成心房肌细胞电流紊乱,降低心房肌动作电位时程,增加心房异位灶的兴奋性,最终导致房颤的发生[29]。心脏兰尼碱受体2(ryanodine receptor 2,RYR2)Ca2+释放通道是心脏兴奋-收缩耦联所必需的,心房肌细胞舒张期RYR2的Ca2+泄露会导致房颤的发生,所以通过稳定靶向作用于RYR2的药物来抑制Ca2+泄露能够降低房颤的发生率[30]。研究发现,房颤患者中circ_7571 和miR-328 表达呈负相关,低表达的circ_7571 使其对miR-328 靶向结合作用减弱,而miR_328能够减弱L型钙电流,缩短心房动作电位持续时间,增加房颤的发生概率[31]。另有研究显示,circRNA_1000053 表达下调,circRNA_1000052通过同时靶定结合miR_455_5p和瞬时受体电位香草样蛋白1(TRPV1:一种非选择性离子通道),进而促进房颤离子通道功能的改变,间接促使房颤的发生[32]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路具有电压依赖性,MAPK L 型和α1C 亚基钙通道(CACNA1C)可能通过阻止心房副交感神经重构,从而参与房颤的发生[33]。已有研究表明,hsa_circ_0004872(circMAPK1)可通过其编码的蛋白质circMAPK1-109a 竞争性结合丝裂原活化蛋白激酶激酶-1(mitogen-activated protein kinase kinase-1,MEK1)来抑制MAPK1 的磷酸化,进而抑制MAPK1及其下游因子在MAPK通路中的激活,可见circRNA能够参与调控MAPK 信号通路,间接参与调控房颤发病过程中离子通道功能的异常变化过程[34]。
4 总结与展望
circRNA 在房颤的病理生理过程、电生理改变中的作用机制复杂多样,各种因素及环节相辅相成,共同促成了房颤的发生,且部分circRNA 能够分别参与房颤电离子通道异常、心房的重构以及神经内分泌紊乱的调控。通过汇总circRNA在房颤患者中的作用机制,并结合circRNA 特异性的分子结构及生物学特性,可见特异性circRNA 分子能同时参与房颤上述发病机制中的病生理及电生理变化的可能调控过程,见图1。通过测序研究和(或)处于房颤发病的核心位置的某个关键性的circRNA 分子,该circRNA 分子能同时参与房颤发病及进展的病理生理及电生理过程,可以作为早期预测和筛查房颤患者的生物标志物,为早期筛查房颤患者的高危人群提供依据,并提供新的分子治疗靶点。
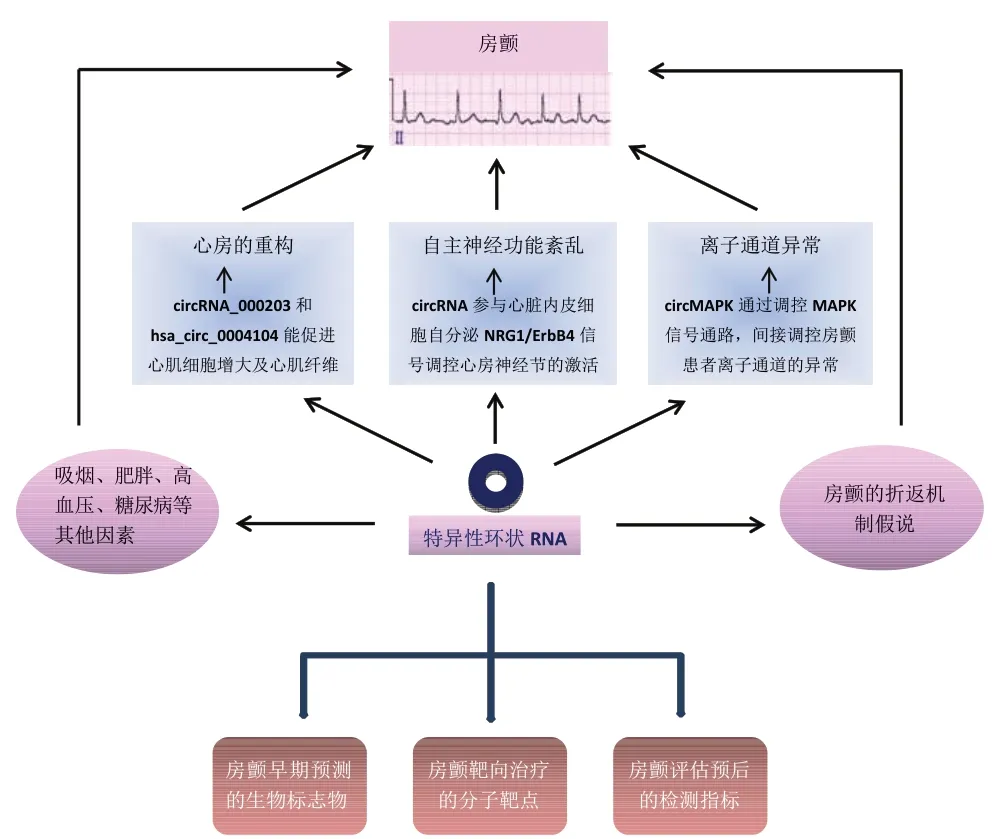
Fig.1 Central role of specific circRNAs in patients with atrial fibrillation图1 房颤患者中特异性circRNA的核心作用

