子宫颈浸润性复层产黏液的癌6例临床病理分析
周冬梅,林丽燕,陈雪燕,朱伟峰,张 红
子宫颈浸润性复层产黏液的癌(invasive stratified mucin-producing carcinoma, ISMC)由Lastra等[1]于2016年首次报道并命名。2018年国际子宫颈腺癌标准与分类(International Endocervical Adenocarcinoma Criteria and Classification, IEACC)已明确将之列为人乳头状瘤病毒(human papilloma virus, HPV)相关的腺癌亚型[2]。ISMC作为一种有特殊形态及免疫表型的新亚型,因其罕见,对其诊断、鉴别诊断及预后等的认识有待提高。本文回顾性分析6例子宫颈ISMC的临床病理学及免疫表型特征、诊断及鉴别诊断等,旨在提高临床和病理医师的认识水平。
1 材料与方法
1.1 临床资料收集2019~2021年褔建省肿瘤医院诊治的6例子宫颈ISMC患者。患者临床病理资料包括发病年龄、临床表现、组织学类型、肿瘤浸润深度、脉管侵犯和转移、国际妇产科联盟(FIGO)分期以及随访情况。1例(例1)为子宫颈活检及根治术标本,1例(例2))为子宫颈根治术标本,2例(例3、4)为子宫颈锥切术标本,2例(例5、6)为子宫颈及淋巴结或肝转移灶活检标本。随访截至2021年2月。病理切片经两名高级病理医师阅片确诊。
1.2 方法标本均经10%中性福尔马林固定,常规脱水,石蜡包埋,切片,行HE和免疫组化染色。免疫组化染色采用EnVision两步法,DAB显色。所用抗体包括CK5/6(D5/16B4)、CK8/18(5D3)、CK7(OV-TL 12/30)、CEA(ZC23)、PAX8(多克隆)、p16(MX007)、ER(6F11)、PR(MX009)、p40(多克隆)、Syn(SP11)、Ki-67(MIB-1),均购自福州迈新公司。
2 结果
2.1 临床特征6例子宫颈ISMC患者年龄42~54岁,中位年龄48.2岁,临床表现均为阴道不规则出血。Ⅰa期2例,Ⅱa期2例,Ⅲc期1例,Ⅳb期1例。单纯ISMC 3例,ISMC合并鳞癌2例,ISMC合并普通型腺癌1例。结节型2例,糜烂型4例。2例行单纯手术切除术,2例行手术切除术+化疗,1例放、化疗治疗过程中进展,出现盆腹腔多发淋巴结转移,1例放、化疗靶向治疗过程中进展,出现肝转移,放弃治疗后1个月后死亡(表1)。
2.2 眼观子宫颈可见糜烂或结节状肿物,切面灰白色,质硬。
2.3 镜检6例均可见肿瘤细胞呈复层排列,实性巢团状生长,边缘圆钝,周边细胞呈栅栏状排列,胞质内黏液空泡多少不等,核深染,胞质上方核分裂象易见,灶性坏死。间质浆细胞、中性粒细胞浸润。例1、3、4合并普通型腺癌或鳞癌成分。例1术前化疗后根治术标本仅间质浅层残留退变的ISMC成分,胞质内仍可见黏液,胞质较嗜酸,核固缩、异型明显,局部仍可见巢周细胞呈栅栏状排列。例3 ISMC成分示肿瘤细胞内黏液不明显,癌巢较不规则但巢周上皮呈栅栏状排列,巢内核碎屑明显。例5子宫颈及左侧颈淋巴结活检组织均显示经典巢团排列伴明显异型的Bizarre核。例6子宫颈及肝转移癌的形态均可见不明显空泡状腔隙,及少量胞质内黏液,但肝转移灶的癌巢更不规则。6例均呈浸润性生长(Silva Patern C)(图1~6)。
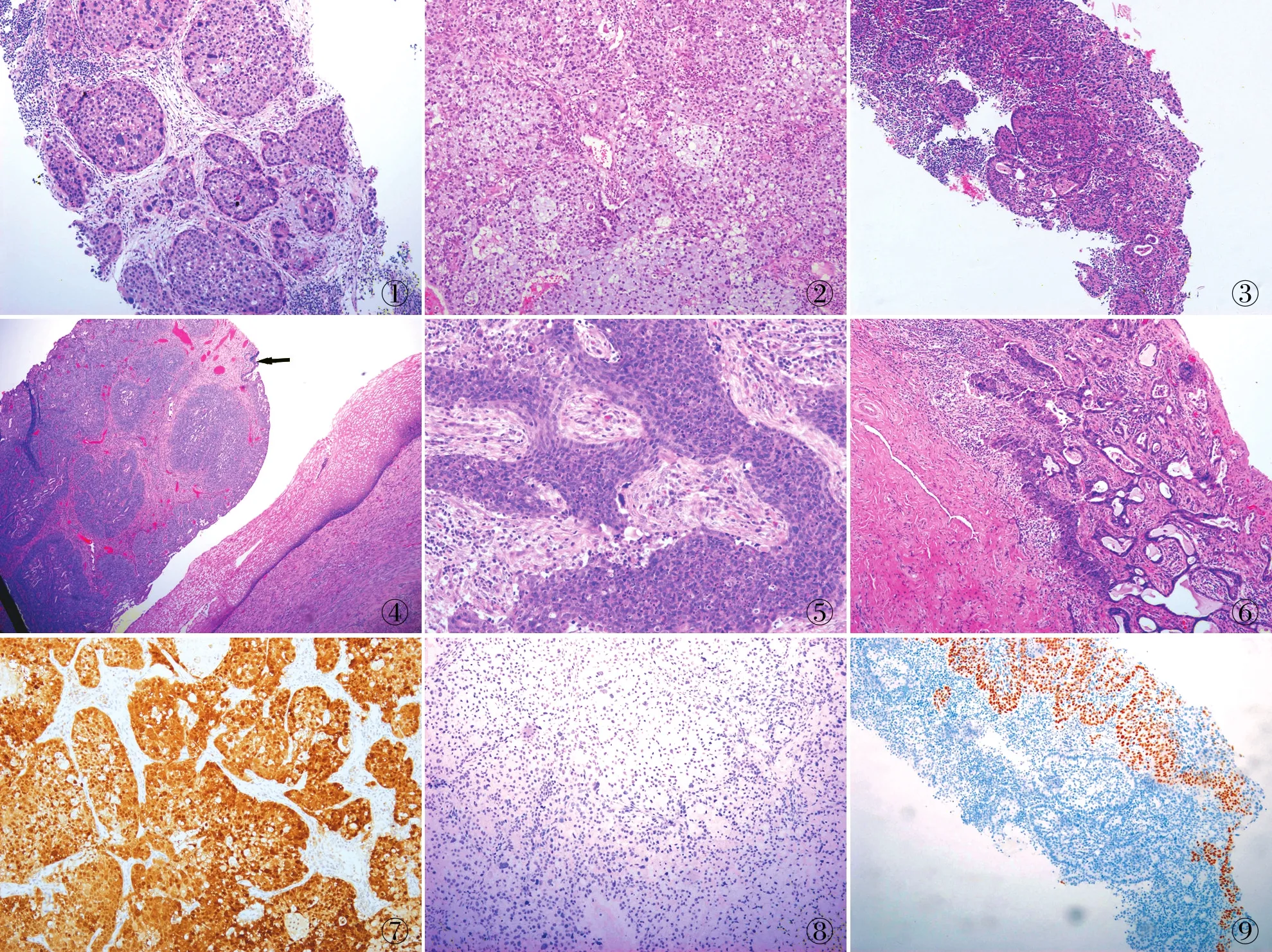
图1 例5淋巴结转移性ISMC:肿瘤细胞实性、圆钝巢状,巢周上皮呈栅栏状排列 图2 例5子宫颈ISMC:肿瘤呈实性巢状,细胞内黏液丰富 图3 例1子宫颈ISMC合并鳞癌 图4 ISMC的癌巢边界圆钝,巢内假腺样小囊形成,右上角见少量普通型腺癌(箭头) 图5 例3 ISMC成分示肿瘤较不规则,呈实性巢状,巢周上皮呈栅栏状排列,巢内核碎屑明显 图6 例3合并普通型腺癌 图7 例5 ISMC呈p16弥漫强阳性,EnVision两步法 图8 例5 ISMC呈p40阴性,EnVision两步法 图9 例1 ISMC呈p40阴性,EnVision两步法
2.4 免疫表型6例ISMC细胞p16(图7)、CEA、CK7和CK8/18均阳性,ER、PR、PAX8和Syn均阴性,CK5/6、p40阴性(图8、9)或灶阳性,Ki-67增殖指数为70%~80%(表1)。
2.5 病理诊断例2、5、6为单纯ISMC,例1、3、4为混合性ISMC。
2.6 随访6例平均随访10.9个月。例1、2术后辅助放、化疗,分别随访22、12.5个月;例3和例4术后均未行其它治疗,分别随访4.5个月和9个月;未见转移和复发。例5确诊后行放、化疗及靶向治疗,10个月后盆腹腔见多发淋巴结转移,继续给予化疗中,随访16.5个月;例6放、化疗后8个月肝转移放弃治疗1个月死亡(表1)。

表1 6例子宫颈ISMC的临床病理学特征
3 讨论
ISMC是近年被认识的一种子宫颈黏液性腺癌,临床多表现为阴道不规则出血,发病年龄较普通型腺癌患者年轻,大多小于50岁,可能源于子宫颈鳞柱交界的储备细胞,具有分化成不同结构及细胞模式的能力[3-4]。最新Park等[5]研究发现ISMC表现出更高的干细胞标志物(ALDH1和Nanog)和上皮-间质转化标志物(Snail、Twist和E-钙黏蛋白)的免疫表型,二代测序技术结果亦显示,与上皮-间质转化和干细胞相关的基因突变频率更高,表明其为子宫颈储备细胞起源。随着ISMC报道病例数的增多,对其形态谱系及预后的认识就越充分,有助于准确的病理诊断及临床治疗。
3.1 前驱病变2000年Park等[6]提出了子宫颈产黏液的复层上皮内病变(stratified mucin-producing intraepithelial lesion, SMILE),WHO(2014)女性生殖器官肿瘤分类将SMILE列为子宫颈原位腺癌的一种亚型[7]。Lastra等[1]对多中心病理库中具有SMILE特点的子宫颈病理进行回顾分析发现8例有SMILE相似形态但有明确间质浸润与破坏,因此命名为ISMC。在Lastra的研究中有7例仅为SMILE,平均年龄为29岁,8例ISMC平均年龄为44岁,两者相差15年。Onishi等[3]从445例子宫颈癌中筛选出12例具有复层产黏液上皮内病变的病例(3例为SMILE,平均年龄37岁;9例为ISMC,平均年龄47岁,两者相差10年)。这与子宫颈其它原位癌发展到浸润癌的自然病程10~15年的观点一致,提示SMILE是ISMC的前驱病变。
3.2 发病率国际子宫颈腺癌标准与分类(IEEC)将ISMC归为HPV相关子宫颈腺癌的亚型之一[2],作为新的疾病类型,由于病例数较少,之前多被误诊为腺鳞癌、低分化鳞癌、黏液表皮样癌及其它类型腺癌,其准确发病率尚不可知。Stolnicu等[2]对409例多中心子宫颈癌病例进行统计学分析,结果示ISMC约占所有子宫颈腺癌的2.4%。
3.3 病理特征经典形态为复层柱状上皮形成的实性癌巢呈浸润性生长,偶有不规则腔隙,但无明显腺腔,细胞复层镶嵌样排列,核圆形、卵圆形或轻微不规则形,胞质黏液可丰富也可稀少,巢周细胞呈栅栏状排列,凋亡小体及核分裂易见,间质或癌巢内可见中性粒细胞浸润。部分可见表面上皮原位成分SMILE。Stolnicu等[8]对29例纯ISMC及23例混合性ISMC病例形态进行分析发现,ISMC除上述经典形态,还可呈岛状、腺样、实性、乳头状、微乳头状、梁状生长,细胞通常有胞质内黏液,胞质可嗜酸、透亮、组织细胞样、毛玻璃样、印戒样,还可见Bizarre细胞核,可伴鳞状分化但无细胞间桥、角化,或有黏液渗出及玻璃样小球。本组6例均可见经典的实性癌巢,周边细胞呈栅栏状排列。2例胞质内黏液丰富,细胞核间隙增宽,其中1例伴Bizarre核异型;2例癌巢较不规则,黏液不明显。与文献报道的形态相似。
3.4 免疫表型与普通型子宫颈腺癌类似,弥漫表达上皮、腺上皮标志物,CK、CK7、CEA、p16强阳性,ER、PR阴性或少量阳性,p40、p63阴性或少量阳性,且主要分布于癌巢周边,少量可散在分布于巢内。PAX8阴性提示源于储备细胞,而p53多为野生型。免疫组化标记p16阴性不等同于无HPV感染[9],可行HPV原位杂交检测。黏液染色大多为阳性。本组6例ISMC成分的免疫表型均与上述符合。
3.5 电镜特征Onishi等[3]对1例SMILE行电镜检查发现,细胞表面有微绒毛,胞内黏液,线粒体丰富,特别是缺乏细胞张力丝,支持腺上皮来源。
3.6 鉴别诊断(1)黏液表皮样癌:罕见发生于子宫颈。有黏液细胞、鳞状分化的细胞及中间型细胞,高级别者多呈实性,与ISMC形态不易区分,但其p40、p63较多阳性,HPV阴性,有特征性的MAML2基因融合,而ISMC免疫表型与之相反。(2)低分化鳞癌:富于糖原时胞质透亮,特别是伴有少量胞质黏液时易与伴局灶鳞化的ISMC混淆,但前者p40、p63弥漫阳性,而在ISMC中阴性或少量巢周阳性。(3)浆液性癌:目前认为子宫颈原发浆样癌极少或不存在,可能为其它腺癌的浆样生长方式,其HPV阴性及p53突变,而ISMC相反,如Stolnicu等[8]报道的首例具微乳头样生长的ISMC,易被误诊为浆液性癌,但其HPV阳性及p53为野生型。(4)透明细胞癌:肿瘤细胞可呈实性生长,胞质透亮或嗜酸,可见Bizarre细胞核,玻璃样小球,与Stolnicu等[8]报道的ISMC不典型形态有相似性。但透明细胞癌多可见靴钉状细胞,而ISMC无靴钉状细胞,多呈复层实性巢状生长,巢周细胞呈栅栏状排列,免疫组化示巢周细胞p40阳性,HPV阳性。前者HNF1β、Napsin A阳性,HPV阴性,但HNF1β无特异性,其它腺癌包括ISMC中HNF1β也可阳性,因此HPV原位杂交检测结果更有价值。(5)腺鳞癌:ISMC最常被误诊为腺鳞癌。ISMC可局部似鳞状分化,但无角化、间桥,大多CK7、CEA、MUC6阳性,支持腺样分化,斑驳状或巢周少量p40、p63阳性支持一定程度鳞状分化;而腺鳞癌必须具备分化明确的腺样或鳞样成分。(6)腺样囊性癌:罕见,也有巢团状及巢周细胞呈栅栏状排列,但其本质为少量腺上皮及较多肌上皮内陷形成的假腺样排列,免疫组化标记肌上皮标志物p63、Calponin弥漫阳性,HPV阴性,有特征性的MYB基因融合。(7)腺样基底细胞癌:也有实性巢状及巢周细胞呈栅栏状排列,但其为低级别肿瘤,胞质内一般无黏液,核分裂、凋亡小体罕见,p40、p63弥漫阳性。
3.7 预后现有文献[1,5,8,10-13]多认为ISMC比其它HPV相关腺癌预后差、肿瘤较大、分级分期较高、Silva patern C比例高、更具侵袭性、有较高的复发和转移(尤其是肺转移)风险。
但也有研究认为其预后与普通型腺癌并无明显差异。Onishi等[3]报道的12例具有复层产黏液上皮内病变形态的子宫颈癌及Lei等[14]报道的3例ISMC随访19~59.3个月,均存活。Stolnicu等[13]研究认为子宫颈HPV相关腺癌与非HPV相关腺癌在伴有淋巴结转移时总生存期、无瘤生存期或无进展生存期差异无统计学意义。但现有研究报道的样本数量均较小,结论重复性差[9],肿瘤分期和分级、外科手术方式及术后治疗的选择均可影响预后分析。另据Stolnicu等[15]报道纯ISMC(ISMC成分≥90%)和混合性ISMC(ISMC成分<90%)在5年总生存期、无复发生存期差异无统计学意义。因此,日常诊断中识别出ISMC成分比判断纯ISMC还是混合性ISMC可能更具有临床意义。
本组6例均呈Silva patern C浸润性生长。4例分期较早,间质浸润较浅,术后随访均无复发转移,另2例分期较迟,出现进展转移,预后明显较差,因例数较少差异无统计学意义。
综上,ISMC是新近认识的子宫颈HPV相关性浸润性腺癌,具有独特的形态学及免疫表型特征,临床分期常较高,预后较差。因此,识别ISMC成分具有临床意义。目前文献报道ISMC大多为经典形态,少数为不典型形态,而预后分析结果明显不一致,可重复性需要积累更多病例总结验证。

