浸润性乳腺癌中miR-608和MIF的表达及临床意义
张 伟,刘 霞,何 雷,张伟璇,焦南林
2020年全球癌症报告显示,乳腺癌的发病率和病死率位居女性癌症的首位[1]。乳腺癌术后复发和转移是导致患者死亡的主要原因,因此,探索乳腺癌发生、发展机制和寻找新的分子靶点具有重要意义。非编码小RNA(microRNAs, miRNAs)具有调节信使RNA翻译和降解的功能,其在乳腺癌的发生、进展和治疗中发挥重要作用[2-3]。文献报道miR-608可以调控AKT/FOXO3a信号通路抑制膀胱癌的增殖[4],还可以结合TFAP4蛋白抑制非小细胞肺癌的迁移[5]。关于乳腺癌中miR-608的报道较少[6],miR-608在乳腺癌中的表达及其生物学功能尚不清楚。巨噬细胞移动抑制因子(macrophagemigration inhibitory factor, MIF)是一种多功能细胞因子,在免疫调节、炎症反应及肿瘤发生中均具有重要作用[7]。文献报道肺腺癌[8]和脑胶质瘤[9]中miR-608靶向结合MIF调控肿瘤的侵袭和转移。本文通过检测乳腺癌中miR-608与MIF的表达,分析两者表达的相关性,初步探讨miR-608调控MIF促进乳腺癌进展的可能机制。
1 材料与方法
1.1 临床资料收集2016年1月~2018年4月我院存档的行乳腺癌改良根治术患者的新鲜组织25例和石蜡组织82例(乳腺癌和癌旁正常乳腺组织)。患者均为女性,新鲜组织来源患者年龄29~77岁(中位年龄53岁),肿瘤直径1.2~4.5 cm(中位直径2.5 cm),组织学分级:Ⅰ+Ⅱ级14例、Ⅲ级11例,淋巴结转移13例,TNM分期:Ⅰ期6例、Ⅱ期12例、Ⅲ期7例;石蜡组织来源患者年龄36~80岁(中位年龄51岁),肿瘤直径0.6~8.0 cm(中位直径2.7 cm),组织学分级:Ⅰ+Ⅱ级62例、Ⅲ级20例,淋巴结转移35例,TNM分期:Ⅰ期15例、Ⅱ期46例、Ⅲ期21例。入组标准:所有患者均未接受术前新辅助治疗,样本均为初治手术切除标本,经组织病理学确诊为非特殊型浸润性乳腺癌(invasive breast carcinoma of no special type, IBC-NST)。
1.2 数据库分析使用TargetScan Human(http://www.targetscan.org/vert_72/)数据库预测miR-608和MIF的结合位点。
1.3 方法
1.3.1qRT-PCR 采用SYBR Green qPCR Mix qRT-PCR试剂盒(德国DBI公司)和All-in-One miRNA qRT-PCR Detection System试剂盒(美国基因复能公司)分别检测MIF和miR-608的表达;qRT-PCR引物序列:MIF上游引物:5′-CGGACAGGGTC TACATCAACTATTA-3′,下游引物:5′-ACCGTTTAT TTCTCCCCACCA-3′;GAPDH上游引物:5′-GGAGC GAGATCCCTCCAAAAT-3′,下游引物:5′-GGCTGTT GTCATACTTCTCATGG-3′; miR-608上游引物:5′-A GGGGTGGTGTTGGGACAGCTCCGT-3′,下游引物:5′-ACGGAGCTGTCCCAACACCACCCCT-3′;U6上游引物:5′-GATTCCTATGTGGGCGACGAG-3′,下游引物:5′-CCATCTCTTGCTCGAAGTCC-3′。以Folds=2-△△Ct表示组间相对倍比关系,GAPDH和U6作为内参。
1.3.2免疫组化及FISH检测 免疫组化染色采用EliVision两步法,ER(克隆号SP1)、PR(克隆号SP2)、Ki-67(克隆号MIB1)及EliVision试剂盒均购自福州迈新生物公司;HER-2(克隆号4B5)检测使用Ventana全自动免疫组化检测平台;MIF(克隆号E7T1W,稀释比1 ∶200)购自Cell Signaling公司,以人甲状腺组织滤泡上皮细胞染色作为阳性对照,PBS代替一抗作为空白对照。HER-2 FISH探针由广州安必平医药科技公司提供。
1.3.3结果判读 免疫组化及FISH判读由两位高年资乳腺专科病理医师独立阅片。MIF阳性定位于胞质。(1)按癌细胞阳性比例进行评分:阳性细胞数<5%为0分,5%~25%为1分,26%~50%为2分,>50%为3分;(2)按着色强度进行评分:无阳性着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;将两项得分结果相乘,>4分为阳性[10]。
HER-2免疫组化0~1+为阴性,3+为阳性,2+行FISH检测,HER-2基因扩增为阳性,无扩增为阴性。Ki-67计数热点区胞核阳性数。乳腺癌分子分型依据2019年st Gallen乳腺癌会议共识:管腔A型(ER≥1%,PR>20%,Ki-67增殖指数<30%且HER-2阴性)、管腔B型(一种为ER≥1%,Ki-67增殖指数≥30%或PR<20%,HER-2阴性;另一种为ER≥1%、PR>20%及HER-2阳性,任何水平Ki-67)、HER-2过表达型(ER及PR阴性,HER-2阳性)和三阴型(ER、PR及HER-2均阴性)[11]。
1.3.4Western blot法 将miR-608 mimics及miR-608 inhibitor(苏州吉玛基因公司)转染人乳腺癌细胞株SK-BR-3(HER-2过表达型),提取蛋白及测定蛋白浓度后进行Western blot检测,一抗包括MIF(稀释比1 ∶1 000,美国Cell Signaling公司,#87501)和GAPDH(稀释比1 ∶1 000,武汉三鹰生物公司,#10494-1-AP)。
1.4 随访对82例IBC-NST患者术后通过电话随访19~64个月,中位随访时间46个月,其中2例失访。无进展生存期(progression free survival, PFS)定义为从患者手术后至出现乳腺癌进展(包括复发或转移)或任何原因的死亡之间的时间;总生存期(overall survival, OS)定义为从患者手术后至因任何原因死亡或随访终止之间的时间。

2 结果
2.1 IBC-NST组织中miR-608和MIF mRNA的表达及两者表达的相关性采用qRT-PCR检测25例IBC-NST和癌旁正常乳腺组织中miR-608和MIF mRNA的表达,结果显示:miR-608在IBC-NST组织中的表达水平显著低于癌旁正常乳腺组织(t=2.934,P<0.01,图1A、B);MIF mRNA在IBC-NST组织中的表达显著高于癌旁正常乳腺组织(t=4.850,P<0.000 1,图1C、D)。以上结果提示miR-608低表达和MIF mRNA高表达可能与IBC-NST的发生相关。利用IBC-NST和癌旁正常乳腺组织中miR-608和MIF mRNA相对表达量制作ROC曲线评价两者的诊断价值,结果显示:miR-608的AUC为0.725,敏感性为58.2%,特异性为86.8%(图2A);MIF mRNA的AUC为0.824,敏感性为70.5%,特异性为94.3%(图2B)。结果提示,检测miR-608和MIF mRNA的表达对于鉴别正常乳腺组织和IBC-NST组织具有一定的诊断价值。Pearson相关性分析结果显示,25例IBC-NST组织中miR-608和MIF mRNA的表达呈负相关(r=-0.669 5,P=0.000 3,图3A、B)。
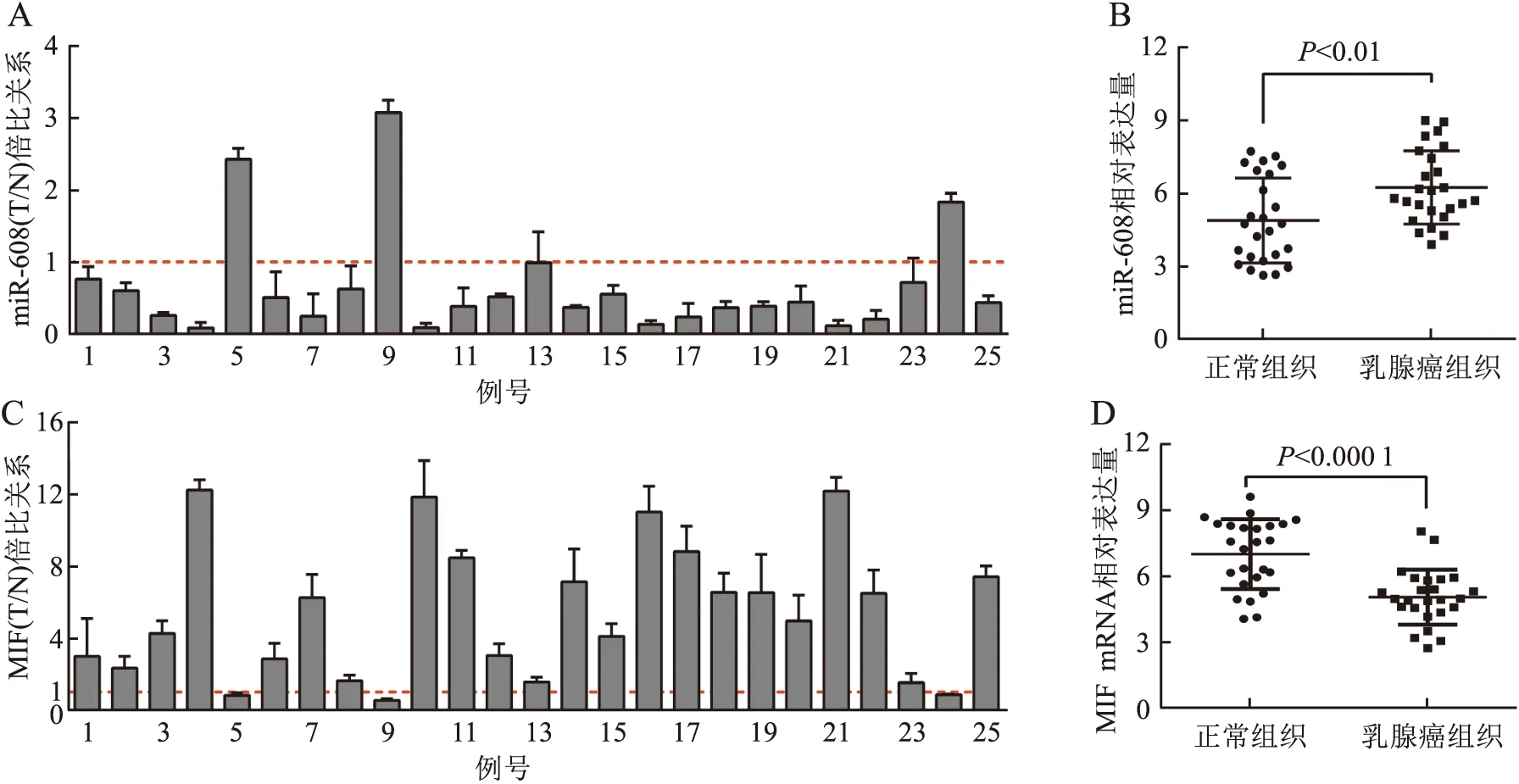
图1 A.qRT-PCR检测25例IBC-NST组织和癌旁正常乳腺组织中miR-608表达量的倍比关系:T. IBC-NST组织;N.癌旁正常乳腺组织;B.qRT-PCR检测25例IBC-NST组织和癌旁正常乳腺组织中miR-608的相对表达量;C.qRT-PCR检测25例IBC-NST组织和癌旁正常乳腺组织中MIF mRNA表达量的倍比关系:T. IBC-NST组织;N.癌旁正常乳腺组织;D.qRT-PCR检测25例IBC-NST组织和癌旁正常乳腺组织中MIF mRNA的相对表达量

图2 A.ROC曲线评估miR-608的诊断价值;B.ROC曲线评估MIF的诊断价值

图3 A.25例IBC-NST组织中miR-608与MIF mRNA相对表达量折线图;B.Pearman相关性分析25例IBC-NST组织中miR-608与MIF mRNA表达的相关性
2.2 IBC-NST组织中miR-608和MIF mRNA表达与临床病理特征的关系利用miR-608或MIF mRNA表达量的中位值将25例IBC-NST分为高表达组和低表达组。有淋巴结转移组miR-608的低表达率(69.2%,9/13)显著高于无淋巴结转移组(25.0%,3/12)(P<0.05);TNM分期Ⅲ期组miR-608的低表达率(85.7%,6/7)显著高于TNM分期Ⅰ+Ⅱ期组(33.3%,6/18)(P<0.05);有淋巴结转移组MIF mRNA的高表达率(76.9%,10/13)显著高于无淋巴结转移组(25.0%,3/12)(P<0.05);TNM分期Ⅲ期组MIF mRNA的高表达率(100%,7/7)显著高于TNM分期Ⅰ+Ⅱ期组(33.3%,6/18)(P<0.05)。而在患者年龄、肿瘤直径及组织学分级方面,miR-608和MIF mRNA的表达差异均无统计学意义。miR-608表达与淋巴结转移及TNM分期(P<0.05)呈负相关,MIF mRNA表达与淋巴结转移及TNM分期(P<0.05)呈正相关,两者表达均与患者年龄、肿瘤直径及组织学分级无关(P>0.05,表1)。

表1 miR-608和MIF mRNA表达与IBC-NST临床病理特征的关系[n(%)]
2.3 IBC-NST细胞中miR-608调控MIF表达的初步机制初探通过TargetScan数据库预测miR-608与MIF的结合位点,结果显示两者结合位点类型是“8mer”,即miR-608第2~8位种子序列与MIF-3′UTR区碱基存在完全互补配对;“context ++ score percentile”为99,该评分反应结合位点的保守性,数值越接近100,表示该位点是真正结合靶点的概率越大(图4)。将人乳腺癌细胞株SK-BR-3转染miR-608 mimics和inhibitor后,qRT-PCR检测结果显示,与NC组(对照组)相比,转染miR-608 mimics后miR-608表达量显著升高(t=24.84,P<0.000 1,图5A),MIF mRNA表达量显著降低(t=20.05,P<0.000 1,图5B);Western blot检测结果显示,与NC组相比,转染miR-608 mimics后MIF蛋白表达显著下降(图5C)。与inh-NC组(对照组)相比,转染miR-608 inhibitor后miR-608表达显著降低(t=49.07,P<0.000 1,图5D),MIF的mRNA(t=13.34,P<0.001,图5E)和蛋白表达显著增加(图5F)。以上结果提示:miR-608负向调控MIF表达,两者间可能存在位点特异性结合关系。
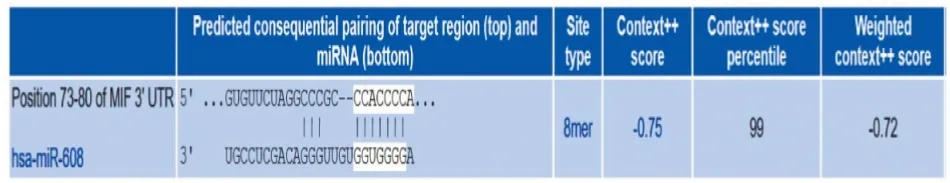
图4 TargetScan数据库预测miR-608和MIF存在结合位点

图5 A.qRT-PCR检测人乳腺癌细胞株SK-BR-3转染miR-608 mimics后miR-608的表达;B.qRT-PCR检测人乳腺癌细胞株SK-BR-3转染miR-608 mimics后MIF mRNA的表达;C.Western blot法检测人乳腺癌细胞株SK-BR-3转染miR-608 mimics后MIF蛋白表达;D.qRT-PCR检测人乳腺癌细胞株SK-BR-3转染miR-608 inhibitor后miR-608的表达;E.qRT-PCR检测人乳腺癌细胞株SK-BR-3转染miR-608 inhibitor后MIF mRNA的表达;F.Western blot法检测人乳腺癌细胞株SK-BR-3转染miR-608 inhibitor后MIF蛋白的表达
2.4 免疫组化法检测IBC-NST组织中MIF蛋白的表达及其与临床病理特征的关系免疫组化结果显示,82例IBC-NST和癌旁正常乳腺组织中MIF阳性率分别为68.3%(56/82)和31.7%(26/82),两组间差异有统计学意义(χ2=21.951,P<0.001,图6)。在有淋巴结转移乳腺癌组中MIF的阳性率(82.9%,29/35)显著高于无淋巴结转移组(57.4%,27/47)(P<0.05)。在TNM分期Ⅰ期乳腺癌组中MIF的阳性率(40%,6/15)显著低于TNM分期Ⅱ期(78.3%,36/46)和Ⅲ期(66.7%,14/21)乳腺癌组(P<0.05)。82例IBC-NST中管腔A型占22.0%(18/82),管腔B型占52.4%(43/82),HER-2过表达型占13.4%(11/82),三阴型占12.2%(10/82),MIF在HER-2过表达型(90.9%,10/11)和三阴型(90.0%,9/10)乳腺癌组中的阳性率显著高于管腔A型(44.4%,8/18)和管腔B型组(67.4%,29/43),差异有统计学意义(P<0.05)。p53突变型(79.2%,38/48)IBC-NST组中MIF的阳性率显著高于p53野生型组(52.9%,18/34)。然而患者年龄、肿瘤发生侧别、肿瘤直径及组织学分级方面,MIF的阳性率差异均无显著性(P>0.05)。综上,82例IBC-NST中MIF表达与淋巴结转移、TNM分期、分子分型及p53突变相关(P<0.05),与患者年龄、肿瘤部位、肿瘤直径、组织学分级均无关(表2)。

表2 MIF蛋白表达与IBC-NST临床病理特征的相关性[n(%)]

图6 IBC-NST组织中MIF的表达,EliVision两步法:A.MIF在三阴型乳腺癌组织中阳性;B.MIF在HER-2过表达型乳腺癌组织中阳性;C.MIF在三阴型乳腺癌癌旁正常乳腺组织中阴性;D.MIF在HER-2过表达型乳腺癌癌旁正常乳腺组织中阴性
2.5 IBC-NST组织中MIF表达与患者预后的关系获得随访的80例IBC-NST患者中有13例疾病进展(其中5例患者因乳腺癌死亡,余8例患者出现乳腺癌复发或转移)。80例IBC-NST患者的3年和5年PFS分别为90%(72/80)和83.8%(67/80);3年和5年OS分别为95%(76/80)和93.8%(75/80)。利用GraphPad-Prism 6.0软件绘制生存曲线结合Gehan-Breslow-Wilcoxon检验分析,结果显示MIF阴性患者(平均47.2±9.87个月)的OS优于MIF阳性患者(平均31.2±11.99个月),但差异无统计学意义(χ2=1.448,P=0.229,图7A);MIF阴性患者(平均55.1±6.52个月)的PFS优于MIF阳性患者(平均42.5±9.99个月),差异有统计学意义(χ2=4.196,P=0.041,图7B)。

图7 A.MIF表达与IBC-NST患者OS的关系;B.MIF表达与IBC-NST患者PFS的关系
3 讨论
目前乳腺癌已然成为威胁女性健康的第一杀手,从表观遗传学角度深入挖掘其发生、发展机制,将为乳腺癌诊治提供新思路。miRNAs是具有20~22个核苷酸的非编码小RNA,是重要的细胞功能和发育调控因子。目前生物界存在的miRNA主要包括细胞内和细胞外miRNA,在哺乳动物细胞中,细胞内miRNA的功能由细胞器驱动,细胞外miRNA通过循环在细胞外空间发挥通信作用[12]。miRNA主要通过诱导其靶基因的mRNA降解或抑制其蛋白翻译发挥作用,可以将其分为促癌miRNA、抑癌miRNA及促癌和抑癌双重作用miRNA[13]。Fong等[14]研究发现miR-122可促进乳腺癌的转移,动物实验亦证实抑制miR-122能恢复远处器官(包括脑和肺)的葡萄糖摄取,降低乳腺癌的转移率。miR-199a-5p通过调节EGF和SP1下调ERK5表达抑制乳腺癌细胞的侵袭[15]。miR-608是新近报道的miRNA分子,目前研究显示其在不同肿瘤中发挥的作用并不一致。miR-608通过靶向BRD4抑制细胞增殖,在肝癌中发挥抑癌作用[16]。在肺癌中miR-608通过与靶基因AKT2结合促进细胞凋亡,发挥抑癌作用[17]。Xiang等[18]报道显示,在膀胱癌中miR-608发挥促进肿瘤增殖和抑制肿瘤凋亡的作用。目前,miR-608在乳腺癌中的表达情况及其生物学功能尚未见报道。本实验结果显示,miR-608在IBC-NST组织中的表达显著低于癌旁正常乳腺组织,并且miR-608低表达与淋巴结转移及TNM高分期相关,以上结果提示miR-608可能在IBC-NST中发挥抑癌作用。
MIF定位于人染色体22q11.2,是由115个氨基酸组成的进化保守蛋白[19],在炎症反应和免疫调节中发挥重要功能。近年来,MIF与肿瘤的关系报道较多,其在非小细胞肺癌[20]、黑色素瘤[21]、膀胱癌[22]和乳腺癌[23]中均发现MIF表达上调。本实验结果与上述一致,本实验从mRNA和蛋白水平均检测出IBC-NST组织中MIF高表达;且MIF表达与淋巴结转移、TNM高分期、分子分型及p53突变相关,MIF在HER-2过表达型和三阴型乳腺癌中的阳性率显著高于管腔A和管腔B型。Wang等[24]对732例乳腺癌的研究显示,MIF在三阴型乳腺癌中的表达显著高于管腔型(P<0.05)。目前研究显示,人类半数以上的恶性肿瘤均存在p53基因突变,p53的突变形式包括错义突变和无义突变[25],乳腺癌中p53蛋白表达大多数为错义突变模式[26]。Hainaut等[27]报道p53突变在基底细胞样型和HER-2过表达型乳腺癌中常见(分别为65%和53.4%),在管腔A和管腔B型中少见(分别为9.3%和24.8%),且p53突变在HER-2过表达型中与患者不良预后相关。Jung等[28]在乳腺癌细胞株MCF7和结直肠癌细胞株HCT116中均发现,MIF通过稳定胞质中MDM2和p53的结合来抑制后者的活性。以上研究结果提示:在乳腺癌不同分子亚型中MIF蛋白表达与p53基因突变关系密切,且两者间可能存在潜在的作用机制。此外,对本组IBC-NST患者进行生存分析,结果显示MIF表达与患者PFS呈负相关。Wang等[24]分析3 951例乳腺癌微阵列数据亦发现,MIF高表达与患者总生存率降低相关(P<0.01)。综上,MIF可能是IBC-NST患者不良预后预测因子。目前,针对MIF靶点相关治疗的研究取得较大进展;体外实验证实MIF抑制剂ISO-1可显著抑制结肠癌和黑色素瘤细胞的增殖[29]。MIF小分子抑制剂CPSI-1306能抑制小鼠原位乳腺癌模型的肿瘤生长和转移[30]。随着研究的深入,MIF抑制剂可能进入临床实验阶段。
马颖光等[31]报道miR-451可直接结合MIF的3′-UTR区来调控人结直肠癌细胞的增殖、侵袭和迁移。李晓娜等[32]报道miR-451靶向MIF,经由PI3K/AKT通路抑制甲状腺癌细胞增殖和促进其凋亡。由此可见,在不同肿瘤中MIF接受同种miRNA调控是常见的分子事件。Yu等[8]研究发现miR-608通过靶向MIF抑制肺腺癌侵袭和迁移。Wang等[9]报道miR-608负向调控MIF表达介导PI3K/AKT和JNK通路失活,抑制胶质瘤细胞增殖、侵袭和迁移。miR-608通过下调EGFR和p53介导MAPK信号通路调控造釉细胞瘤细胞增殖、分化、凋亡和细胞周期。本实验结果显示,在IBC-NST组织中miR-608与MIF表达呈负相关;在人乳腺癌细胞株SK-BR-3中,miR-608模拟物和抑制剂能负调控MIF的mRNA和蛋白表达;TargetScan数据库提示miR-608和MIF存在高评分结合位点。因此,笔者推测miR-608可能通过结合MIF的3′-UTR区在IBC-NST中发挥抑癌作用。本课题组后续将通过设计双荧光素酶报告基因实验等进一步验证两者的结合关系,并深入探索miR-608和MIF结合后其下游的信号通路是否与p53基因突变相关。
综上所述,在IBC-NST中miR-608呈低表达,MIF呈高表达,两者均与不良临床病理特征相关;在人乳腺癌细胞株中miR-608负向调控MIF表达。miR-608和MIF可能是IBC-NST的预后标志物和潜在的治疗靶点。

