血清反应因子N端片段对鼻咽癌细胞增殖及迁移能力的影响*
袁建玲, 邵钟铭, 邹园, 伍彩霞, 郑阿秀, 邢敬慈,白建荣, 揭伟,2△, 申志华△
血清反应因子N端片段对鼻咽癌细胞增殖及迁移能力的影响*
袁建玲1,3, 邵钟铭1, 邹园1, 伍彩霞1, 郑阿秀1, 邢敬慈1,白建荣1, 揭伟1,2△, 申志华1△
(1广东医科大学基础医学院病理生理学教研室,广东 湛江 524023;2海南医学院急救与创伤研究教育部重点实验室,海南 海口 571199;3北京大学深圳医院病理科,广东 深圳 518036)
探讨血清反应因子N端剪切片段(SRF-N)对鼻咽癌(NPC)细胞增殖和迁移能力的影响与机制。应用SRF全长(SRF-Full,1~508 aa)、SRF-N(1~254 aa)及阴性对照(NC)慢病毒颗粒感染人NPC细胞系6-10B,经嘌呤霉素抗性筛选结合Western blot检测Flag标签化融合蛋白的表达获得单克隆细胞株,CCK-8实验分析细胞活力的改变,划痕损伤修复实验和Transwell实验分析细胞迁移能力,细胞-基质黏附实验分析细胞黏附能力,Western blot检测细胞增殖相关蛋白增殖细胞核抗原(PCNA)和上皮-间充质转化(EMT)相关指标的表达,双萤光素酶报告基因实验检测SRF-Full和SRF-N对启动子的调节效应。成功用SRF-Full、SRF-N及NC慢病毒感染6-10B细胞,经嘌呤霉素抗性筛选结合Flag标签蛋白的表达获得相应的单克隆细胞株,分别标记为6-10BSRF-Full、6-10BSRF-N和6-10BNC。与6-10BNC细胞相比,6-10BSRF-Full细胞活力、迁移能力和与基质的黏附能力均显著增强(<0.01),而6-10BSRF-N细胞较6-10BSRF-Full细胞活力、迁移能力及黏附能力均显著下降(<0.01)。6-10BSRF-Full细胞中波形蛋白(vimentin)、神经钙黏素(N-cadherin)和Snail1的表达水平较6-10BNC细胞显著升高(<0.01),上皮钙黏素(E-cadherin)表达水平显著下降(<0.01);而6-10BSRF-N细胞中vimentin、N-cadherin和Snail1的表达水平较6-10BSRF-Full细胞显著下降(<0.05),E-cadherin表达水平显著上升(<0.05)。双萤光素酶活性实验结果表明,与NC相比,SRF-Full显著激活启动子(<0.001);与SRF-Full相比,SRF-N显著抑制启动子活性(<0.01)。SRF-Full促进而SRF-N抑制NPC细胞的增殖和迁移;SRF-N抑制启动子活性而介导NPC的EMT;SRF-N具有潜在的抗NPC作用。
鼻咽癌;血清反应因子N端片段;细胞增殖;细胞迁移;上皮-间充质转化
鼻咽癌(nasopharyngeal carcinoma, NPC)是起源于鼻咽黏膜的上皮性恶性肿瘤,远处转移和局部复发是影响患者预后的关键因素。目前对NPC侵袭转移的机制仍不甚清楚。课题组前期已经报道了部分基因的表达异常与NPC的增殖转移相关,丰富了NPC发病学理论[1-3]。新近,有关单细胞测序技术在NPC上的应用,更为阐明基因、环境因素在NPC的发病机制提供了新思路[4-5]。尽管如此,进一步发现和鉴定介导NPC细胞侵袭转移的关键因素,仍然是NPC防治研究的重要内容。
血清反应因子(serum response factor, SRF)属于MADS(Mcm1, Agamous, Deficiens and SRF)转录因子家族成员,进化保守,在生物体内普遍存在。通过与辅因子相互作用并结合CArG序列元件[CC(A/T)6GG],SRF调控了超过200个下游靶基因的转录表达,涉及细胞的生长、迁移、骨架形成等方面,其表达和活性的异常与包括肿瘤在内的很多人类疾病关系密切[6-9]。SRF过表达促进某些肿瘤的临床进展,提示SRF可能是潜在的肿瘤预后判断和治疗靶标[8-10]。
2003年Chang等[11]报道在心力衰竭的心脏组织中全长SRF(SRF-Full, 1~508 aa)可被caspase-3剪切成N端片段(SRF-N, 1~254 aa)及C端片段(SRF-C, 255~508 aa)。由于SRF-N含有完整MADS结合域但不含有催化结构域,因此可与SRF-Full竞争性结合靶基因的CArG盒,从而抑制下游基因的转录激活。本研究假设SRF-N具有一定的抗肿瘤特性,以NPC细胞系6-10B为对象,体外研究过表达SRF-N对NPC细胞增殖、迁移、黏附、上皮-间充质转化(epithelial-mesenchymal transition, EMT)等特性的影响,为基于SRF-N靶点的抗NPC研究提供参考资料。
材料和方法
1 细胞系
NPC细胞系6-10B为南方医科大学病理学系惠赠,我室常规培养传代后液氮冻存。293T细胞购自中国科学院上海细胞库。
2 主要试剂及仪器
基于pEZX-PG04.1构建的启动子、阴性对照(negative contorl, NC)及突变型(mutant, Mut)启动子过表达质粒,萤光素酶表达质粒,SRF-Full和SRF-N过表达质粒(上海吉凯基因化学技术有限公司);Matrigel(Corning);鼠抗人Flag单克隆抗体(Sigma);兔抗人E-cadherin和增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)单克隆抗体(CST);鼠抗人N-cadherin、vimentin和β-actin单克隆抗体,兔抗人Snail1单克隆抗体,HRP或FITC标记的II抗(武汉三鹰技术有限公司);X-tremeGENE™ HP DNA转染试剂和定量PCR试剂盒(Roche);Dual-Luciferase®Reporter Assay System (Promega);RNA抽提试剂盒、RT试剂盒和Lipofectamine 3000(Invitrogen);PCR引物(上海生工生物工程有限公司);胎牛血清(fetal bovine serum, FBS)、RPMI-1640培养液和DMEM培养液(HyClone);蛋白酶抑制剂、RIPA蛋白裂解液和BCA试剂盒(江苏碧云天生物技术有限公司)。ECL发光剂、PVDF膜、细胞培养箱、全波长酶标仪(Thermo Fisher Scientific);定量PCR仪(Roche);荧光显微镜(Olympus);凝胶成像分析系统(上海天能科技有限公司);蛋白电泳仪(Bio-Rad)。
3 方法
3.1细胞培养用新配制的RPMI-1640完全培养液(含10% FBS、1×105U/L青霉素和0.1 mg/L链霉素)重悬复苏后离心沉淀的6-10B细胞,经吹打混匀后接种于培养皿,并置于37 ℃、5% CO2及饱和湿度培养箱内培养,每2~3 d更换培养液,倒置显微镜下观察细胞形态。待贴壁细胞完全生长汇合后,用0.25%胰酶(含0.02% EDTA)消化传代,待细胞扩增至一定数量后,收获细胞进行相关实验。293T细胞用含10% FBS的DMEM培养液重悬,置于37 ℃、5% CO2及饱和湿度培养箱内培养,每2~3 d更换培养液。
3.2慢病毒感染SRF-N过表达、SRF-Full过表达及NC过表达慢病毒颗粒参考既往方法获得[12]。6-10B细胞常规培养,0.25%胰酶消化后完全培养液重悬,以每孔4×104个细胞接种于6孔板中,分为3组,标记为阴性对照病毒(6-10BNC)组、SRF-N过表达慢病毒(6-10BSRF-N)组及SRF-Full过表达慢病毒(6-10BSRF-Full)组。当细胞融合度达到60%~70%时,进行病毒感染。以感染复数100 感染6-10B细胞,计算SRF-Full、SRF-N及NC病毒的体积,0.5 mL polybrene病毒工作液稀释各组病毒;将稀释好的病毒液加入6孔板内进行感染,12 h 内弃去病毒液,更换2 mL新鲜的完全培养液;24 h后换液;48 h后添加嘌呤霉素(2.0 mg/L)筛选;72 h后换液,在荧光显微镜下观察GFP信号来判断感染效果,培养细胞以备后续实验。
3.3单克隆细胞株筛选6-10BSRF-Full、6-10BSRF-N和6-10BNC混合克隆细胞经过2.0 mg/L嘌呤霉素抗性筛选3 d后,以0.5 mg/L的浓度维持培养。采用有限稀释法,将这3种细胞分别用0.25%胰酶消化并转移至96孔板,调整浓度为每孔1个细胞,待生长出单克隆细胞团后,荧光显微镜下观察绿色荧光情况,并在孔板背面相应位置做好标记。将转染阳性的单克隆细胞株经消化传代扩大培养,并通过Western blot检测含Flag标签化的融合蛋白的表达水平。
3.4CCK-8法检测细胞活力将上述3组细胞按每孔2×103个共100 μL接种于96孔板, 每组6个复孔,边缘孔用无菌PBS填充,过夜孵育。贴壁后,分别在培养时点0、24、48及72 h向每孔细胞加入10 μL CCK-8试剂,轻轻敲击培养板混匀液体,37 ℃继续孵育4 h,使用酶标仪测定450 nm吸光度()值。
3.5Western blot提取各组细胞总蛋白,BCA法定量蛋白浓度,取50 μg蛋白用于凝胶电泳。蛋白转移至PVDF膜,经脱脂奶粉封闭后加入Ⅰ抗(Flag, 1∶3 000; PCNA, 1∶1 000; N-cadherin, 1∶500; E-cadherin, 1∶500; vimentin, 1:500; Snail1, 1∶1 000; β-actin, 1∶2 000)4 ℃过夜孵育,TBST洗涤,HRP标记的IgG Ⅱ抗(1∶3 000)室温孵育2 h,ECL发光后凝胶成像系统扫描获得目的蛋白条带。
3.6细胞基质黏附实验配制Matrigel,每孔2 μg铺于96孔板内。挑选对数生长期状态良好的上述3种细胞,消化计数,调整细胞浓度,以每孔4×104接种在铺胶的96孔板中,每组4个复孔;置于37 ℃、5% CO2培养箱内培养2和4 h;弃上清,PBS冲洗3次;每孔加入100 μL含10% FBS的RPMI-1640培养液和10 μL CCK-8液,继续培养4 h;酶联免疫检测仪上450 nm处测定各孔的值(代表黏附细胞数)。
3.7Transwell迁移实验Transwell小室置于24孔板。上述3种培养细胞消化后用含0.5% FBS的DMEM培养液重悬,取2×104个细胞接种于Transwell小室的上室,体积为200 μL。Transwell小室的下室中加含10% FBS的DMEM培养液500 μL,置于37°C、5% CO2、饱和湿度的培养箱中继续培养24 h,培养结束后取出小室并用4%中性甲醛固定15 min,0.1%结晶紫液染色5 min,用棉签小心擦除小室上室面细胞,PBS洗涤后在20×显微镜物镜下观察并拍照。以穿膜的细胞数差异代表细胞运动能力的改变。每张膜选2个典型视野,每组重复3孔。
3.8划痕损伤修复实验参考既往方法进行操作[2]。简言之,将上述3种细胞接种6孔板培养至单层汇合状态,用200 μL吸头尖每孔划3条平行线,PBS洗去未贴壁细胞,加入含0.5% FBS的RPMI-1640培养液,于培养时点0、24和48 h镜下观察并拍照,ImageJ 8.0软件分析伤口愈合程度。
3.9双萤光素酶报告基因实验293T细胞接种24孔板,按照X-tremeGENE™ HP转染试剂使用说明书将表达质粒转染至目的细胞。实验分组:Promoter-NC+SRF-Full组(SRF-Full过表达质粒组)、Promoter-NC+SRF-N组(SRF-N过表达质粒组)、Promoter-Snail1+SRF-Full组(启动子和SRF-Full过表达质粒组)、Promoter-Snail1+SRF-N组(启动子和SRF-N过表达质粒组)、Promoter-Mut+SRF-Full(启动子突变体和SRF-Full过表达质粒组)和Promoter-Mut+SRF-N组(启动子突变体和SRF-N过表达质粒组)。每孔启动子质粒、SRF表达质粒和萤光素酶表达质粒按0.5 μg∶0.5 μg∶0.02 μg转染,每组3个复孔,按照说明书操作检测萤光素酶活性。根据软件预测,人基因启动子存在4个潜在的SRF结合位点,分别位于转录起始位点上游118~101 nt (#1, 5'-CTTCACTAAACGAGGCTG-3')、786~775 nt (#2, 5'-GCCCAAGTGAGG-3')、1 395~1 378 nt (#3, 5'-AAACACTGGATAAGGGAA-3')和1 935~1 924 nt (#4, 5'-GGCCTTATCTGC-3')处。本研究使用的突变体启动子序列将上述#1和#3位点同时突变为5'-GGGCTCTATGGGGGGTTT-3', #2和#4位点同时突变为5'-CTATGGGGGGTT-3'。
4 统计学处理
使用GraphPad Prism 8.0软件进行分析。计量资料数据采用均数±标准差(Mean±SD)表示。组间比较采用单因素方差分析或非配对检验。以<0.05为差异有统计学意义。
结果
1 成功筛选SRF-Full及SRF-N过表达单克隆6-10B细胞
按照感染复数为100加入SRF-Full、SRF-N过表达和NC慢病毒,72 h后荧光显微镜下观察到6-10B细胞中有较强的胞核绿色荧光信号,经嘌呤霉素筛选后感染效率达95%以上(图1A),通过Western blot成功在预测分子量大小的位置检测到SRF-Full-Flag及SRF-N-Flag融合蛋白(图1B)。采用有限稀释法, 将转染阳性细胞接种至96孔板进行单克隆细胞筛选,最终挑选出4个NC,2个SRF-N和4个SRF-Full过表达单克隆细胞。Western blot结果显示,10个单克隆细胞株的融合蛋白SRF-Full-Flag及SRF-N-Flag的表达水平不等(图2)。结合细胞形态改变的情况,最终挑选第1号(#1)6-10BNC、第1号(#1)6-10BSRF-N及第3号(#3)6-10BSRF-Full单克隆作为后续实验对象。
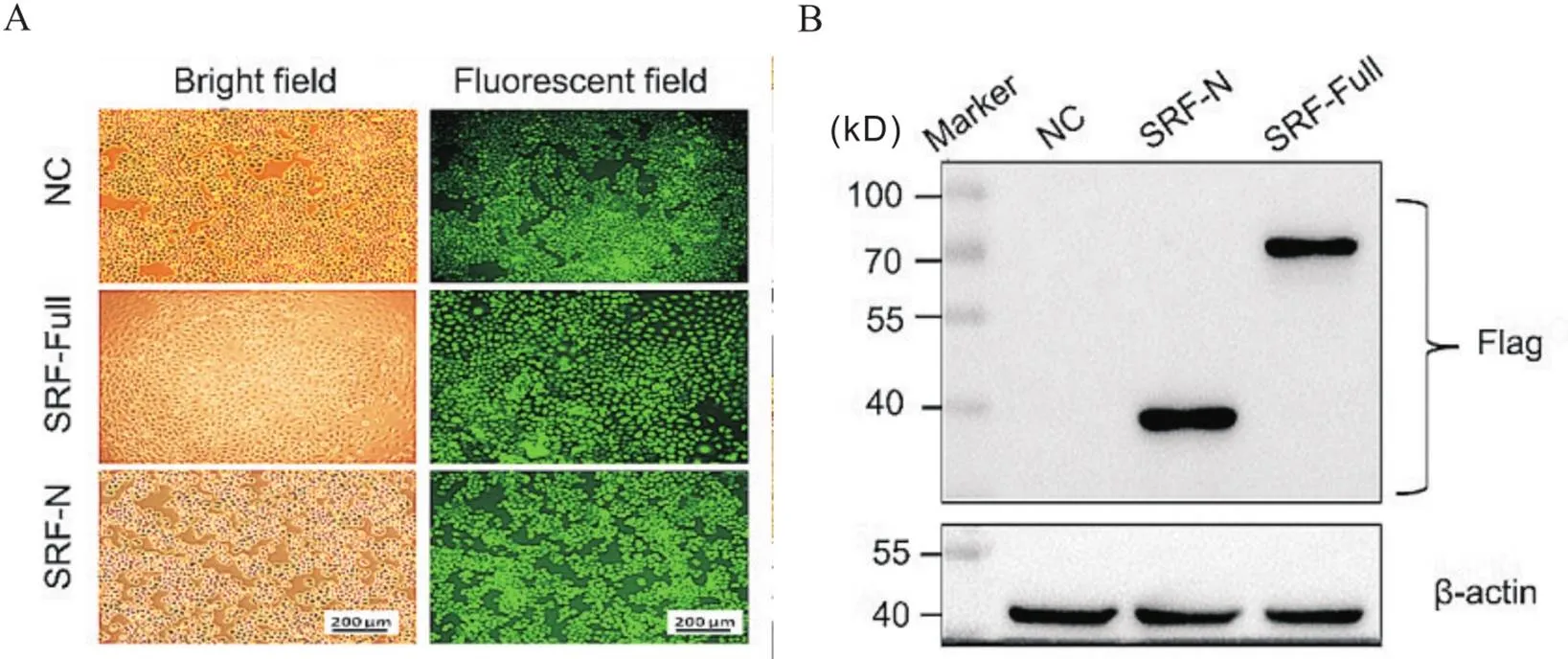
Figure 1.Observation of lentivirus-infected 6-10B cells and identification of the expression of Flag-tagged fusion protein. A: the GFP fluorescence 72 h after infection of 6-10B cells with lentivirus (scale bars=200 μm); B: the expression of Flag-tagged fusion protein in virus-infected 6-10B cells.

Figure 2.The expression of Flag-tagged fusion protein in monoclonal cell lines.
2 SRF-Full和SRF-N过表达后细胞增殖能力的变化
CCK-8实验结果显示,随着时间推移,6-10BSRF-Full的活力较同一时点的6-10BNC细胞增加(<0.01),而6-10BSRF-N的活力较6-10BSRF-Full却降低(<0.01),见图3A。通过Western blot检测细胞增殖相关蛋白PCNA的表达,提示6-10BNC及6-10BSRF-N细胞PCNA的表达情况差异不显著,6-10BSRF-Full细胞中PCNA表达水平较二者均显著增加(<0.01),见图3B。

Figure 3.The effects of overexpression of SRF-Full and SRF-N on the proliferation of 6-10B cells. A: cell viability detected by CCK-8 assay; B: Western blot detection of PCNA protein level in virus-infected 6-10B cells. Mean±SD. n=3. **P<0.01 vs 0 day; ##P<0.01 vs SRF-Fullgroup.
3 SRF-Full和SRF-N过表达后细胞迁移能力的变化
划痕损伤修复实验结果表明,与6-10BNC细胞相比,48 h后6-10BSRF-Full细胞划痕伤口的面积显著减小(<0.01),而6-10BSRF-N细胞伤口的面积较6-10BSRF-Full显著增大(<0.01),见图4A。进一步采用Transwell实验分析SRF-Full和SRF-N过表达后对6-10B细胞迁移能力的影响,结果显示,6-10BSRF-Full细胞穿膜细胞数比6-10BNC细胞显著增多(<0.01),而6-10BSRF-N细胞穿膜细胞数较6-10BSRF-Full细胞显著减少(<0.01),见图4B。
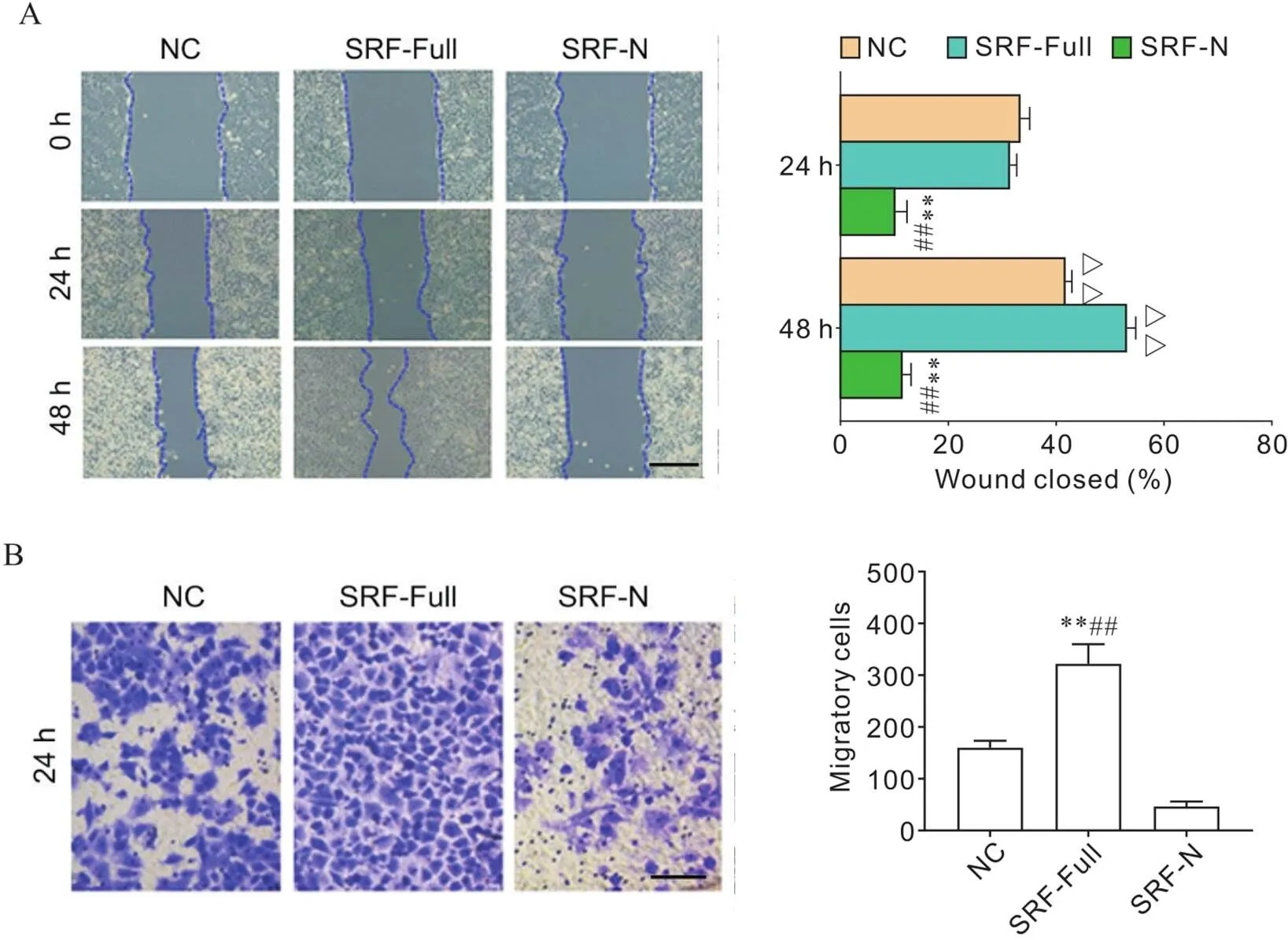
Figure 4.Impacts of overexpression of SRF-Full and SRF-N on the migration of 6-10B cells. A: representative images of wound healing assay (scale bar=200 μm) and the quantitative results; B: representative images of Transwell migration assay (scale bar=50 μm) and the quantitative results. Mean±SD. n=6. **P<0.01 vs NC group; ##P<0.01 vs SRF-N group; △△P<0.01 vs 24 h.
4 SRF-Full和SRF-N过表达后细胞黏附能力的变化
将与Matrigel黏附的细胞用CCK-8液孵育后,酶标仪测定其吸光度值,结果显示6-10BSRF-Full细胞平均吸光度为3.41±0.12,与6-10BNC细胞的平均吸光度(1.47±0.01)相比显著升高(<0.01)。6-10BSRF-N细胞的平均吸光度为1.50±0.01,较6-10BSRF-Full细胞显著降低(<0.01),见图5。

Figure 5.Impacts of overexpression of SRF-Full and SRF-N on the adhesion of 6-10B cell to matrix. Mean±SD. n=4. **P<0.01 vs NC group; ##P<0.01 vs SRF-N group.
5 过表达SRF-Full和SRF-N后EMT相关蛋白表达的改变
Western blot检测结果显示,与6-10BNC相比,6-10BSRF-Full细胞的间充质细胞标志物(N-cadherin和vimentin)和转录因子Snail1显著增加(均<0.01),而上皮细胞标志物E-cadherin显著减少(<0.01);与6-10BSRF-Full相比,6-10BSRF-N细胞的间充质细胞标志物(N-cadherin和vimentin)和转录因子Snail1显著减少(<0.05),上皮标志物E-cadherin表达量显著增加(<0.05),见图6。

Figure 6.Western blot analysis of EMT-related proteins in 6-10B cells. Mean±SD. n=3. **P<0.01 vs NC group; #P<0.05, ##P<0.01 vs SRF-N group.
6 SRF-Full和SRF-N对Snail1启动子活性的影响
通过构建SRF-Full、SRF-N、NC启动子、启动子及启动子突变体质粒,按照既定分组将质粒共转染到293T细胞中,分别收集各组细胞培养48 h后的培养液上清进行萤光素酶活性检测。结果显示,与Promoter-NC+SRF-Full相比,Promoter-Snail1+SRF-Full组启动子活性显著增强(<0.01),且Promoter-Snail1+SRF-Full组较Promoter-Snail1+SRF-N组具有更高的启动子活性(<0.01);与Promoter-Snail1+SRF-Full组相比,Promoter-Snail1-Mut+SRF-Full组启动子其活性显著下降(<0.01);Promoter-Snail1-Mut+SRF-Full组与Promoter-Snail1-Mut+SRF-N组启动子活性无显著差异,见图7。
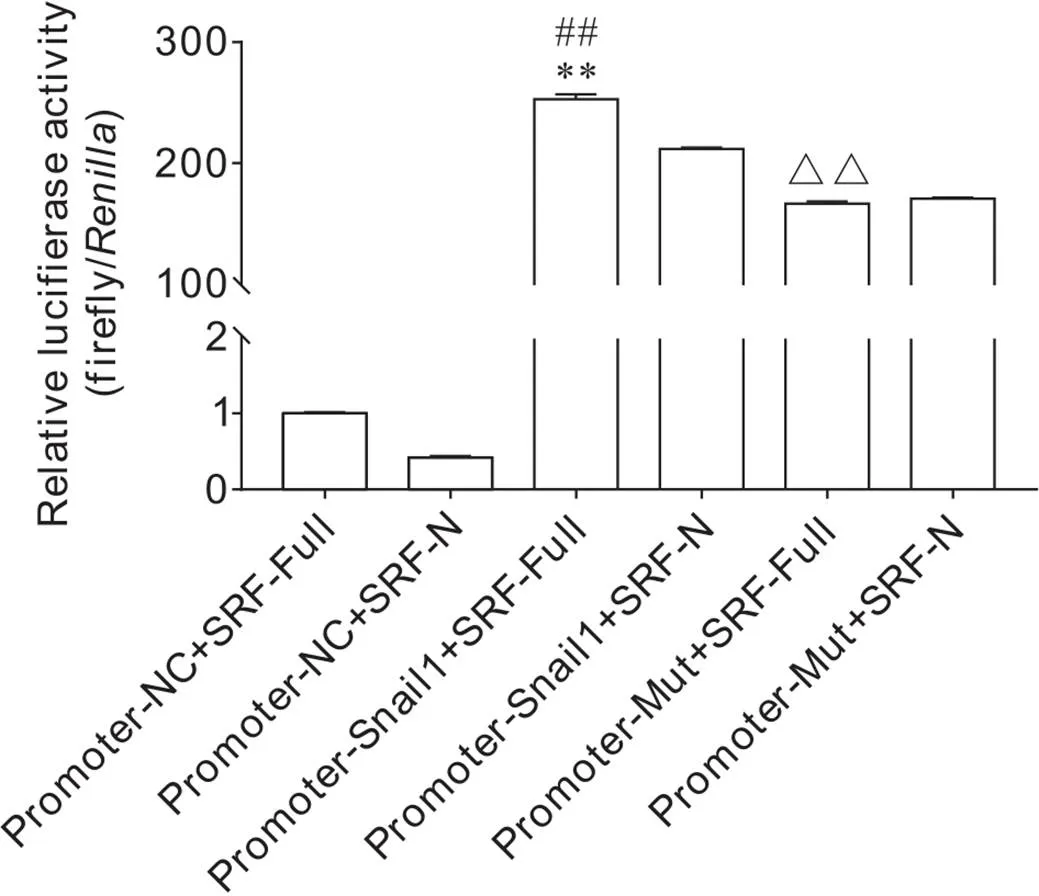
Figure 7.The effects of SRF-Full and SRF-N on the activity of Snail1 promoter assessed by dual-luciferase reporter assay. Mean±SD. n=3. **P<0.01 vs Promoter-NC+SRF-Full group; ##P<0.01 vs Promoter-NC+SRF-N group; △△P<0.01 vs Promoter-Snail1+SRF-Full group.
讨论
SRF表达异常与人类某些疾病的病理生理过程关系密切,如肿瘤、纤维化、神经损伤再生及心功能衰竭等[13]。有报道称SRF在人类多种肿瘤中高表达,目前已经观察到SRF高表达可促进人类胃癌[9]、肝癌[14]、甲状腺癌[15]和宫颈癌[16]等多种恶性肿瘤的进展。因此,靶向SRF对肿瘤的分子治疗具有潜在的临床意义。有报道显示CCG-100602可以抑制TGF-β1诱导的SRF的表达[17],但该抑制剂的特异性不强,因而挖掘内源性SRF抑制分子具有重要的意义。针对前述的SRF-Full可被剪切产生SRF-N分子的事实,结合SRF-N的结构特点[11],促使我们思考SRF-N是否具有抗肿瘤特性。本研究即应用NPC细胞模型来进行验证。
我们首先委托上海赛业生物技术有限公司基于慢病毒载体pEZ-Lv201分别构建了SRF-Full、SRF-N和NC的过表达质粒,包装了相应的慢病毒颗粒并经过相应质检,提示慢病毒包装成功并具有较高滴度(未发表资料)。将相应慢病毒分别感染6-10B细胞,荧光显微镜下观察到GFP信号。由于当前针对SRF-N的商品化抗体同时也可以和SRF-Full结合,抗体的检测结果特异性不强,因而我们采用检测Flag与目的蛋白的融合蛋白方式来进行外源性蛋白表达的验证。结果显示,从慢病毒感染的细胞中分别检测到分子量分别约70 kD和接近40 kD的Flag融合蛋白条带。这些阳性条带大小与预期的SRF-Full-Flag和SRF-N-Flag的分子量大小一致,提示目的基因成功表达和慢病毒成功感染。继而采用经典的单克隆细胞挑选法获得相应单克隆细胞株,这些表型相对均一的单克隆细胞为后续研究奠定了扎实的基础。
在获得合格的细胞模型后,我们从体外实验角度分析SRF-N对NPC细胞增殖、迁移、黏附及EMT的影响。结果表明,与6-10BNC细胞相比,6-10BSRF-Full的增殖能力增加,而6-10BSRF-N细胞的增殖活力较6-10BSRF-Full减弱,提示过表达SRF-Full可促进NPC细胞增殖,而过表达SRF-N片段在一定程度上抑制了细胞增殖,这一结果与Western blot检测到的PCNA蛋白的趋势是一致的。此外,本实验结果也证实,过表达SRF-Full可以促进6-10B细胞的迁移和基质黏附能力,而SRF-N具有一定的抑制6-10B细胞迁移和基质黏附的能力,进一步提示了SRF-N具有拮抗NPC进展的生物学特性。
越来越多的证据表明SRF过表达可能影响肿瘤细胞EMT过程[18-21]。EMT即上皮源性肿瘤细胞获得间充质源性细胞表型,通常表现为上皮细胞标志物如E-cadherin和ZO-1表达下降,而间充质细胞标志物如vimentin和N-cadherin等表达上升,同时功能上发生EMT的肿瘤细胞侵袭、运动能力增加。本研究通过Western blot检测EMT相关蛋白表达的变化,观察到过表达SRF-Full能有效诱导6-10B细胞N-cadherin、vimentin和Snail1表达增加,同时E-cadherin表达减弱,过表达SRF-N则出现与SRF-Full相反的趋势。由此提示,SRF-Full能促进NPC细胞EMT进展,而SRF-N能部分阻断EMT进程。这一结果也与功能上细胞划痕损伤修复、迁移与基质粘附的结果趋势相一致。由此可见,NPC中SRF-Full过表达可以通过EMT机制来促进肿瘤细胞的侵袭和转移,而SRF-N过表达后显示出一定程度的负性调控EMT的作用而抑制肿瘤细胞的侵袭和转移。
EMT被认为是由相关转录因子信号触发的,这些转录因子主要包括Snail1、Slug、ZEB1、ZEB2和Twist1等,它们的激活被认为是使细胞获得侵袭性的关键过程[22-23]。既往报道,Snail1是最早被认为可通过与E-box基序结合直接抑制E-cadherin转录来驱动EMT的转录因子之一[24]。研究表明,SRF从胞质移位入核以上调Snail1的表达,Snail1和SRF的亚细胞定位影响细胞的表型和功能[25],因此,SRF/Snail1信号的活化促进细胞发生EMT[26]。本实验也显示SRF过表达显著增加6-10B细胞中Snail1的表达。为探究NPC中SRF与Snail1之间的调控关系,我们通过启动子活性分析实验证明,SRF-Full增强了Snail1启动子活性,而SRF-N在一定程度上抑制Snail1的转录活性,这与预期结果相一致。由此可见,SRF-N通过直接抑制Snail1的转录活性来实现减弱EMT的作用。需要注意的是,本启动子活性实验中,细胞在培养过程中产生的内源性SRF也可能发挥了一定作用。此外,Snail1突变型启动子与SRF-Full和SRF-N较之NC对照启动子仍具有较高的活性,很可能与SRF与Snail1结合位点未完全突变有关,
总之,本研究结果提示SRF-Full过表达促进NPC细胞的增殖和迁移能力,而SRF-N过表达在一定程度上抑制了NPC细胞的增殖、迁移和黏附能力。机制上,SRF-N通过抑制Snail1启动子的转录活性来实现调控NPC细胞的EMT,SRF-N是SRF-Full的内源性拮抗因子。进一步明确SRF-N在抗肿瘤治疗中的作用具有重要意义和潜在的临床转化价值。本研究为体外细胞学实验,后期需要从动物实验及临床队列研究的角度进一步验证。
[1]贾亚楠,李汝佳, 王可可, 等. 受体酪氨酸激酶Axl高表达促进鼻咽癌临床进展[J]. 中国病理生理杂志, 2017, 33(8):1386-1392.
Jia YN, Li RJ, Wang KK, et al. High expression of Axl promotes clinical progression of nasopharyngeal carcinoma[J]. Chin J Pathophysiol, 2017, 33(8):1386-1392.
[2] Wu Y, Shen Z, Wang K, et al. High FMNL3 expression promotes nasopharyngeal carcinoma cell metastasis: role in TGF-β1-induced epithelia-to-mesenchymal transition[J]. Sci Rep, 2017, 7:42507.
[3]贾亚楠, 王可可, 王思思, 等. SATB1高表达通过促进上皮-间充质转化而介导鼻咽癌细胞侵袭和转移[J]. 中国病理生理杂志, 2018, 34(9):1578-1585.
Jia YN, Wang KK, Wang SS, et al. Over- expression of SATB1 mediates invasion and metastasis of nasopharyngeal carcinoma cells through epithelial-mesenchymal transition[J]. Chin J Pathophysiol, 2018, 34(9):1578-1585.
[4] Jin S, Li R, Chen MY, et al. Single-cell transcriptomic analysis defines the interplay between tumor cells, viral infection, and the microenvironment in nasopharyngeal carcinoma[J]. Cell Res, 2020, 30(11):950-965.
[5] Gong L, Kwong DL, Dai W, et al. Comprehensive single-cell sequencing reveals the stromal dynamics and tumor-specific characteristics in the microenvironment of nasopharyngeal carcinoma[J]. Nat Commun, 2021, 12(1):1540-1558.
[6] Onuh JO, Qiu H. Serum response factor-cofactor interactions and their implications in disease[J]. FEBS J, 2021, 288(10):3120-3134.
[7] Miano JM. Role of serum response factor in the pathogenesis of disease [J]. Lab Invest, 2010, 90(9) : 1274-1284.
[8] Müller S, Glaß M, Singh AK, et al. IGF2BP1 promotes SRF-dependent transcription in cancer in a m6A- and miRNA-dependent manner [J]. Nucleic Acids Res, 2019, 47(1):375-390.
[9] Yin J, Lv X, Hu S, et al. Overexpression of serum response factor is correlated with poor prognosis in patients with gastric cancer[J]. Hum Pathol, 2019, 85:10-17.
[10] Lionarons DA, Hancock DC, Rana S, et al. RAC1P29Sinduces a mesenchymal phenotypic switch via serum response factor to promote melanoma development and therapy resistance[J]. Cancer Cell, 2019, 36(1):68-83.e9.
[11] Chang J, Wei L, Otani T, et al. Inhibitory cardiac transcription factor, SRF-N, is generated by caspase 3 cleavage in human heart failure and attenuated by ventricular unloading[J]. Circulation, 2003, 108(4):407-413.
[12] 雷洪, 王可可, 哈艳平, 等. 血清反应因子全长及N端片段过表达慢病毒载体的构建及其对心脏干细胞分化的影响[J]. 临床与实验病理学杂志, 2017, 33(10):1109-1115.
Lei H, Wang KK, Ha YP, et al. Construction of the full length and N-terminal fragment of serum response factor over-expressing lentiviral plasmid and its impacts on cardiac stem cell differentiation[J]. J Clin Exp Pathol, 2017, 33(10):1109-1114.
[13] He X, Xu H, Zhao M, et al. Serum response factor is overexpressed in esophageal squamous cell carcinoma and promotes Eca-109 cell proliferation and invasion [J]. Oncol Lett, 2013, 5(3):819-824.
[14] Bae JS, Noh SJ, Kim KM, et al. Serum response factor induces epithelial to mesenchymal transition with resistance to sorafenib in hepatocellular carcinoma[J]. Int J Oncol, 2014, 44(1):129-136.
[15] Kim HJ, Kim KR, Park HS, et al. The expression and role of serum response factor in papillary carcinoma of the thyroid[J]. Int J Oncol, 2009, 35(1):49-55.
[16] Ma L, Yu Y, Qu X. Suppressing serum response factor inhibits invasion in cervical cancer cell lines via regulating Egr-1 and epithelial-mesenchymal transition[J]. Int J Mol Med, 2019, 43(1):614-620.
[17] Choi YJ, Koo JB, Kim HY, et al. Umbilical cord/placenta-derived mesenchymal stem cells inhibit fibrogenic activation in human intestinal myofibroblasts via inhibition of myocardin-related transcription factor A[J]. Stem Cell Res Ther, 2019, 10(1):291-307.
[18] Zhao L, Li C, Jiang W, et al. Serum response factor increases renal cell carcinoma migration and invasion through promoting epithelial-mesenchymal transition[J]. Int J Urol, 2020, 27(9):808-816.
[19] Park MY, Kim KR, Park HS, et al. Expression of the serum response factor in hepatocellular carcinoma: implications for epithelial-mesenchymal transition[J]. Int J Oncol, 2007, 31(6):1309-1315.
[20] Zhao X, He L, Li T, et al. SRF expedites metastasis and modulates the epithelial to mesenchymal transition by regulating miR-199a-5p expression in human gastric cancer[J]. Cell Death Differ, 2014, 21(12):1900-1913.
[21] 冯岚, 曹鹏博, 周钢桥. 血清应答因子通过诱导肝癌细胞上皮间充质转化增强其迁移能力[J]. 军事医学, 2018, 42(11):810-816.
Feng L, Cao PB, Zhou GQ. Serum response factor promotes hepatocellular carcinoma cell migration by inducing epithelial-mesenchymal transition[J]. Mil Med Sci, 2018, 42(11):810-816.
[22] Ell B, Kang Y. Transcriptional control of cancer metastasis[J]. Trends Cell Biol, 2013, 23(12):603-611.
[23] Chaffer CL, Weinberg RA. A perspective on cancer cell metastasis[J]. Science, 2011, 331(6024):1559-1564.
[24] Batlle E, Sancho E, Francí C, et al. The transcription factor snail is a repressor of E-cadherin gene expression in epithelial tumourcells [J]. Nat Cell Biol, 2000, 2(2):84-89.
[25] He L, Lou W, Ji L, et al. Serum response factor accelerates the high glucose-induced epithelial-to-mesenchymal transition (EMT) via snail signaling in human peritoneal mesothelial cells[J]. PLoS One, 2014, 9(10):e108593.
[26] Zhao L, Chi L, Zhao J, et al. Serum response factor provokes epithelial-mesenchymal transition in renal tubular epithelial cells of diabetic nephropathy[J]. Physiol Genomics, 2016, 48(8):580-588.
Effects of N-terminal fragment of serum response factor on proliferation and migration of nasopharyngeal carcinoma cells
YUAN Jian-ling1,3, SHAO Zhong-ming1, ZOU Yuan1, WU Cai-xia1, ZHENG A-xiu1, XING Jing-ci1, BAI Jian-rong1, JIE Wei1,2△, SHEN Zhi-hua1△
(1,,,524023,;2,,,571199,;3,,518036,)
To explore the effects of the N-terminal fragment of serum response factor (SRF-N) on the proliferation and migration of nasopharyngeal carcinoma (NPC) cells and its mechanisms.The full-length SRF (SRF-Full, 1 to 508 aa) overexpression, SRF-N (1 to 254 aa) overexpression and negative control (NC) lentiviral particles were used to infect human NPC 6-10B cells, and the monoclonal cells were obtained by puromycin resistance screening. Western blot was applied to detect the expression of Flag-tagged fusion protein. The cell viability, migration and adhesion were analyzed by CCK-8 assay, wound healing assay, Transwell assay and matrix-adhesion assay. The changes in proliferation-associated protein proliferating cell nuclear antigen (PCNA) and epithelial-mesenchymal transition (EMT)-related factors were assessed by Western blot. Finally, dual-luciferase reporter assay was used to detect the regulatory effects of SRF-Full and SRF-N onpromoter.The 6-10B cells were successfully infected with SRF-Full, SRF-N and NC lentiviruses. The corresponding monoclonal cell lines, which were obtained by puromycin resistance screening combined with the expression of Flag tag protein, were labeled as 6-10BSRF-Full, 6-10BSRF-Nand 6-10BNC, respectively. Compared with 6-10BNCcells, increased viability, migration and adhesion to the matrix were observed in 6-10BSRF-Fullcells (<0.01), while these capabilities of 6-10BSRF-Ncells were decreased compared with 6-10BSRF-Fullcells (<0.01). Compared with 6-10BNCcells, the expression of vimentin, N-cadherin and Snail1 in 6-10BSRF-Fullcells were significantly increased (<0.01), while the expression of E-cadherin was significantly decreased (<0.01). Compared with 6-10BSRF-Fullcells, the expression of vimentin, N-cadherin and Snail1 in 6-10BSRF-Ncells was significantly decreased (<0.05), while the expression of E-cadherin was significantly increased (<0.05). The results of dual-luciferase reporter assay showed that SRF-Full significantly activatedpromoter compared with NC (<0.01), while SRF-N significantly inhibitedpromoter compared with SRF-Full (<0.01).SRF-Full promotes but SRF-N inhibits the proliferation and migration of NPC cells. SRF-N inhibitspromoter activity and mediates EMT of NPC. SRF-N may serve as a potential anti-NPC target.
Nasopharyngeal carcinoma; N-terminal fragment of serum response factor; Cell proliferation; Cell migration; Epithelial-mesenchymal transition
R 363.2; R739.6
A
10.3969/j.issn.1000-4718.2022.03.019
1000-4718(2022)03-0535-08
2021-10-11
2022-01-13
[基金项目]国家自然科学基金资助项目(No. 81402415);广东省扬帆计划高层次人才项目(No. 4YF16007G)
申志华 Tel: 0759-2388587; E-mail: szh75@126.com; 揭伟 Tel: 0898-66968217; E-mail: wei_jie@hainmc.edu.cn
▲共同第一作者:并列第1作者
(责任编辑:林白霜,罗森)

