家兔心脏停搏自主循环恢复后血清代谢组学特征分析*
梁明宇, 冯洋, 刘娅荣, 李淑彤, 欧阳洁琳, 陈芳,祝益民, 邹联洪,△, 蒋宇△
家兔心脏停搏自主循环恢复后血清代谢组学特征分析*
梁明宇1, 冯洋1, 刘娅荣1, 李淑彤1, 欧阳洁琳1, 陈芳2,祝益民2, 邹联洪1,2△, 蒋宇2△
[1湖南师范大学,分子流行病学湖南省重点实验室, 湖南 长沙 410013;2湖南省人民医院(湖南师范大学附属第一医院)湖南省急救医学研究所,湖南 长沙 410005]
探讨分析家兔心脏停搏(CA)自主循环恢复(ROSC)后血清代谢组学特征变化。10只雄性新西兰家兔,采用窒息法制备CA家兔模型,于CA前、ROSC后15 min、3 h、6 h和24 h各收集2 mL血液样品,通过气相色谱-质谱联用(GC-MS)测定各时间点血清代谢产物,采用Simca P软件对血清代谢轮廓特征进行主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA),通过MetaboAnalyst 5.0软件进行检验、火山图、聚类热图分析差异代谢产物,并对差异代谢物进行KEGG代谢通路分析。与CA前相比,ROSC后15 min、3 h、6 h和24 h家兔的血清代谢轮廓特征发生明显改变,分别有50、44、58和78个差异代谢物,其中山梨糖、赖氨酸、乙醇胺、2'-脱氧胞苷-5'-三磷酸和腐胺含量在ROSC后均减少(<0.05),莽草酸、磷酸丝氨酸、-甲基-L-谷氨酸、4-羟基-3-甲氧基苯甲醇(香草醇)、塔格糖、氨基丙二酸、乳果糖、吲哚-3-乙酸、景天庚酮糖和肌酸含量在ROSC后均增加(<0.05)。牛磺酸含量在ROSC后15 min、6 h和24 h减少(<0.05),在ROSC后3 h含量差异无统计学意义。与CA前相比,ROSC后15 min、3 h、6 h和24 h分别有8、8、12和15条差异代谢通路,其中苯丙氨酸、酪氨酸和色氨酸的生物合成在ROSC后均下调,精氨酸和脯氨酸代谢在15 min和3 h时下调,而在6和24 h时上调。磷酸戊糖途径在ROSC后15 min时受到抑制,但是在其他时点无差异。CA家兔ROSC后的血清代谢组学存在显著动态差异。磷酸戊糖途径受限和牛磺酸水平下调可能与ROSC后的损伤有关,而肌酸水平上调提示心肌细胞损伤。
心脏停搏;自主循环恢复;代谢组学
心脏停搏(cardiac arrest, CA)是指各种原因导致的心脏射血功能突然停止,随即出现脉搏消失、意识丧失、呼吸循环中断的现象,致死率极高,是一个严重威胁生命安全的世界性公共健康问题[1]。随着急诊急救技术的不断进步和应用,越来越多患者经抢救后能达到自主循环恢复[2]。但目前对CA和CA自主循环恢复(return of spontaneous circulation, ROSC)后的研究大部分是基于临床治疗效果的观察,缺乏动态的、多路径的CA和ROSC后的发病进程研究。
新陈代谢是机体生命活动的基本特征,代谢变化在疾病病情判断、早期诊断、预后及疗效评估等方面逐渐受到重视,而代谢组学能对生物体内代谢物进行识别和定量分析,并寻找代谢物与疾病的病理生理变化关联[3]。CA后缺氧缺血所致的器官损伤是幸存者后期死亡和长期神经功能障碍的主要原因[4],而缺血缺氧后机体会出现特征性的代谢变化。运用代谢组学分析ROSC后的动态代谢变化,可为发掘CA复苏后器官损伤可能的机理提供数据支持,为新治疗靶点的发现提供有效帮助。因此,本研究通过制备新西兰家兔窒息性CA模型并进行复苏,从代谢组学层面探索家兔CAROSC后血清代谢物的动态变化,为CA研究提供理论依据和参考。
材料与方法
1 实验动物
雄性新西兰家兔10只,平均体重为(2.50±0.18) kg,购于湖南斯莱克景达实验动物有限公司,许可证号为SCXK(湘)2013-0004。动物实验符合伦理学标准。
2 CA家兔模型制作及样本收集
新西兰家兔禁食不禁水12 h,3%戊巴比妥(30 mg/kg)麻醉后固定于兔台,耳缘动脉置动脉留置针用于血压监测,生物机能实验仪实时监测体温、心率、血压,记录正常(normal)状态的数值。气管插管后,采用窒息方式诱导室颤致CA,致颤时长为3~4 min,以心电显示无脉搏心电活动或无电活动,血压小于10 mmHg作为CA标志,7 min后用动物呼吸机给予机械通气,注射肾上腺素并行胸外按压术至自主循环恢复,复苏至ROSC时长为2~3 min,分别于CA造模前(即正常状态)、ROSC后15 min、3 h、6 h、24 h从耳缘动脉抽血2 mL,收集血清样本于-80 ℃中保存备用,研究流程图如图1所示。
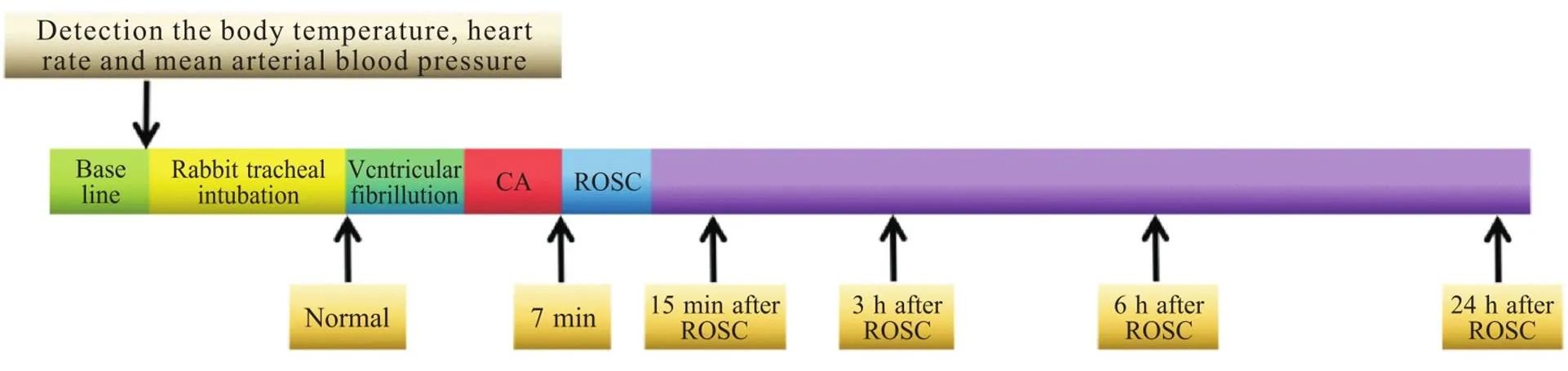
Figure 1.Flow chart of cardiac arrest (CA) rabbit model. ROSC: return of spontaneous circulation.
3 样品处理及质量控制
将存于-80 ℃的血清样本取出置于冰上自然解冻,取每份待测血清样品5 μL混合于进样瓶中制作成质量控制(quality control,QC)样品。每个样本取100 μL,加入内标10 μL(L-2-氯-苯丙氨0.3 g/L,甲醇配置)、100 μL蛋白沉淀剂甲醇-乙腈(2∶1),涡旋混匀10 s,冰水浴中超声提取10 min,4 ℃、12 000 r/min、10 min,挥干,加入50 μL甲氧胺盐酸吡啶溶液(15 g/L),涡旋混匀,70 ℃肟化1 h,冷却15 min,加入50 μL双(三甲基硅烷基)三氟乙酰胺[BSTFA,含1%三甲基氯硅烷(TMCS)]衍生试剂和正乙烷,涡旋震荡,70 ℃ 60 min。室温放置30 min,取上清液移入进样瓶。7890A-5975C型GC-MS气质联用仪进行代谢组学检测。
4 统计学处理
通过ChromaTOF软件处理GC-MS数据,初步筛选得到314个代谢物。将代谢物数据矩阵导入SIMCA-P14.1软件,采用主成分分析(principal component analysis, PCA)和正交偏最小二乘判别分析(orthogonal partial least squares discrimination analysis, OPLS-DA)评估各样本的总体分布以及ROSC后15 min、3 h、6 h和24 h分别与normal相比的代谢组学总体差异,并进行置换检验来判断模型的拟合程度;以差异倍数(fold change, FC)>2或FC<0.66,<0.05,变量投影重要性值(variable importance in the projection, VIP)>1的标准筛选差异代谢物,将代谢数据导入MetaboAnalyst 5.0软件进行检验、火山图、热图分析,并利用KEGG Pathway数据库分析相关代谢通路。计量资料采用均数±标准差(mean±SD)表示。以<0.05表示差异有统计学意义。
结果
1 一般资料比较
连续监测各时间点家兔的体温、心率和平均动脉压(mean arterial blood pressure, MAP),与normal组相比,ROSC后15 min、3 h和6 h家兔体温无明显变化(>0.05),而ROSC后24 h体温略有升高(<0.05),CA后7 min心率和MAP均为0,与normal组相比,ROSC后15 min心率无明显变化(>0.05),3、6和24 h后心率加快(<0.05);ROSC后15 min、3 h和6 h时血压呈下降趋势(<0.05),ROSC后24 h血压与normal组相比无明显差异(>0.05),见表1。

表1 心脏停搏家兔模型各时间点体温、心率、平均动脉压情况
ROSC: return of spontaneous circulation.*<0.05normal group.
2 ROSC后CA家兔血清代谢轮廓的动态变化
首先对各个时点的家兔血清代谢物数据进行PCA,结果如图2A所示:与normal组相比,CA家兔ROSC后15 min、3 h、6 h和24 h样本的代谢轮廓改变明显,且呈时间相关的动态变化趋势。OPLS-DA也得到同样结果,见图2B。对模型有效性进行200次置换检验,R2=0.453,Q2=-0.413,说明OPLS-DA模型可靠,不存在过拟合现象,见图2C。
CA家兔ROSC后15 min、3 h、6 h和24 h分别与normal组进行两两比较分析,PCA结果显示,与normal组相比,ROSC后15 min、3 h、6 h和24 h样本的轮廓差异显著(图2D),OPLS-DA进一步证明ROSC后各个时点样本的代谢轮廓发生明显变化(图2E),且OPLS-DA分析模型不存在过拟合(图2F)。

Figure 2.Analysis of serum metabolite profiles after return of spontaneous circulation (ROSC) in cardiac arrest rabbits. A, B and C: PCA (A), OPLS-DA (B) and permutation analysis (C) of serum metabolic characteristics at different time points; D and E: PCA (D), OPLS-DA (E) and permutation analysis (F) of serum metabolic characteristics between normal, and 15 min, 3 h, 6 h and 24 h after ROSC.
3 CA家兔血清差异代谢产物的动态改变
采用MetaboAnalyst 5.0软件平台,按照FC>2且<0.05的标准,筛选ROSC后不同时点血清差异代谢物。结果如图3、表2所示:与normal组相比,ROSC后15 min、3 h、6 h和24 h的差异代谢物分别有50、44、58和78个;有15种代谢物同时存在于ROSC后各时点组,其中山梨糖、赖氨酸、乙醇胺、2'-脱氧胞苷-5'-三磷酸和腐胺含量在4个时点均减少(<0.05),莽草酸、磷酸丝氨酸、N-甲基-L-谷氨酸、4-羟基-3-甲氧基苯甲醇(香草醇)、塔格糖、氨基丙二酸、乳果糖、吲哚-3-乙酸、景天庚酮糖和肌酸含量在4个时点均增加(<0.05);牛磺酸含量在ROSC后15 min、6 h和24 h减少(<0.05),但在ROSC后3 h含量与normal组差异无统计学意义(>0.05)。

Figure 3.Volcano analysis of serum metabolic characteristics in cardiac arrest rabbtis at 15 min, 3 h, 6 h and 24 h after return of spontaneous circulation (ROSC) compared with normal.

表2 心脏停搏家兔ROSC后血清中主要差异代谢产物
“/”:>0.05.
4 差异代谢物聚类热图分析
为了更加直观体现出不同时间点家兔血清代谢物的差异性和聚类程度,根据各对比组前50位VIP值的代谢物进行聚类热图分析。由图4可知各组样本均呈现出较为明显的聚类。
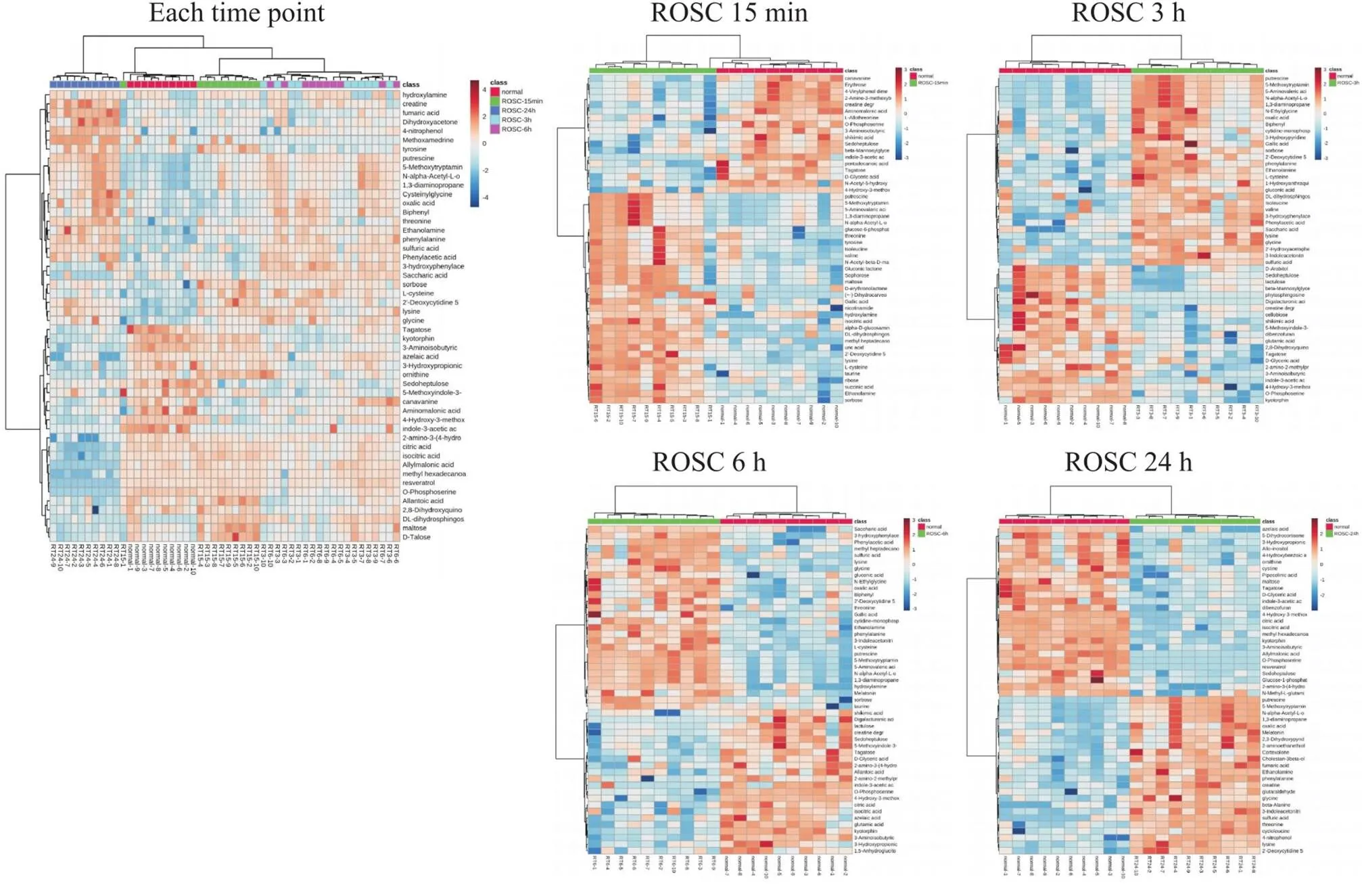
Figure 4.Heatmap analysis of serum metabolic characteristics between each time point, or at 15 min, 3 h, 6 h and 24 h after return of spontaneous circulation (ROSC) compared with normal.
5 代谢通路途径分析
将不同时点的血清差异代谢物导入MetaboAnalyst 5.0软件中进行KEGG代谢通路分析。根据Impact>0.1筛选出改变显著的代谢通路,结果如图5所示。与normal组相比,ROSC后15 min、3 h、6 h和24 h分别有8、8、12和15条差异代谢通路,其中苯丙氨酸、酪氨酸和色氨酸的生物合成均下调,精氨酸和脯氨酸代谢在15 min和3 h时下调,而在6 h和24 h时上调。磷酸戊糖途径在ROSC后15 min时受到抑制,但是在其他时点却无差异。牛磺酸和次牛磺酸代谢在ROSC后15 min、6 h和24 h均被抑制,且影响权重较大。

Figure 5.The KEGG pathway analysis of serum metabolic characteristics in cardiac arrest rabbits at 15 min, 3 h, 6 h and 24 h after return of spontaneous circulation (ROSC) compared with normal.
讨论
CA是急危重症时较常见的严重不良事件。在我国,每年发生心源性猝死的患者高达41.8/10万[5]。CA患者ROSC后出现的病理损害过程主要包括全身缺血再灌注损伤、脑组织损伤、心肌功能障碍和持续致病性病因与诱因等四个方面,被称为CA后综合征[6]。炎症反应、氧化应激和代谢紊乱是CA致多器官功能障碍的重要原因,也是影响CA患者预后的关键因素。代谢组学是对被干扰或刺激的生物系统的观察,是对生物体代谢物变化的研究,能系统全面地反映生物体的代谢特征,从整体层面探讨生命活动的代谢特征和规律[7]。通过对CA家兔血清代谢组学的研究发现,与心脏聚停前相比,CA家兔ROSC后各个时点的血清代谢轮廓特征存在差异,经KEGG代谢通路分析发现苯丙氨酸,酪氨酸和色氨酸的生物合成、精氨酸和脯氨酸代谢、磷酸戊糖途径、牛磺酸和次牛磺酸代谢等途径发生明显改变。
CA和ROSC后的患者经历了严重的全身缺血再灌注损伤,氧化应激始终贯穿于这一病理生理进程中,被认为是导致CA患者死亡的重要原因。活性氧(reactive oxygen species, ROS)的产生和清除失衡,引发级联放大的氧化应激反应,对组织细胞造成损伤,最终出现多器官功能障碍综合征甚至死亡[8]。磷酸戊糖途径是在生物界中普遍存在的糖分解代谢途径之一,参与NADPH的产生[9],葡萄糖6-磷酸脱氢酶是磷酸戊糖途径的限速酶。有研究显示葡萄糖6-磷酸脱氢酶对小鼠脑缺血再灌注损伤具有保护作用,其作用机制可能是通过增强磷酸戊糖途径,提高NADPH水平,使其抑制ROS,从而抑制神经细胞死亡[10]。本研究结果显示磷酸戊糖途径在ROSC后15 min时变化较大,受到抑制,提示CA患者ROSC过程的早期严重的氧化应激损伤。
牛磺酸是一种游离的含硫β-氨基酸亚磺酸类似物,在细胞内含量较高且非常稳定,参与渗透平衡的调控[11]。Ca2+过度累积对心脏有细胞毒性,有研究证实牛磺酸可通过其抗氧化活性和调控细胞内Ca2+水平减轻缺血再灌注损伤[12-13]。牛磺酸在缺血再灌注期间通过调节细胞内Ca2+移动、清除自由基、调节渗透压保持膜稳定性来发挥其巨大的抗氧化活性[14-15]。在离体大鼠心脏再灌注损伤的研究中,牛磺酸可减轻氧化损伤、改善心室功能和减少梗死面积[16]。此外,牛磺酸还可以促进胚胎大脑的神经发育,被证实对大脑灰质和白质、对局灶性脑缺血-再灌注损伤具有保护作用[17],其在脑缺血损伤中的作用越来越受到重视。本研究中,与normal组相比,在ROSC后24 h内的家兔血清中,牛磺酸含量显著降低,提示增加牛磺酸摄入有望减轻CA致心肌细胞损伤。
心肌是高能量需求的器官。CA患者ROSC过程中缺血缺氧再灌注造成的能量代谢紊乱,致使心肌功能障碍。肌酸主要以磷酸肌酸(creatine phosphate, PCr)形式存在,负责能量的缓冲和运输,在肌酸激酶控制下与三磷酸腺苷(adenosine triphosphate, ATP)可相互转换Cr+ATP↔PCr+ADP+H+[18,19]。在心肌缺血时,氧不足以支持通过氧化磷酸化产生ATP,PCr和ATP水平会在几分钟内迅速耗尽,出现能量危机致心肌细胞受损[20-21]。本研究中,与normal组相比,血清中肌酸水平在CA家兔ROSC后不同时点显著上调,尤其是在ROSC后15min上调10.61倍,提示在CA家兔ROSC过程中,ATP耗竭和能量代谢障碍。在CA导致缺血再灌注过程中,氧供应的先中断后恢复不仅通过电子传递链(electron transport chain, ETC)削弱ATP的产生,而且它还促进电子从ETC泄漏,导致高度破坏性的ROS形成,ROS可引起严重氧化应激损伤,从而导致氧化还原稳态丧失和心肌细胞死亡[22],提示CA所致的能量代谢障碍,诱发氧化应激反应,致使心肌组织功能障碍。一项缺血性心肌研究中发现,外源性PCr可减少细胞内溶血磷脂酰胆碱和溶血磷脂酰乙醇胺的积累,具有稳定心肌细胞膜和保护心肌细胞功能的作用[23],增加PCr可以减少缺血/再灌注损伤大鼠心肌组织的炎症反应,从而改善心肌功能[24],提示PCr可能是改善CA患者预后的有效治疗靶点。
综上所述,CA家兔ROSC后的血清代谢组学存在显著动态差异,磷酸戊糖途径和血清代谢物牛磺酸通过调控氧化应激反应介导CA家兔ROSC后心脏功能的保护作用;肌酸水平上调提示心肌细胞损伤。
[1]张玉曼, 宋春霞, 郑晓丽, 等. 心搏骤停患者目标体温管理的最佳证据总结[J]. 中华护理杂志, 2020, 55(4): 621-627.
Zhang YM, Song CX, Zheng XL, et al. Best evidence summary for target temperature management of patients after cardiac arrest[J]. Chin J Nurs, 2020, 55(4):621-627.
[2]沈一鸣, 王秋红, 王建杰, 等. 不同吸氧时间对心脏骤停大鼠复苏后神经功能的影响[J]. 第三军医大学学报, 2020, 42(11):1078-1085.
Sheng YM, Wang QH, Wang JJ, et al. Effect of different durations of post-resuscitation oxygen ventilation on neurological function in rats after cardiac arrest[J]. J Third Mil Med Univ, 2020, 42(11):1078-1085.
[3] Lindon JC, Holmes E, Bollard ME, et al. Metabonomics technologies and their applications in physiological monitoring, drug safety assessment and disease diagnosis[J]. Biomarkers, 2004, 9(1):1-31.
[4] Meybohm P, Gruenewald M, Zacharowski KD, et al. Mild hypothermia alone or in combination with anesthetic post-conditioning reduces expression of inflammatory cytokines in the cerebral cortex of pigs after cardiopulmonary resuscitation[J]. Crit Care, 2010, 14(1):R21.
[5]田永灿, 柳发有, 郎大夫. 脑氧代谢率评估心肺复苏患者脑功能预后的价值[J]. 中国急救复苏与灾害医学杂志, 2021, 16(4):347-350.
Tian YC, Liu FY, Lang DF. Value of cerebral oxygen metabolism rate in accessing prognosis of ce-rebral function in patients undergoing cardiopulmonary resuscitation[J]. Chin J Emerg Resuscit Disaster Med, 2021, 16(4):347-350.
[6] Dalessio L. Post-cardiac arrest syndrome[J]. AACN Adv Crit Care, 2020, 31(4):383-393.
[7]曹学锋, 白振忠, 马兰, 等. 慢性高原病患者血清GC-TOF-MS代谢组学的初步研究[J]. 中国病理生理杂志, 2017, 33(9):1676-1682.
Cao XF, Bai ZZ, Ma L, et al. Preliminary study of patients with chronic mountain sickness by GC-TOF-MS based serum metabolomics analysis[J]. Chin J Pathophysiol, 2017, 33(9):1676-1682.
[8] Atil K, Halperin HR, Becker LB. Cardiac arrest: resuscitation and reperfusion[J]. Circ Res, 2015, 116(12):2041-2049.
[9] Chen M, Lian H, Zhong ML. Effects of hypothermia on brain oxygen metabolism and nerve function in patients after cardiac arrest[J]. J Med Theory Pract, 2021, 34(13):2226-2228.
[10] 张顶梅. G6PD通过增强磷酸戊糖途径在脑缺血再灌注损伤中发挥保护作用[D]. 苏州大学, 2018.
Zhang DM. G6PD plays a neuroprotective role in brain ischemia through promoting pentose phosphate pathway[D]. Soochow University, 2018.
[11] 王丽娟, 徐超, 赵玉梅. 牛磺酸对大鼠局灶性脑缺血-再灌注损伤的全脑保护作用[J]. 脑与神经疾病杂志, 2017, 25(10):617-622.
Wang LJ, Xu C, Zhao YM. The total brain protection efficacy of taurine during focal cerebral ischemia/reperfusion damage in rat[J]. J Brain Nerv Dis, 2017, 25(10):617-622.
[12] Rasola A, Bernardi P. Mitochondrial permeability transition in Ca2+-dependent apoptosis and necrosis[J]. Cell Calcium, 2011, 50(3):222-233.
[13] Baliou S, Adamaki M, Ioannou P, et al. Protective role of taurine against oxidative stress (review)[J]. Mol Med Rep, 2021, 24(2):605.
[14] Schaffer SW, Jong CJ, Ito T, et al. Effect of taurine on ischemia-reperfusion injury[J]. Amino Acids, 2014, 46(1): 21-30.
[15] Bkaily G, Jazzar A, Normand A, et al. Taurine and cardiac disease: state of the art and perspectives[J]. Can J Physiol Pharmacol, 2020, 98(2):67-73.
[16] Xu YJ, Arneja AS, Tappia PS, et al. The potential health benefits of taurine in cardiovascular disease[J]. Exp Clin Cardiol, 2008, 13(2):57-65.
[17] 王国华, 姜正林, 李霞, 等. 牛磺酸联合安定治疗脑缺血再灌注损伤的实验研究[J]. 中国病理生理杂志, 2010, 26(4):737-741.
Wang GH, Jiang ZL, Li X, et al. Combination of taurine and diazepam has neuroprotective effect on focal cerebral ischemia-reperfusion in rats[J]. Chin J Pathophysiol, 2010, 26(4):737-741.
[18] Zervou S, Whittington HJ, Russell AJ, et al. Augmentation of creatine in the heart[J]. Mini Rev Med Chem, 2016, 16(1):19-28.
[19] Buford TW, Kreider RB, Stout JR, et al. International Society of Sports Nutrition position stand: creatine supplementation and exercise[J]. J Int Soc Sports Nutr, 2007, 4:6.
[20] Balestrino M. Role of creatine in the heart: health and disease[J]. Nutrients, 2021, 13(4):1215.
[21] 李芳, 李辉, 朱世军, 等. 磷酸肌酸对大鼠心肌缺氧、复氧心肌线粒体肌酸激酶肌膜型亚基mRNA表达水平的影响[J]. 中国病理生理杂志, 2000, 16(2):143-145.
Li F, Li H, Zhu SJ, et al. The influence of phosphocreatine on expression of mitochondrial sarcomeric creatine kinase mRNA of myocardium ischemia and reperfusion in rats[J]. Chin J Pathophysiol, 2000, 16(2):143-145.
[22] Li X, Arslan F, Ren Y, et al. Metabolic adaptation to a disruption in oxygen supply during myocardial ischemia and reperfusion is underpinned by temporal and quantitative changes in the cardiac proteome[J]. J Proteome Res, 2012, 11(4):2331-2346.
[23] Gaddi AV, Galuppo P, Yang J. Creatine phosphate administration in cell energy impairment conditions: a summary of past and present research[J]. Heart Lung Circ, 2017, 26(10):1026-1035.
[24] Zhang W, Zhang H, Xing Y. Protective effects of phosphocreatine administered post- treatment combined with ischemic post-conditioning on rat hearts with myocardial ischemia/reperfusion injury[J]. J Clin Med Res, 2015, 7(4):242-247.
Serum metabolomic characteristics of rabbits with return of spontaneous circulation after cardiac arrest
LIANG Ming-yu1, FENG Yang1, LIU Ya-rong1, LI Shu-tong1, OUYANG Jie-lin1, CHEN Fang2, ZHU Yi-min2, ZOU Lian-hong1,2△, JIANG Yu2△
(1,,410013,;2,,410005,)
To investigate and analyze the dynamic changes of serum metabolomic characteristics in cardiac arrest (CA) rabbit model with return of spontaneous circulation (ROSC).The rabbit model of CA was induced by asphyxiation. Blood samples were collected at different time points including before CA, or 15 min, 3 h, 6 h and 24 h after ROSC. The metabolites in serum were determined by gas chromatography-mass spectrometer (GC-MS). Simca P software was used to analyze the serum metabolic profile characteristics by principal component analysis (PCA) and orthogonal partial least squares discrimination analysis (OPLS-DA). T-test, volcano plot, cluster heat map analysis and KEGG of MetaboAnalyst 5.0 software were used to analyze the differential metabolites and metabolic pathways.Compared with normal group, the characteristics of serum metabolic profiles at 15 min, 3 h, 6 h and 24 h after ROSC were significantly changed. There were 50, 44, 58 and 78 differential metabolites at these four time points. Concentrations of sorbose, lysine, ethanolamine, 2'-deoxycytidine 5'-triphosphate and putrescine were down-regulated (<0.05), while shikimic acid,-phosphoserine,-methyl-L-glutamic acid, 4-hydroxy-3-methoxybenzyl alcohol, tagatose, aminomalonic acid, lactulose, indole-3-acetic acid, sedoheptulose and creatine were up-regulated (<0.05). Taurine was decreased at 15 min, 6 h and 24 h after ROSC (<0.05), and was recovered at 3 h after ROSC. Compared with normal group, 8, 8, 12 and 15 differential metabolic pathways were captured at 15 min, 3 h, 6 h and 24 h after ROSC, respectively. The biosynthesis of phenylalanine, tyrosine and tryptophan was down-regulated after ROSC. The metabolism of arginine and proline was down-regulated at 15 min and 3 h after ROSC, while it was up-regulated at 6 and 24 h after ROSC. Pentose phosphate pathway was inhibited at 15 min after ROSC, but there was no difference at other time points.Significant dynamic differences in serum metabolomics were observed after ROSC in CA rabbit model. Restricted pentose phosphate pathway and decreased taurine may be caused by the injury after ROSC. Increased creatine indicates myocardial cell injury.
Cardiac arrest; Return of spontaneous circulation; Metabonomics
R363; R446
A
10.3969/j.issn.1000-4718.2022.03.007
1000-4718(2022)03-0434-08
2022-01-06
2022-02-22
[基金项目]湖南省重大专项(No. 2020SK1010)
Tel: 0731-83929129; E-mail: zoulh1986@hunnu.edu.cn(邹联洪); jiangyu@hunnu.edu.cn(蒋宇)
(责任编辑:卢萍,余小慧)

