肝胰同步手术切除与全身化疗治疗可切除胰腺癌伴肝转移患者的效果比较
金添强,戴朝六,徐 锋
中国医科大学附属盛京医院 普通外科,沈阳 110004
胰腺癌恶性程度高,发病隐匿,早期即可出现远处转移。其中肝脏是胰腺癌最常出现的远处转移器官,约占70%,胰腺癌伴肝转移(pancreatic cancer with liver metastasis,PCLM)患者预后差,5年生存率低于5%[1]。国内外胰腺癌诊治指南认为此类患者不适合手术,一线治疗方案应以全身化疗为主。近年来,随着外科设备、技术、药物等发展与进步,越来越多的医疗中心开展了原发灶和转移灶的同步手术切除,认为手术切除是最可能实现肿瘤根治的手段之一[2]。有研究[3]显示,同步手术切除较姑息性改道手术能延长PCLM患者的中位生存时间,提示手术切除可能存在积极意义。但亦有研究[1,4]表明同步手术切除与化疗相比,疗效无显著差异。对于哪种治疗方式最能够使患者获益,目前仍存在较大争议[5]。
这些既往研究多为回顾性分析或病例报告,对研究对象缺乏严格的筛选。部分入组作为对照的化疗患者,本身可能为不可切除的胰腺癌或者合并不可切除的肝脏转移,生存时间较短,影响研究结果。因此,本研究采用倾向性评分匹配(propensity score matching,PSM)方法以减少数据偏倚和混杂变量的影响,比较可切除PCLM患者手术切除与化疗的疗效差异,并分析影响预后的相关因素。
1 资料与方法
1.1 研究对象 选取2013年1月—2020年5月本院收治的PCLM患者,依据纳入及排除标准筛选出可切除PCLM病例,按照治疗方式分为手术组和化疗组,其中手术组根据有无术后化疗,可进一步分为单纯手术组和联合术后化疗组。
1.2 纳入和排除标准 手术组纳入标准:(1)可切除胰腺及肝转移病灶;(2)接受外科手术治疗;(3)美国东部肿瘤协作组(ECOG)体力评分0~2分。手术组排除标准:(1)术后病理为非胰腺导管腺癌肝转移;(2)合并肝外转移;(3)异时性肝转移;(4)接受非根治性手术,如姑息性切除、改道手术等;(5)合并较严重的基础疾病。化疗组纳入标准:(1)穿刺病理和/或影像学诊断为胰腺癌伴肝转移;(2)可切除胰腺及肝转移病灶;(3)接受全身化疗;(4)ECOG体力评分0~2分。化疗组排除标准:(1)异时性肝转移;(2)合并肝外转移;(3)合并较严重的基础疾病;(4)除化疗外,联合免疫靶向治疗、放疗、介入等其他治疗方式。
1.3 可切除胰腺及肝转移病灶的定义 胰腺癌可切除状态判断标准以2013年中国临床肿瘤学会胰腺癌诊疗指南为基础,借助影像学检查判断,其核心标准为肿瘤是否侵犯血管及受累血管是否可以切除重建:(1)肿瘤未浸润腹腔动脉、肠系膜上动脉和肝总动脉;(2)肿瘤未累及肠系膜上静脉和门静脉;(3)肿瘤毗邻/包裹肠系膜上静脉/门静脉,但≤180°且轮廓正常。肝转移病灶的可切除状态判定标准参考肿瘤寡转移的定义[6]以及目前可切除结直肠癌肝转移的判定标准[7],核心为保证阴性切缘和足够的剩余肝体积,具体如下:(1)充分的影像学评估,数目≤5个且有明确的大小及分布;(2)预计能够达到R0切除;(3)剩余肝体积>30%,合并肝病者需>50%;(4)残肝至少有完整的两个肝段;(5)残肝至少保留1根肝静脉,胆汁引流通畅。可切除与不可切除胰腺癌伴肝转移病例的影像学资料如图1、2所示。
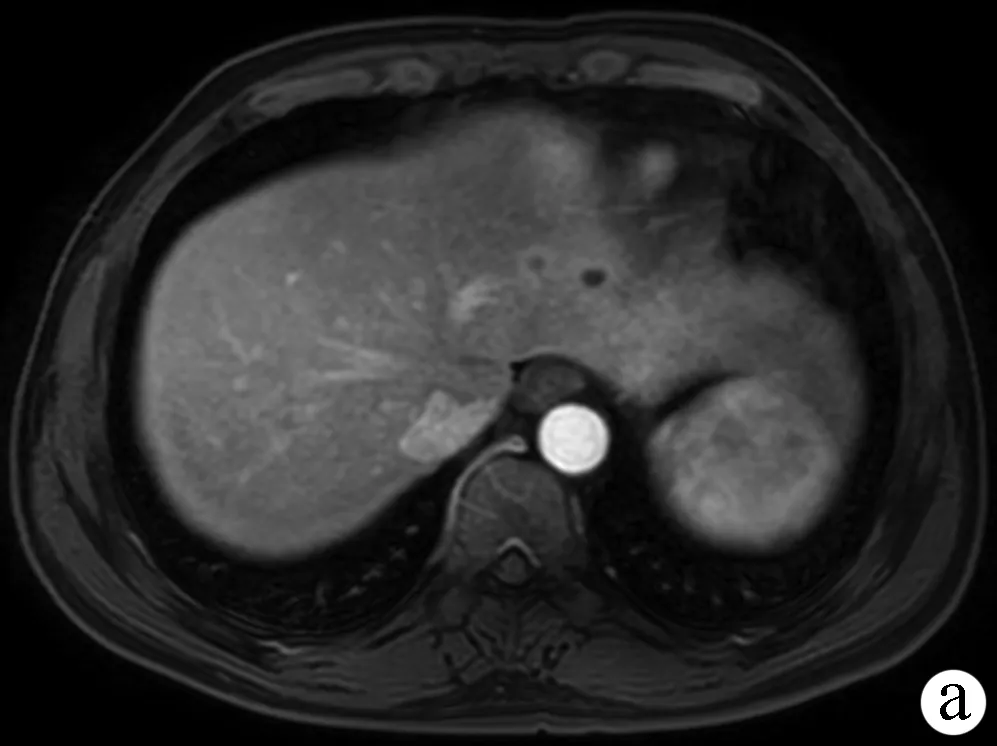
注:a,增强MRI可见肝脏左叶转移癌2个,较大者直径约1 cm,增强扫描可见环形强化;b,肝左叶转移癌,直径约1.1 cm,增强扫描环形强化;c,胰腺体部可见长T1信号包块,大小约3.6 cm×3.2 cm,增强扫描可见弱强化,邻近脾动脉局部狭窄。
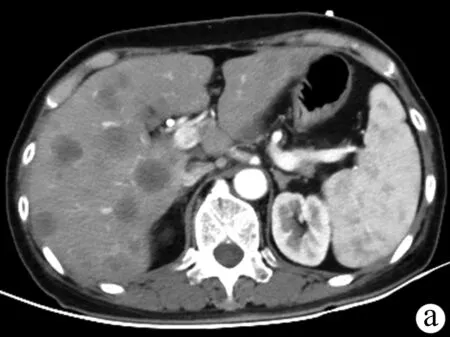
注:a,不可切除肝转移病灶,CT扫描可见肝内多发弥漫性低密度转移灶,呈边缘强化;b,不可切除胰腺病灶合并可切除肝脏转移,CT扫描可见胰腺体尾部软组织密度包块,弱强化,包绕腹腔干及分支,肝右叶可见单发低密度转移病灶,直径约2.1 cm,增强扫描环形强化;c,不可切除胰腺癌及肝转移病灶,胰体部肿物包绕腹腔干、肝总动脉及脾动脉,肝内另可见多发弥漫性低密度环形强化转移病灶。
1.4 治疗方法 手术组患者胰腺病灶的手术方式包括胰十二指肠切除术、胰体尾切除术和全胰腺切除术。肝转移灶的手术方式包括肝楔形切除、肝段切除、肝叶切除和半肝切除。化疗组患者治疗方案包括吉西他滨单药、替吉奥单药、吉西他滨联合替吉奥、吉西他滨联合白蛋白结合型紫杉醇、FPLFIRINOX方案、吉西他滨联合铂类方案等。
1.5 观察指标及随访 手术组观察指标包括手术时间、术中输血、住院时长、术中出血、术后并发症、总生存时间等。化疗组主要关注患者的总生存时间。复查方式包括化验(血生化、肿瘤标志物)和影像学检查(增强CT/增强MRI)两个部分。两组患者的随访方式包括门诊复查和电话随访,随访截止日期为2020年10月31日。
2 结果
2.1 一般资料 共纳入胰腺癌伴肝转移患者56例,其中手术组33例,化疗组23例。手术组患者中胰头癌9例,胰体尾癌24例,胰腺肿物平均直径为(4.8±1.9)cm;共有肝转移癌80个,平均直径为(1.5±0.5)cm,其中合并单发肝转移者15例,合并多发肝转移者18例。化疗组患者中胰头癌4例,胰体尾癌19例,肿瘤平均直径为(4.4±1.3)cm;合并单发肝转移7例,多发肝转移16例,肝转移癌的平均直径为(1.6±1.3)cm。采用PSM分组后,手术组与化疗组患者各15例(图3)。PSM分组前后,两组患者的基线指标差异均无统计学意义(P值均>0.05)(表1)。
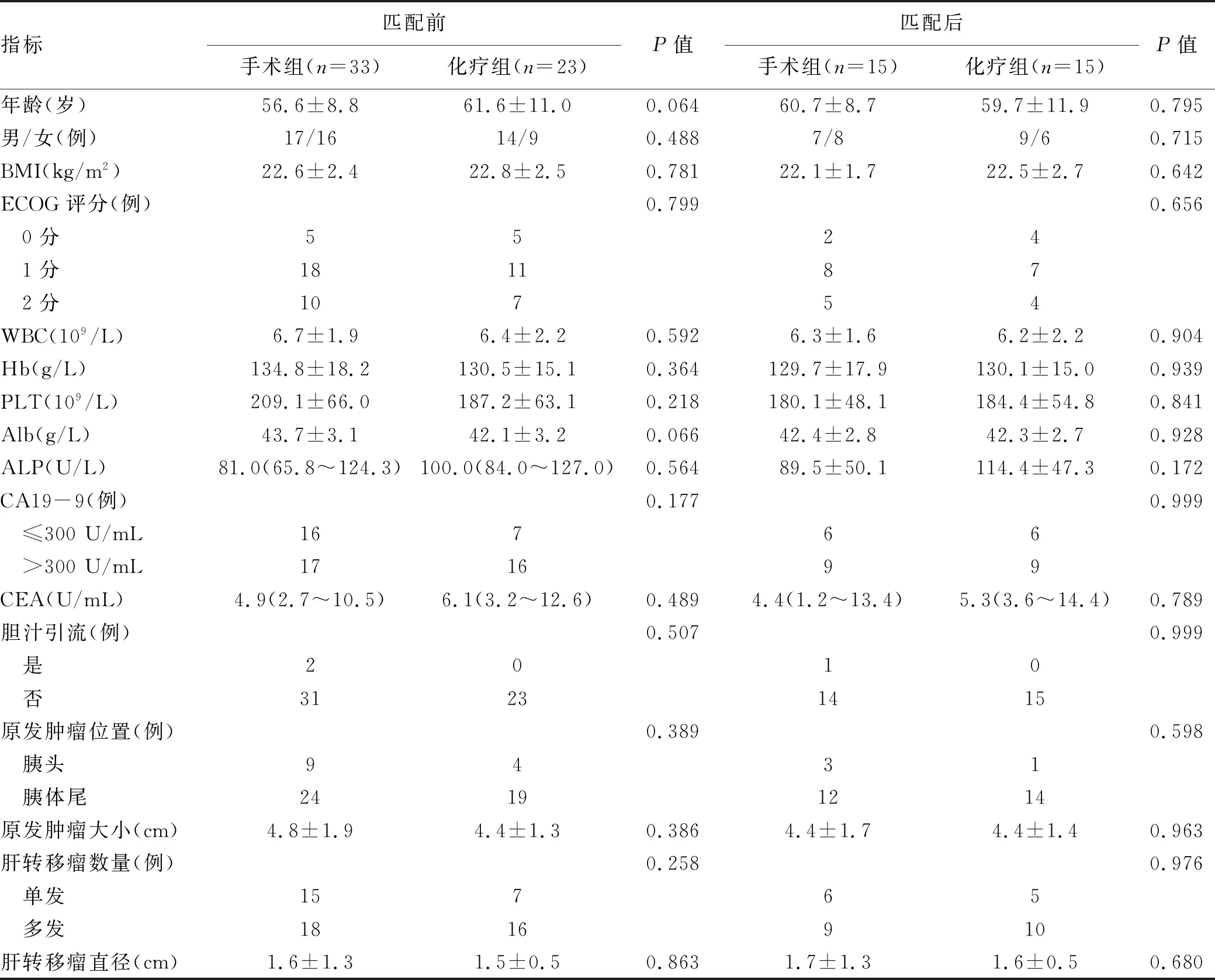
表1 PSM前后手术组与化疗组患者的一般临床资料比较
2.2 手术组患者病理特征及围手术期临床资料 手术组患者平均手术时间为(431.6±151.6)min,平均住院时间为(29.3±13.9)d,术后死亡率为0。有2例患者出现术后出血,均接受二次手术止血,其中1例患者术后出血原因为术区渗血,另1例患者原因为并发胰瘘导致胃十二指肠动脉残端出血。肝转移癌的手术方式以楔形切除为主(81.8%),其余治疗方式包括肝段和半肝切除。术后胰瘘(ISGPS B或C级)的发生率约为33.3%,其余主要并发症包括术后感染和胃排空延迟等。未见肝切除相关并发症,如肝断面出血、胆汁漏、肝脓肿等。术后病理提示22例患者为高/中分化腺癌,11例为低分化腺癌,有6例出现脉管侵犯,10例出现神经侵犯。胰腺病灶的R0切除率为78.8%,肝转移的R0切除率为87.9%。所有手术患者均被建议在出院后继续化疗,但仅有8例(24.2%)接受了术后化疗(表2)。
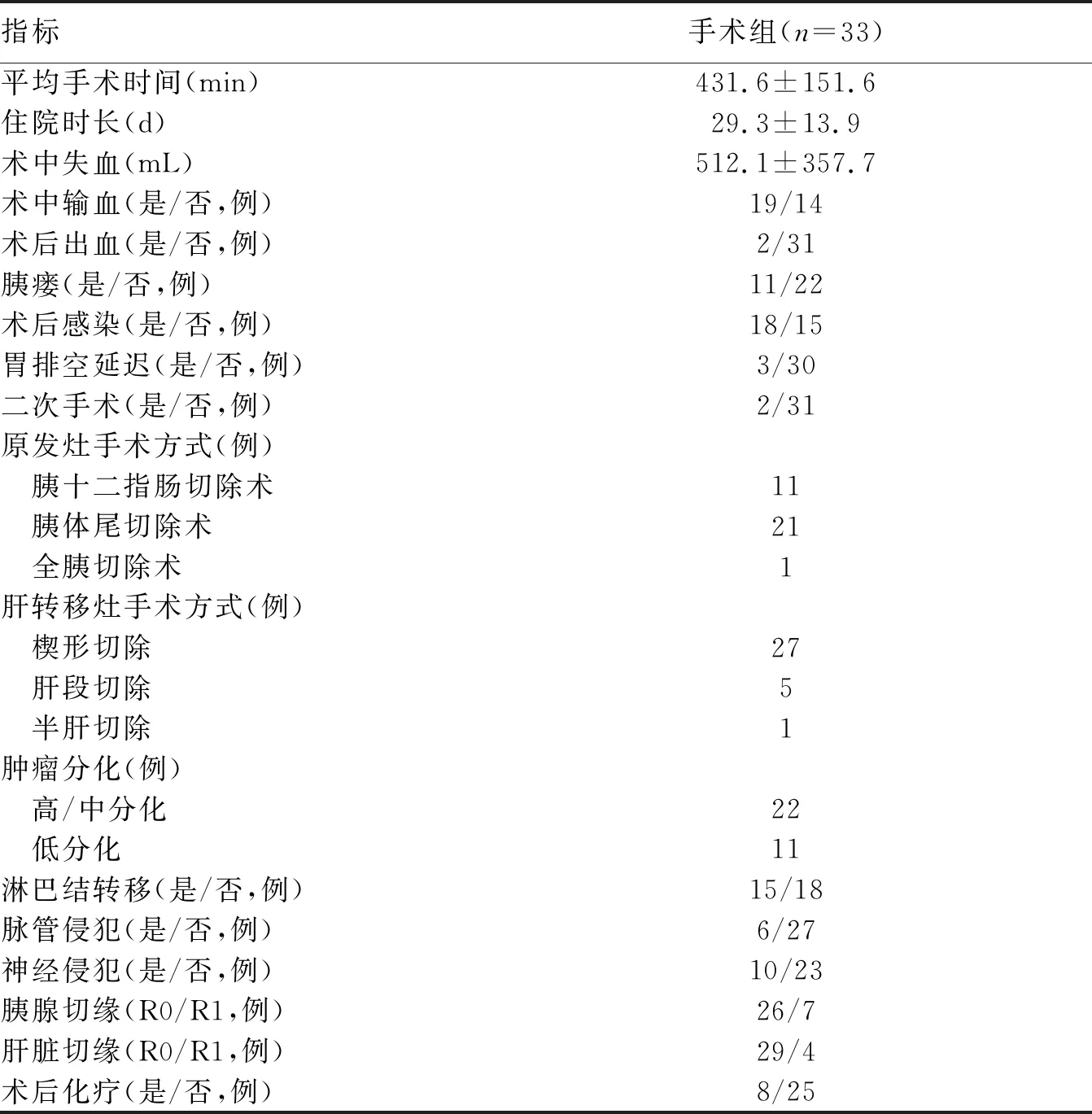
表2 手术组患者围手术期临床资料及病理结果
2.3 手术组与化疗组生存时间的比较 匹配前,手术组与化疗组患者的中位总体生存时间(mOS)分别为6.6个月和10.4个月,差异有统计学意义(χ2=4.476,P=0.034)(图4a);匹配后手术组患者mOS亦显著短于化疗组(6.4个月 vs 10.5个月,χ2=4.309,P=0.038)(图4b)。亚组分析结果显示,未接受术后化疗的手术组患者mOS明显短于化疗组(5.7个月 vs 10.4个月,χ2=6.855,P=0.009)(图4c),而接受术后化疗的手术组患者mOS与化疗组患者相比较,差异无统计学意义(9.1个月 vs 10.4个月,χ2=0.041,P=0.840)(图4d)。
注:TACE,经肝动脉化疗栓塞术。
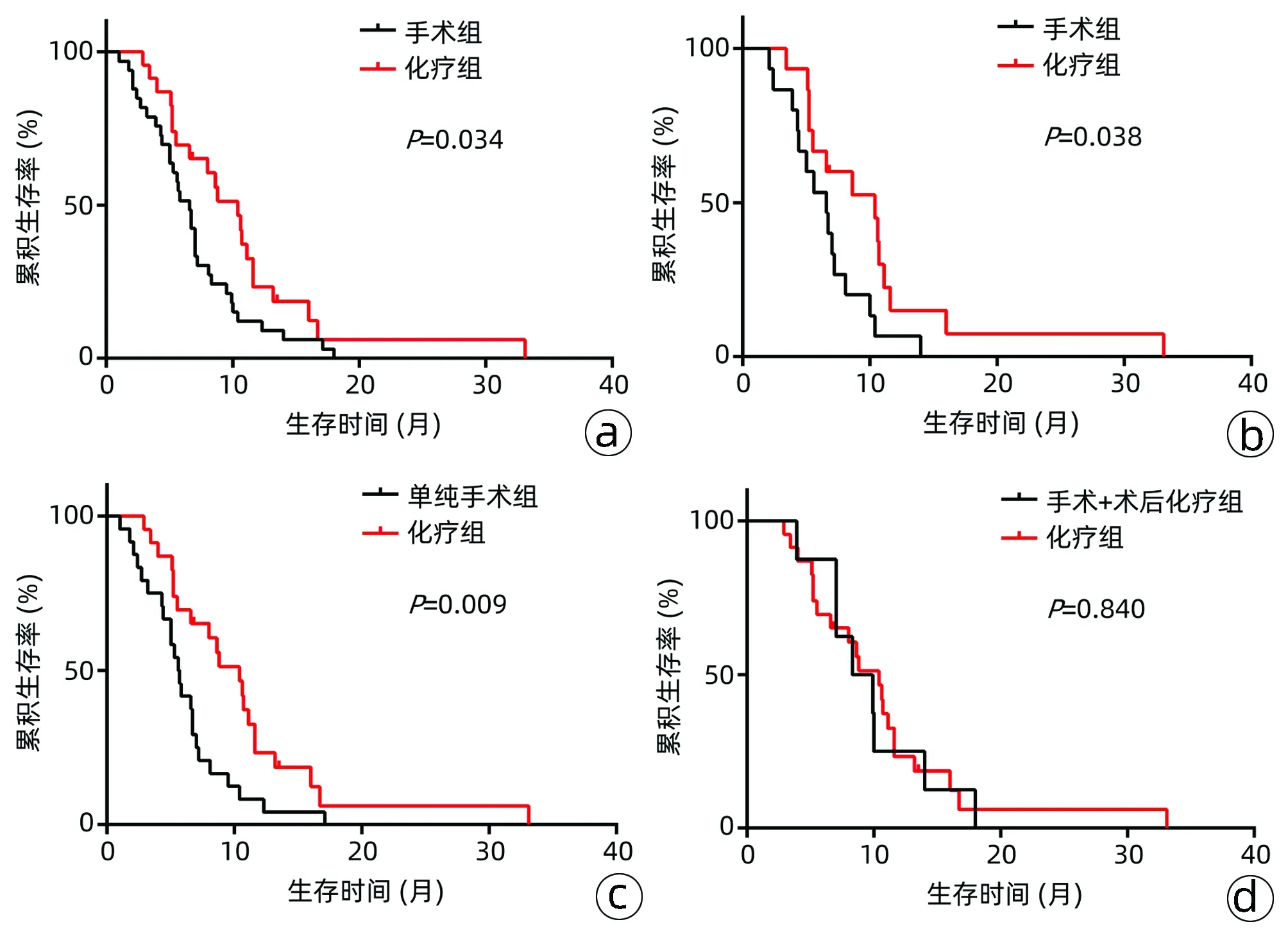
注:a,PSM前;b,PSM后;c,单纯手术组与化疗组;d,手术联合术后化疗组与化疗组。
2.4 PCLM患者预后因素分析 单因素Cox回归分析结果显示年龄(P=0.028)、治疗方式(P=0.034)、ECOG评分(P=0.031)是影响患者生存时间的预后因素。多因素Cox回归模型分析显示,年龄>60岁(P=0.007)和ECOG评分2分(P=0.006)是PCLM患者预后的独立影响因素(表3)。
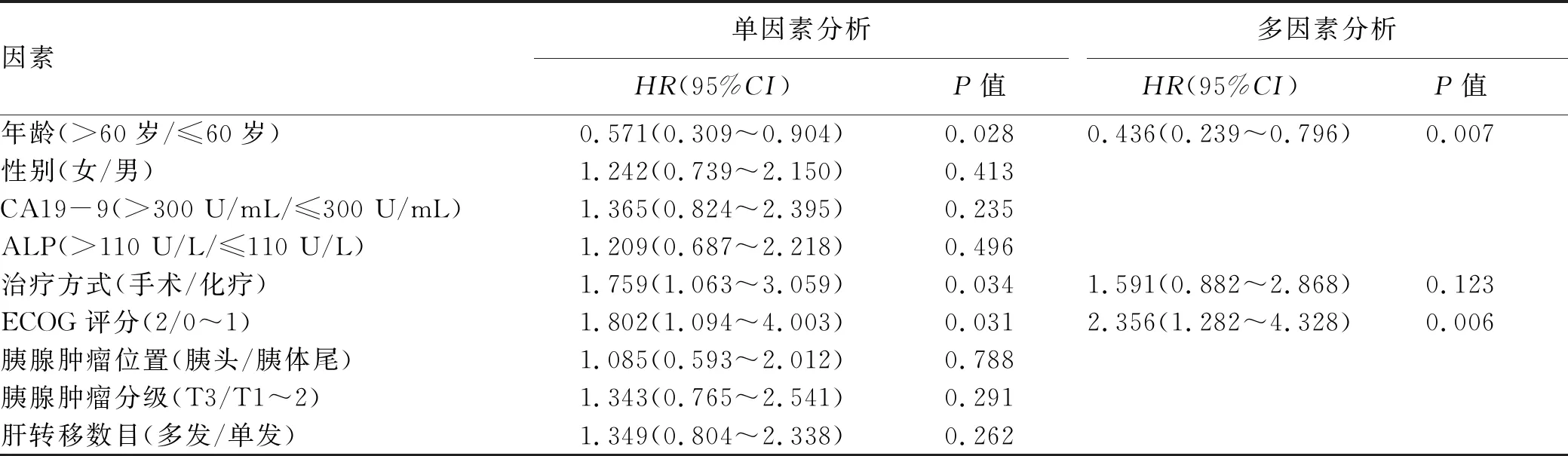
表3 影响PCLM患者预后的单因素及多因素分析结果
2.5 手术组患者预后因素分析 单因素Cox回归分析结果显示GGT>50 U/L(P=0.013)、低分化肿瘤(P=0.004)、无术后化疗(P=0.023)是影响手术患者术后总体生存时间的预后因素。将单因素分析P<0.15的变量纳入多因素Cox回归模型中,结果显示低分化肿瘤(P=0.001)和无术后化疗(P=0.007)是PCLM手术患者预后差的独立危险因素(表4)。
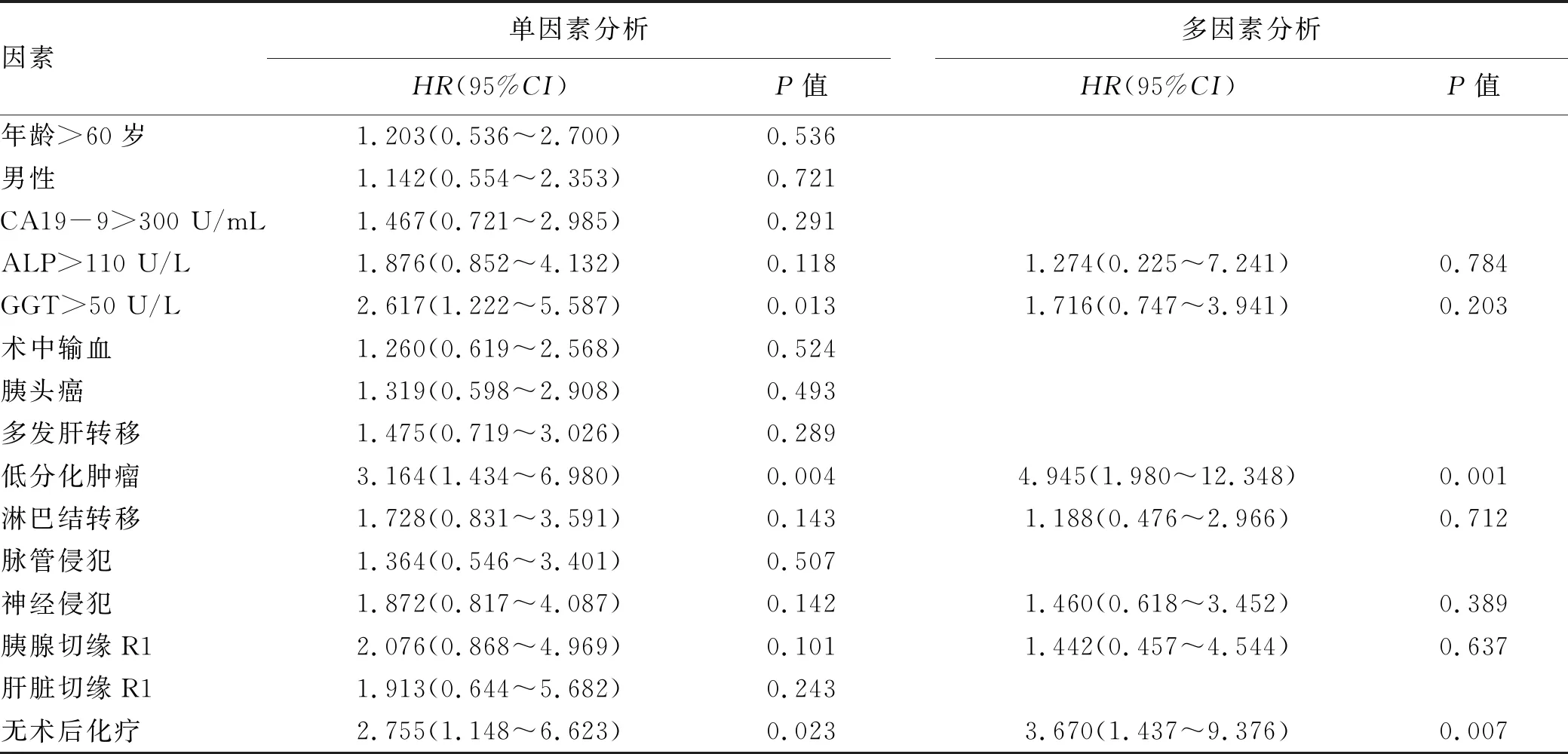
表4 影响手术组患者预后的单因素及多因素分析结果
3 讨论
在可切除结直肠癌肝转移领域,尽可能同步切除肝转移病灶已经是目前公认的治疗方式,能够有效延长患者生存时间[8-9]。但是对于PCLM患者,是否应该同步切除肝转移,目前存在争议。近年来,随着FOLFIRINOX方案、吉西他滨联合白蛋白结合型紫杉醇等新化疗方案的出现,转移性胰腺癌患者的生存时间获得了显著延长,mOS可达到11个月左右[10-11],化疗已成为转移性胰腺癌的首选治疗方式。尽管如此,手术作为最为有效的减瘤手段,仍是最有可能实现长期生存的治疗方式[12]。此外,手术治疗还在解除胆道梗阻、缓解症状、提高生活质量等方面具有不可替代的作用。因此,世界各地的医疗中心先后尝试开展肝胰病灶同步切除手术。但是,目前关于化疗和手术治疗PCLM的对照研究较少,尚缺乏证据证明手术能给此类患者带来生存获益。
切除肝转移对于减少肿瘤负荷意义重大,较姑息性手术能够使患者受益。一项Meta分析[13]纳入了11个队列研究共1147例PCLM患者(手术切除肝转移灶217例,非手术治疗930例),其中手术组1年(52.8% vs 27.1%,P<0.01)和3年生存率(17.2% vs 3.7%,P<0.01)较非手术治疗组均有明显提升。Tachezy等[3]在一项多中心回顾性队列研究中,共分析了来自6个欧洲中心且进行肝胰病灶同步切除手术的69例PCLM患者,mOS为14个月,显著长于配对的69例接受旁路手术或探查手术的患者(14个月 vs 8个月,P<0.01)。但在不同医疗中心,手术患者的生存时间差异较大,既往研究[3,12,14-17]中患者中位生存期为5.9~15.7个月。本研究中匹配前手术组患者的mOS为6.6个月,较既往研究相对较短,化疗组患者的mOS为10.4个月,与文献[10]报道的相近。本研究结果显示,PSM前后,手术组患者的mOS均显著短于化疗组(P值均<0.05),其中手术组患者联合术后化疗的比例较低,可能是生存期偏短的原因。然而,将联合术后化疗亚组与化疗组比较,两组生存期差异并无统计学意义(9.1个月 vs 10.4个月,P=0.840)。Yang等[6]分析比较了48例同步手术切除组和33例化疗组患者,两组mOS亦未达到统计学差异(7.8个月 vs 7.6个月,P=0.840)。以上结果均提示,对于PCLM患者,应该慎重选择手术,需要权衡考虑生存期、治疗费用以及生活质量等。
对于部分高度选择的PCLM患者,同步手术确实能够取得显著的疗效[3,6,15]。对于可切除PCLM患者,需要选择性地实施手术,但是如何筛选出此类潜在的受益患者群体是目前主要的问题。本研究中,高/中分化肿瘤和联合术后化疗对患者的预后有影响,mOS分别达到7个月和9.1个月,这一结果与Andreou等[12]的研究结论相符。Yang等[6]研究发现合并肝寡转移以及肿瘤位于胰体尾部的患者其mOS显著优于非肝寡转移组(16.8个月 vs 7.05个月,P=0.000 4)和化疗组(16.8个月 vs 8个月,P=0.003),提示肿瘤部位和肝转移瘤负荷可能是患者筛选的标准之一。胰体尾癌患者术前一般少有黄疸、肝功能异常等,身体状态大多较胰头癌患者好。此外,其手术过程一般无需消化道重建,术后并发症风险低,恢复相对较快,对于术后化疗的耐受性较好。在本研究中,接受术后化疗的患者主要为胰体尾癌肝转移。因此,笔者认为,对于胰体尾癌患者,更值得尝试手术,预后相对较好。Tachezy等[3]发现肝转移瘤的数目与患者预后有关,单发肝转移患者的mOS优于合并多发肝转移患者(11.6个月 vs 5.6个月)。肿瘤的生物学特性也应该成为患者筛选的重要指标,在术前缺乏病理的前提下,可以通过肿瘤对于化疗的敏感程度大致判断,化疗后肝转移灶缩小甚至消失的患者,手术后往往能够存活更长时间[18]。Frigerio等[19]报道了24例对化疗反应良好的PCLM患者,手术R0切除率为88%,患者mOS和中位无进展生存时间分别达到56个月和27个月。Crippa等[16]的研究也得出了相似结论,对于新辅助化疗反应良好的PCLM患者,积极手术组的mOS显著优于非手术组(39个月 vs 12个月,P<0.001)。结合本研究和既往研究的结果,笔者认为以下标准有助于进行术前筛选:(1)患者术前一般状态及体力评分良好,能够耐受手术创伤;(2)胰体尾部肿瘤肝转移;(3)肝寡转移,转移瘤负荷低,能够R0切除;(4)术前系统治疗后,肿瘤标志物水平降低,原发及转移病灶缩小。
术后并发症也是影响患者生存的重要因素,尤其对于同步手术切除患者,肝脏切除可能额外增加胆漏、出血、肝脓肿等风险。在本研究中,术后并发症包括胰瘘(33.3%)、术后出血(6.1%)、术后感染(54.5%)、胃排空延迟(9.1%)等,所有并发症的发生率可接受且没有出现肝切除相关的并发症。Shi等[15]研究显示,同步肝胰切除手术与单纯胰腺切除手术相比,术后并发症和住院时长无显著差异。随着手术技术以及术后护理的不断进步,肝胰同步切除手术的安全性也在不断提高,既往回顾性研究[4,6,17,20]报道的术后死亡率为0~5%。本研究中虽然有2例患者行二次手术止血,但术后总体死亡率为0,所有患者均顺利出院。这些结果亦表明在技术可行条件下,同步肝胰切除是安全可行的。
联合新辅助化疗、术后化疗是治疗其他消化道恶性肿瘤如结直肠癌肝转移的重要组成部分[9]。围手术期化疗可以抑制肿瘤微转移和循环肿瘤细胞,有效预防肿瘤早期复发。但是由于家庭经济或身体状态等原因,本研究中仅8例患者接受术后化疗,这也导致手术组患者总体生存期偏短,并且超过半数的患者在术后3个月内出现肝脏复发病灶。除了化疗,其他治疗方式如精准放疗、肿瘤消融、TACE等局部治疗不仅并发症轻微,而且在控制肿瘤进展和缓解症状方面作用明显,有利于患者的生存和生活质量的改善[21-24]。每种治疗方式都有其优势和相应的局限性,因此,PCLM的治疗不能依靠单一的治疗模式,应该采取多学科综合治疗模式[25]。不管是“手术+全身+局部”还是“全身+局部”治疗模式,均可以更大程度地改善患者的生存[26]。
本研究存在一定的局限性。首先,本研究属于回顾性分析,虽然采取了PSM分组,但仍不可避免地存在病例选择上的偏倚。第二,本研究样本量偏少,匹配后各组只有15例患者。第三,手术联合化疗应该是标准的治疗方式,但是本研究中联合化疗的例数较少,可能是导致手术组患者总体生存时间偏短的原因。第四,本研究化疗组患者并非全依靠穿刺病理诊断,其中可能存在非导管腺癌病理类型,对结果产生一定干扰。手术与化疗哪种治疗方式更适用于PCLM患者,仍有待进一步大样本、前瞻性的随机对照研究。
本研究初步探索了肝胰同步切除对PCLM患者的影响,研究结果显示手术并未较化疗给患者带来生存获益。但是联合术后化疗对于延长手术患者的生存时间具有重要意义。肿瘤分化程度与术后化疗是影响手术患者预后的两个重要因素。
伦理学声明:本研究方案于2021年5月18日经由中国医科大学附属盛京医院伦理委员会审批,批号:2021PS508K。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:金添强负责收集数据、资料分析、撰写论文;戴朝六参与指导撰写文章及修改论文;徐锋负责拟定写作思路、修改论文及最后定稿。

