高炉渣吸附亚甲基蓝的性能研究
李昌新,喻源,张庆武,朱桂明,郁颖蕾
(1.南京工业大学 安全科学与工程学院,江苏 南京 211816;2.江苏省安全生产科学研究院,江苏 南京 211816)
目前,亚甲基蓝染料废水脱色处理主要有:吸附法、化学法和生物法[1-4]。由于吸附法具有成本较低、工艺简单、操作方便、无二次污染、适用范围广等特点而备受关注。高炉渣( BFS) 是高炉炼铁过程中形成的副产品,为多孔质硅酸盐材料,具有一定的吸附性能。目前,国内外学者进行了大量的以高炉渣吸附无机磷及重金属离子的相关研究[5-7],但针对亚甲基蓝染料的吸附研究报告较少。本文以高炉渣为吸附剂,研究了高炉渣用量、吸附时间、吸附pH值、吸附温度等对高炉渣吸附亚甲基蓝的性能影响,并探究了高炉渣对亚甲基蓝的吸附动力学和吸附等温线。
1 实验部分
1.1 材料与仪器
亚甲基蓝(纯度98%),分析纯;高炉渣,取自江苏某钢铁股份公司,其主要化学成分见表1。高炉渣主要由CaO、SiO2和Al2O3等物质组成。

表1 高炉渣的主要化学组成
由表1可知,高炉渣吸附剂具有疏松多孔的特点,表面较为粗糙,且分散性较好,有利于作为吸附剂吸附去除亚甲基蓝染料。
Axios X射线荧光光谱仪;Regulus8100扫描电子显微镜;S22可见分光光度计。
1.2 实验方法
称取0.3 g高炉渣样品置于250 mL锥形瓶中,加入100 mL一定浓度亚甲基蓝溶液,在设定温度下以200 r/min振荡,振荡过程中分别测定在不同时间下上清液中亚甲基蓝浓度,根据式(1)计算高炉渣材料对亚甲基蓝的吸附容量:
(1)
式中q——吸附容量,mg/g;
C0——亚甲基蓝溶液的初始浓度,mg/L;
Ce——吸附后亚甲基蓝溶液的平衡浓度,mg/L;
V——溶液体积,mL;
m——高炉渣的质量,g。
1.3 表征方法
采用X射线荧光光谱仪分析高炉渣化学成分,采用扫描电子显微镜分析高炉渣微观形貌,溶液中亚甲基蓝浓度的分析采用分光光度法,于665 nm波长处,用10 mm比色皿,以蒸馏水为参比,测定吸光度并计算浓度。
2 结果与讨论
2.1 吸附时间对吸附性能的影响
控制吸附实验条件为:吸附温度25 ℃,吸附pH值7.0,高炉渣用量3.0 g/L,吸附时间对高炉渣吸附亚甲基蓝的吸附容量的影响见图1。
由图1可知,随着初始浓度的增加,高炉渣对亚甲基蓝的吸附容量逐渐增加,且当亚甲基蓝初始浓度<100 mg/L时,随着初始浓度的增加,吸附容量的增加幅度较大,当亚甲基蓝初始浓度>100 mg/L 时,继续增加初始浓度,吸附容量的增加幅度变小,初始浓度从60 mg/L升至120 mg/L时,平衡吸附容量从6.9 mg/g增至10.6 mg/g。另外,当吸附时间增加到180 min时,亚甲基蓝的吸附容量明显增大,而当吸附时间>180 min 后,继续增大吸附时间,亚甲基蓝的吸附容量趋于平衡状态。分析其原因认为,吸附初始阶段此时吸附主要发生在高炉渣表面;随着吸附得进行,吸附受扩散控制,主要发生在高炉渣孔内表面,且吸附活性位置基本被占据,空余活性位较少,因此吸附速率逐渐减慢[8]。当吸附时间>180 min后,继续增大吸附时间,高炉渣对于亚甲基蓝的吸附容量变化趋于平衡状态,因此,选取吸附时间为180 min。

图1 吸附时间对高炉渣吸附容量的影响
2.2 吸附pH值对吸附性能的影响
控制吸附实验条件为:吸附温度25 ℃,亚甲基蓝初始浓度100 mg/L,吸附时间180 min,高炉渣用量3.0 g/L,反应pH值对高炉渣吸附亚甲基蓝吸附容量的影响见图2。
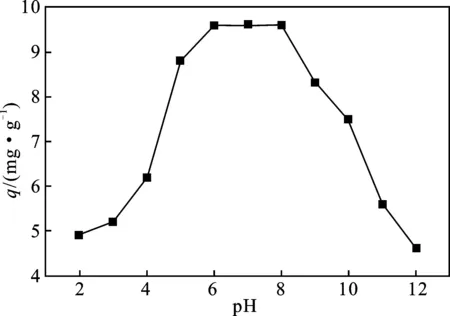
图2 反应pH值对高炉渣吸附容量的影响
由图2可知,反应pH值对高炉渣吸附容量影响非常显著,随着pH值的增大,高炉渣对亚甲基蓝的吸附容量先增大后减少。探究其原因,主要是因为:一方面,当pH值较低(pH<6.0)时,H+与吸附质对矿物的吸附点位存在竞争,而pH值增加时,溶液中H+数量降低,其与吸附质之间的竞争逐渐减弱。另一方面,当 pH>8.0后,随着pH值的升高,高炉渣的主要成分为钙、铝、镁、铁等物质,在溶液中形成金属氢氧化物附着在高炉渣的表面,从而对亚甲基蓝的吸附产生影响[9-10]。因此,在吸附过程中应充分考虑吸附体系的pH值,考虑实际应用,在本实验中将反应pH值控制在6.0~8.0较为适宜。
2.3 初始浓度对吸附性能的影响
控制吸附实验条件为吸附pH值7.0,吸附时间180 min,高炉渣用量3.0 g/L,初始浓度对高炉渣吸附亚甲基蓝的吸附容量的影响见图3。

图3 反应初始浓度对高炉渣吸附容量的影响
由图3可知,随着初始浓度增加,高炉渣对亚甲基蓝的吸附容量也不断增加,这是由于初始浓度的提高引起溶液本身与材料表面浓度梯度的增大,促进了吸附质向矿物内部迁移并使离子交换反应动力增大。同时,吸附温度的升高有利于吸附过程的进行,表明其为吸热过程。另外,溶液的黏度随着温度的升高而降低,有利于吸附质向内部孔道的扩散[11]。
2.4 吸附动力学
以准一级动力学方程和准二级动力学方程对高炉渣吸附亚甲基蓝的吸附数据进行拟合,相关动力学参数见表2。

表2 不同初始浓度下高炉渣吸附过程动力学方程拟合参数
ln(qe-qt)=lnqe-k1t
(2)
(3)
式中qt、qe——吸附t时和吸附平衡时吸附量,mg/g;
k1——准一级吸附速率常数,min-1;
k2——准二级吸附速率常数,g/(mg·min)。
由表2可知,相比而言,准二级动力学方程的线性相关系数(R2)均大于0.99,且理论值qe和实验值更为接近,表明准二级动力学模型可以更好地描述高炉渣对亚甲基蓝的吸附行为。
2.5 等温吸附模型
采用Langmuir和Freundlich两种模型研究了在等温条件下,高炉渣对溶液中亚甲基蓝的等温吸附过程。
(4)
(5)
式中Ce——吸附平衡时溶液中吸附质浓度,mg/L;
qe——平衡吸附容量,mg/g;
q0——吸附质的单层最大吸附容量,mg/g;
KL——Langmuir等温吸附常数,L/mg;
KF——Freundlich等温吸附常数,(mg·g-1)(L·g-1)n;
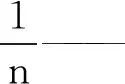
由表3可知,在不同温度下Langmuir吸附等温线方程的线性相关系数(R2)均大于 0.99,因此,相较而言高炉渣对亚甲基蓝的吸附行为更符合Langmuir等温吸附规律,且随着吸附温度的增加,q0和KL值均不同程度的升高,再次说明亚甲基蓝在高炉渣上的吸附是吸热的过程,提高吸附温度有利于吸附的进行。
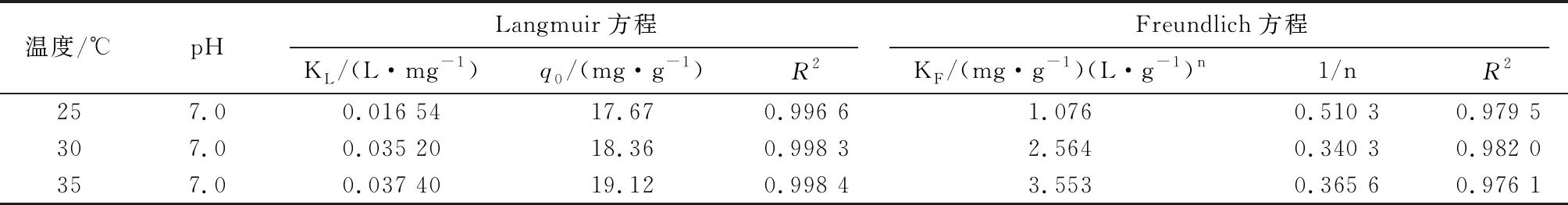
表3 不同温度下吸附过程Langmuir和Freundlich等温方程拟合参数
3 结论
(1)以高炉渣吸附亚甲基蓝的实验研究表明,高炉渣对亚甲基蓝的吸附容量与吸附pH值、初始浓度、吸附温度等因素紧密相关,吸附过程中反应pH值控制在6.0~8.0较为适宜,且高炉渣吸附亚甲基蓝的吸附速度较快,在180 min即可达到吸附平衡状态。
(2)高炉渣吸附亚甲基蓝的过程符合准二级动力学模型和Langmuir吸附等温线模型,且吸附过程为吸热过程。

