茶多酚对脓毒症大鼠肝损伤的作用研究*
张凤伟,桑珍珍,王淑娟,贾春梅,王 伟
(沧州市中心医院急诊医学部,沧州 061000)
脓毒症是感染、烧伤、创伤、休克等急危重患者的严重并发症,患者机体难以控制的炎症反应导致机体多个器官出现急性功能损伤,发展为脓毒性休克和多器官功能衰竭[1]。脓毒症患者病情发展十分迅速,尽管目前有良好的监护措施及诊疗技术,但其发病率和病死率仍较高。肝脏血运丰富,并且具有免疫、代谢、解毒等重要功能,是脓毒症最常受累的器官之一,脓毒症病理过程涉及炎症、氧化应激的过度激活,释放大量炎症因子,导致肝损伤[2]。肝损伤可出现在脓毒症的各个时期,是多器官功能衰竭和死亡的独立危险因素,尽早发现和干预可以改善脓毒症肝损伤患者的预后[3]。茶多酚(tea polyphenols,TP)是绿茶叶中酚类化合物及其衍生物的总称,主要包括表没食子儿茶素没食子酸酯、没食子儿茶素没食子酸酯、表儿茶素没食子酸酯、表没食子儿茶素、咖啡碱、表儿茶素及儿茶素等,是绿茶的主要活性物质。国内外大量研究显示,TP在调节炎症反应、细胞凋亡、氧化应激、抗肿瘤等方面发挥了重要作用[4-5],亦有学者发现其可参与脓毒症的发生发展和调控的过程[6]。但TP 是否对脓毒症肝损伤具有保护作用目前相关报道仍较少。因此,本研究通过探讨TP 对脓毒症大鼠肝损伤的保护作用及其作用机制,以期为脓毒症临床治疗寻求新的方向,减少脓毒症引起的肝功能衰竭,改善患者的预后,并且为明确TP改善肝损伤的药理作用提供科学依据。
1 材料与方法
1.1 大鼠盲肠结扎穿刺法(cecum ligation and puncture,CLP)模型的建立及分组 40 只7 周龄健康雄性成年SD大鼠购自东方生物服务公司(南京)。实验方案经沧州市中心医院伦理委员会批准,符合《实验动物护理与使用指南》(IACUC-190525-12)。所有大鼠维持12 h的光/暗循环,并随意喂食食物和水。实验前,让大鼠适应环境1周。将SD大鼠随机分为4组:Sham组(术后每天300 mg/kg生理盐水灌胃)、Sham+TP 组(CLP 术后每天300 mg/kg TP 灌胃)、CLP 组(CLP 术后每天300 mg/kg 生理盐水灌胃)、CLP+TP 组(CLP 术后每天300 mg/kg TP 灌胃),每组10 只。采用CLP 建立脓毒症模型[7]:异氟醚麻醉下,正中切口1.5 cm 暴露盲肠,随后在距盲肠尖端1 cm处用5-0丝线结扎,用18号针头穿刺盲肠,挤压出少量粪便,然后用无菌4-0 丝线缝合切口。Sham组和Sham+TP组行剖腹手术,但不结扎、不穿孔。术后皮下注射1 mL 生理盐水进行液体复苏。7 d后麻醉处死大鼠,并取出肝脏组织、全血。
1.2 大鼠肝脏组织形态学检查 大鼠肝脏组织用4%多聚甲醛固定24 h后进行切片,进行苏木精-伊红(HE)染色(麦克林,上海):对切片用无水乙醇-二甲苯溶液脱蜡,洗涤后浸入苏木精溶液中染色5~8 min 取出洗涤,浸入伊红溶液染色3 min 取出洗涤,依次放入无水乙醇—二甲苯中5 min,使用中性树胶封片。400 倍光学显微镜(Olympus,日本东京)下观察并采集图像,重复3次。
1.3 大鼠血清肝功能检测 取全血3 000 r/min 离心15 min,收集上层血清待测。采用微量法活性检测试剂盒(索莱宝,北京)检测大鼠血清谷草转氨酶(aspertate aminotransferase,AST)及谷丙转氨酶(alanine aminotransferase,ALT)等肝脏功能的指标。根据试剂盒说明书操作,重复3次。
1.4 大鼠肝脏细胞凋亡测定 使用脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TdT-mediated dUTP Nick-End Labeling,TUNEL)试剂盒(Roche,德国)评估大鼠肝脏细胞凋亡情况。剪取少量肝脏组织,加入胰蛋白酶-EDTA 消化液,置于37 ℃培养箱中20 min,收集上清液过滤,800 r/min离心5 min,收集底层肝脏细胞,PBS 洗涤5 组肝脏细胞后,利用4%多聚甲醛固定细胞30 min 后再次进行洗涤,随后用含0.1%Triton X-100 的PBS 重悬细胞,冰孵2 min 后再次洗涤2 次。加入50 μL TUNEL 检测液,37 ℃避光孵育60 min,PBS 洗涤2 次,250 μL PBS悬浮细胞,涂片后在荧光显微镜下观察并进行定量分析,重复3次。
1.5 大鼠肝脏组织白细胞介素-6(IL-6)的表达
肝脏组织在10%福尔马林溶液中置于4 ℃冰箱固定72 h。然后,对样品进行常规处理和石蜡包埋。然后将组织切成4 μm 厚度使用IL-6 兔抗大鼠一抗(Abcam,美国,稀释浓度1∶50)、山羊抗兔二抗(索莱宝,北京,稀释浓度1∶200)进行免疫组化染色(Immuno histochemistry,IHC),根据SP 试剂盒(中山金桥,北京)说明书操作,显微镜观察染色情况,重复3次。
1.6 大鼠肝组织IL-6和肿瘤坏死因子-α(TNF-α)检测 采用酶联免疫吸附试剂盒(建成,南京)测定4 组大鼠肝组织IL-6 和TNF-α,重复3 次,参照试剂盒说明书操作。
1.7 大鼠肝脏组织氧化应激标志物检测 检测肝脏匀浆的上清液氧化应激标记物水平。根据生物诊断试剂盒(Dokki,埃及)说明书,对过氧化氢酶(catalase,CAT)及超氧化物歧化酶(superoxide dismutase,SOD)进行检测,重复3次。
1.8 统计学方法 采用SPSS 21.0软件进行统计分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 TP对脓毒症大鼠肝损伤具有保护治疗作用
Sham 组大鼠肝形态正常,与Sham 组比较,Sham+TP 组肝形态无明显改变,说明TP 对大鼠肝脏无明显毒副作用;CLP 组大鼠肝脏出现大空泡,说明肝脏受到损伤;而CLP+TP 组大鼠肝脏大空泡较CLP 组明显减少,说明TP 可改善脓毒症大鼠肝脏组织形态学表现,见图1。与Sham 组相比,Sham+TP组AST及ALT的水平比较,差异无统计学意义(P>0.05);CLP 组与Sham 组相比,AST 及ALT 的水平增高(P<0.001);CLP+TP 组与CLP 组相比,AST及ALT的水平降低(P<0.01),见表1。
表1 TP处理对脓毒症大鼠血液中AST、ALT含量的影响U/L, ±s

表1 TP处理对脓毒症大鼠血液中AST、ALT含量的影响U/L, ±s
与Sham组相比,###P<0.001;与CLP组相比,**P<0.01。
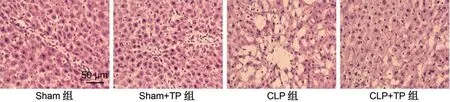
图1 各组大鼠肝脏组织形态学(HE,×400)
2.2 TP可减少脓毒症大鼠肝脏细胞凋亡 与Sham组相比,Sham+TP组TUNEL阳性细胞比例比较,差异无统计学意义(P>0.05);与Sham组相比,CLP组TUNEL阳性细胞比例增加(P<0.001);与CLP组相比,CLP+TP 组TUNEL 阳性细胞比例降低(P<0.01),见图2、表2。
表2 TP处理对脓毒症大鼠肝脏细胞中TUNEL染色阳性细胞比例的影响%, ±s

表2 TP处理对脓毒症大鼠肝脏细胞中TUNEL染色阳性细胞比例的影响%, ±s
与Sham组相比,###P<0.001;与CLP组相比,**P<0.01。

图2 TP对脓毒症大鼠肝脏细胞凋亡的影响(×400)
2.3 TP对脓毒症大鼠肝脏组织中炎症反应的影响
IL-6阳性反应呈棕色。Sham+TP组及Sham组大鼠肝脏组织中均无明显的IL-6阳性表达;在CLP组中,可见大量IL-6阳性表达,而CLP+TP组IL-6阳性表达减少,见图3。与Sham 组相比,Sham+TP 组IL-6及TNF-α水平比较,差异均无统计学意义(P>0.05);与Sham组相比,CLP组IL-6及TNF-α水平增高(P<0.001);与CLP 组相比,CLP+TP 组IL-6 及TNF-α水平降低(P<0.01),见表3。
表3 TP处理对脓毒症大鼠肝脏中IL-6、TNF-α含量的影响pg/mL, ±s

表3 TP处理对脓毒症大鼠肝脏中IL-6、TNF-α含量的影响pg/mL, ±s
与Sham组相比,##P<0.01,###P<0.001;与CLP组相比,**P<0.01,***P<0.001。

图3 免疫组化染色观察TP对轻脓毒症大鼠肝脏组织中IL-6水平的影响(×400)
2.4 TP对脓毒症大鼠肝脏组织中氧化应激反应的影响 与Sham 组相比,Sham+TP 组CAT 及SOD 水平比较,差异均无统计学意义(P>0.05);与Sham组相比,CLP 组CAT 及SOD 水平降低(P<0.01);与CLP组相比,CLP+TP组CAT及SOD水平增高(P<0.05),见表4。

表4 TP处理对脓毒症大鼠肝脏组织中的CAT、SOD含量的影响U/mg,n=10
3 讨论
近年来,脓毒症发病率在全世界范围内仍呈现明显增高的趋势,且死亡率居高不下[8]。肝脏是脓毒症最常受累的靶器官之一,与预后密切相关。脓毒症后的肝功能障碍是多器官功能障碍和脓毒症诱发的死亡的独立危险因素,给临床诊疗带来了较大的困扰[9-10]。脓毒症发生时肝脏微循环血流量减少,肝窦灌注降低,肝功能降低,本研究应用CLP诱导的脓毒症大鼠肝损伤模型,发现CLP组大鼠肝脏出现大空泡,且CLP组与Sham组相比,AST及ALT的水平增高,说明脓毒症时大鼠的肝脏受损,并且在这一病理过程中,大鼠肝脏组织中炎症及氧化应激存在过度激活。
TP是茶叶中非常重要的成分,作为一种天然的酚类化合物参与过氧化过程中螯合脂质过氧化自由基,降低多酚自由基含量,阻断自由基氧化链反应,从而有效清除自由基,现已被国内外学者广泛应用于过氧化引起的多种疾病治疗中,如梗阻性黄疸肝损伤、急性肝损伤、酒精性肝损伤和肝癌,发挥肝保护作用[11-12]。为验证TP对脓毒症大鼠肝损伤是否具有保护作用,本研究通过给予CLP大鼠模型TP治疗,发现CLP+TP 组大鼠肝脏大空泡较CLP 组减少,CLP+TP 组AST 及ALT 的水平低于CLP 组,说明TP 对脓毒症大鼠肝损伤具有保护治疗作用。肝细胞凋亡或者坏死是造成肝脏损伤和肝脏疾病最基本的中心环节,在脓毒症肝损伤的发生发展中具有重要的作用[13]。本研究采用TUNEL 染色对各组大鼠肝脏细胞凋亡进行研究,结果显示,Sham 组的大鼠采用TP 或者生理盐水灌胃后CLP 组TUNEL阳性细胞比例高于Sham 组,而脓毒症模型大鼠经TP 治疗后,TUNEL 阳性细胞比例降低,提示TP 可减少脓毒症大鼠肝脏细胞凋亡。
炎症细胞过度激活并释放大量炎症因子是脓毒症发生发展的重要机制之一。有研究显示,脓毒症能引起的肝损伤涉及炎症反应及氧化应激的过度激活,此时体内可产生大量的氧自由基,而自由基的形成及其引发的脂质过氧化反应是肝损伤的主要机制之一,并且已有文献报道炎症因子如TNFα 直接参与肝坏死的发生,在脓毒症肝损伤中发挥重要的作用[14-15]。而TP已被证实在多种生理及病理过程中可发挥抗炎及抗氧化的作用,不仅可减少细胞内因氧化和自由基引起的DNA 损伤,保护组织,还可与过氧化氢自由基反应,终止脂质过氧化反应[16-17]。本研究大鼠肝脏组织切片IHC 染色发现,Sham 组的大鼠肝脏组织中均无明显IL-6 表达。Sham+TP 组、Sham 组的大鼠肝脏IL-6 及TNF-α 水平比较,差异均无统计学意义,且CAT 及SOD 水平比较,差异均无统计学意义,说明手术过程及灌胃处理对大鼠的炎症因子、氧化应激因子的表达无显著影响,而脓毒症模型大鼠的IL-6及TNF-α水平均增高,CAT及SOD水平降低,且经TP治疗的大鼠模型的肝脏组织IL-6及TNF-α水平降低,CAT及SOD水平增高,提示TP在脓毒症引起的肝损伤这一病理过程中可发挥其抗炎及抗氧化的作用。
综上所述,TP可通过抑制脓毒症引起的肝脏炎症及氧化应激反应进而发挥其对肝脏的保护作用,并且具有一定的安全性,可为脓毒症的临床治疗及辅助用药提供新的思路,但对于TP改善脓毒症引起肝损伤的具体作用机制仍然需要进一步研究。

