SPAG6的DNA高甲基化对鼻咽癌细胞增殖的影响*
钟雪敏,冯国飞,周晓莹,黄光武△
(1.广西医科大学第一附属医院耳鼻咽喉头颈外科,南宁 530021;2.广西医科大学区域性高发肿瘤早期防治研究教育部重点实验室,南宁 530021;3.广西区域性高发肿瘤早期防治研究重点实验室,南宁 530021;4.广西医科大学生命科学研究院,南宁 530021)
鼻咽癌(NPC)是一种非淋巴瘤性鳞状细胞癌,发生在鼻咽部的上皮内层[1],是一种极具独特的地理和种族分布模式的肿瘤[2]。在世界大部分区域,NPC 的发病率约为1/100 000,而在南亚,尤其华南地区(广东省和广西壮族自治区),发病率较前者高了100 倍。NPC 的致病风险因素包括Epstein-Barr病毒感染(EBV)、饮酒、吸烟以及接触烟雾、烟雾、化学品和甲醛[3-4]。此外,表观遗传修饰,尤其DNA高甲基化修饰,是NPC发生的重要机制。目前已在NPC 中鉴定出多种重要的肿瘤抑制基因(TSG),它们被DNA 启动子高甲基化下调,如CDH4、RASSF2A、RERG[5-7]。近年来,NPC 的治疗得到飞速发展,然而患者预后较差。因此,寻找新的分子标志物对NPC 的诊断及提供精准的靶向药物治疗具有十分重要的意义。
精子相关抗原6(SPAG6),亦称为CT141,首次在人类睾丸组织中被检测到[8],其主要功能是参与生殖细胞的成熟并维持精子活力和生育能力[9]。最新研究表明,SPAG6 涉及肿瘤发生发展,其被鉴定为一种肿瘤标志物,并参与个别实体瘤的治疗。研究发现,SPAG6促进伯基特淋巴瘤与恶性骨髓细胞的生长[10-11],而在非小细胞肺癌中SPAG6受DNA甲基化转录调控[12],但其异位表达对非小细胞肺癌并无影响[13]。通过基因功能富集分析及信号通路富集分析发现,SPAG6与NPC的发生发展密切相关。但SPAG6 在NPC 中的生物学功能尚未清晰。本研究旨在探讨SPAG6在NPC中的表达及其对NPC细胞生物学行为的影响,为SPAG6作为NPC诊断标志物和治疗新靶点提供理论依据。
1 材料与方法
1.1 主要试剂 甲基转移酶抑制剂5-aza-dC 购于美国Sigma 公司。DMEM(高糖)培养基、胎牛血清及KSFM(含生长因子)购于美国Gibco 公司;青—链霉素及苏木精染色液购于北京索莱宝责任有限公司;cDNA 逆转录试剂盒购于北京全式金公司;SYBR Green Supermix 购于德国Qiagen;SPAG6 和β-actin 引物购于奥科公司;Trizol 试剂和Lipofectamine 3000 转染试剂购于美国Invitrogen;SPAG6 抗体(ab155653)购于自英国Abcam 公司;GAPDH 抗体(HRP-60004)购于美国Proteintech;荧光二抗购于美国Li-COR;pCMV6-entry-SPAG6 质粒(RC216144)及其空载质粒(PS100001)购于美国Origene公司;免疫组化试剂盒购于北京中杉金桥公司;CCK-8试剂盒购于日本Dojindo公司。
1.2 生物信息分析 在GEO 数据库(https://www.ncbi.nlm.nih.gov/gds/)中搜索并下载NPC 基因表达数据(GSE13597、GSE12452、GSE40290、GSE53819、GSE64634),分析SPAG6 在NPC 与NNE 中的转录表达水平。
为了研究NPC 中SPAG6 异常转录表达的一致性,对6 个微阵列数据集包括114 例NPC 和46 例NNE 组织进行Meta 分析。以“nasopharyngeal OR nasopharynx”“cancer OR carcinoma OR adenocarcinoma OR tumor OR tumor OR malignancy/malignant* OR neoplasm* OR oncology*”为英文检索关键词,在Pubmed 数据库上进行搜索。比较NPC 和NNE样本中SPAG6转录水平,纳入标准:(1)基因表达数据来源于人类;(2)样本均取自恶性组织或非癌性组织;(3)NNE 组和NPC 组均至少3 例;(4)涉及的患者均未接受治疗。STATA 12 软件用于Meta分析。
为了研究SPAG6 是否因启动子高甲基化而转录失调,本研究使用EMBOSS(https://www.ebi.ac.uk/Tools/emboss/)探究SPAG6 启动子区,并通过甲基化芯片(GSE62336)研究SPAG6启动子区在NPC与NNE组织中的甲基化程度。
1.3 组织标本获取及细胞培养 收集来自广西医科大学第一附属医院的34例NPC癌组织和29例正常鼻咽上皮(NNE)组织,所有样本均经本院病理科医师确诊,所有患者均已知情同意并签署知情同意书。其中,24例NPC及19例NNE组织用于RNA提取,其余10例NPC 及10例NNE样本用于免疫组化染色技术。组织样本获取通过广西医科大学第一附属医院伦理委员会的批准(No.2016-KY-050)。正常鼻咽上皮细胞(NP69)及NPC细胞(HK1、HK1-EBV、HONE1、5-8F、6-10B、CNE1、CNE2、CNE2-EBV、TW03)由广西医科大学重点实验室提供。NP69细胞培养在含0.2%生长因子的KSFM培养基中,NPC 细胞培养于含10%胎牛血清和1%青—链霉素的DMEM高糖培养基中。
1.4 RT-qPCR法检测SPAG6 mRNA相对表达量 提取组织和细胞总RNA,逆转录为cDNA,在Step One Plus(Applied Biosystems)仪器进行PCR反应[14]。引物序列如下:SPAG6 上游:5’-GACGTGGTCCCAACAATTCAA-3’,下游:5’-ACAGCTTCTGCTAGGTCATCAT-3’;β-actin上游:5’-CTTCGCGGGCGACGAT-3’,下游:5’-CCACATAGGAATCCTTCTGACC-3’。PCR反应条件:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火延伸1 min,共40 个循环。采用2-ΔΔCT法计算SPAG6 mRNA相对表达量。
1.5 免疫组化染色检测SPAG6 蛋白表达 制备组织石蜡切片,二甲苯脱蜡,酒精水化,柠檬酸盐修复液修复,冷却至室温,加入SPAG6 抗体(1∶100)4 ℃冰箱孵育过夜;复温30 min,加入生物素标记山羊抗小鼠/兔IgG聚合物和辣根酶标记链霉卵白素,DAB显色,苏木精复染,盐酸酒精分化,自来水反蓝后自然风干,中性树胶封片。由两位经验丰富的病理科医师对免疫组化结果进行评分,结果判定采用半定量计分法。染色强度的评分标准:不着色、浅黄色、棕黄色、棕褐色分别为0 分、1 分、2 分、3 分;阳性细胞的百分比评分标准:阳性细胞占比0~5%、≤10%、11%~50%、51%~75%、>75%分别评为0 分、1 分、2分、3分、4分。以上两项评分的乘积即为免疫组化染色得分,表示SPAG6蛋白表达水平。
1.6 5-aza-dC 去甲基化处理 将4 株NPC 细胞(HONE1、5-8F、6-10B、TW03)以1×104个密度接种到6孔板中,每株细胞均分别加入含5 μmol/L 5-azadC的培养基和含DMSO培养基,置于细胞培养箱内孵育4 d,每天更换1 次新鲜培养基(含5-aza-dC 或DMSO)。
1.7 瞬时转染 构建SPAG6 过表达细胞株,在NPC 细胞系5-8F 中通过克隆含完整的SPAG6 cDNA 编码区的DNA 片段扩增到载体pCMV6-entry。使用Lipofectamine 3000 将pCMV6-entry-SPAG6 质粒及空载质粒(Ctrl)分别转染至5-8F。
1.8 Western blotting法检测SPAG6蛋白表达 提取细胞总蛋白[15],煮沸使蛋白变性后,取20 μg蛋白上样,进行NuPAGETM 4-12%Bis-Tris电泳30 min;将蛋白转移至NC膜,5%BSA封闭90 min,加入一抗SPAG6(1∶1 000)、GAPDH(1∶1 000)4 ℃冰箱孵育过夜;TBST 洗膜3 次,加入荧光二抗(1∶10 000)室温下避光孵育90 min;红外荧光扫描仪成像后,用Image J 软件对条带灰度值进行分析。以目的蛋白条带灰度值与内参蛋白条带灰度值的比值作为目的蛋白相对表达量。
1.9 CCK-8法检测细胞增殖 将5-8F细胞以1×103个/孔的密度接种到96孔板中,置于细胞培养箱中培养5 d。从第2 天开始,各孔加入CCK-8 溶液(10 μL/孔)孵育1.5 h,充分震荡均匀后,用酶标仪检测450 nm波长处各孔的吸光度(OD)值。
1.10 统计学方法 采用SPSS 23.0 统计软件进行数据分析。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 SPAG6 在NPC 中的表达 在5 个GEO 微阵列数据集(GSE13597、GSE12452、GSE40290、GSE53819、GSE64634)中,NPC癌组织中SPAG6的转录水平均明显低于相应正常组织(均P<0.05),见图1。

图1 SPAG6在NPC基因芯片中的表达情况
Meta分析显示:单个数据集具有异质性(I2=76.4%,P<0.001),NPC 组织中SPAG6 转录水平低于正常组织(SMD=-1.66,95%CI:-2.58~-0.73,P=0.000),见图2A;通过漏斗图绘制对发表偏倚进行检验,Begg 检验(P=0.707,图2B)和Egger 检验(P=0.558,图2C)结果均无明显偏倚;敏感性分析结果(图2D)揭示剔除任一研究结果均不改变结论,结果较为稳定。GEO数据集的详细信息见表1。
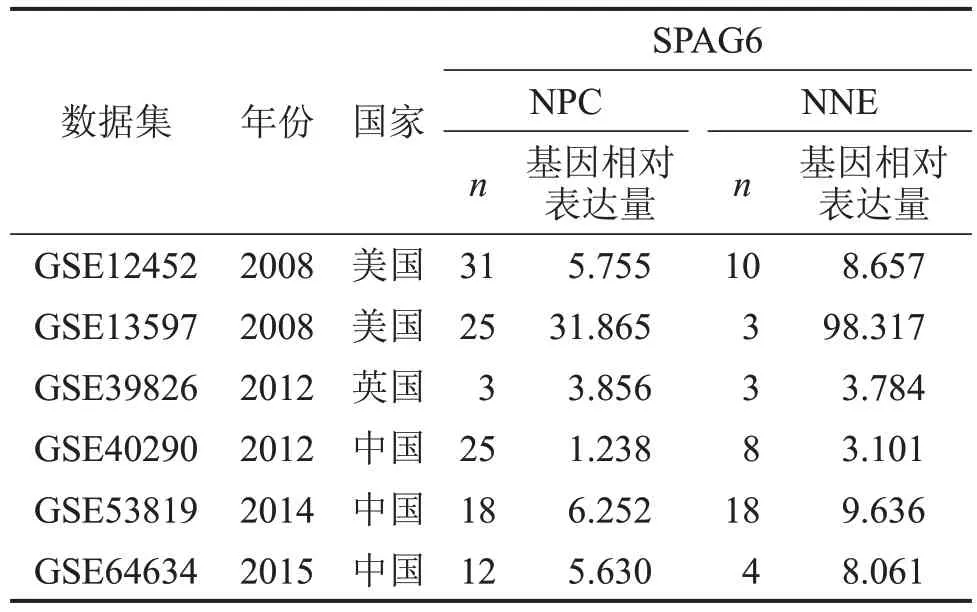
表1 用于Meta分析的GEO数据集的详细信息

图2 SPAG6在NPC GEO芯片的Meta分析
2.2 NPC 细胞及组织中SPAG6 基因表达下调 与NP69 细胞比较,NPC 细胞中SPAG6 mRNA 相对表达量降低(P<0.05),见图3A。与NNE 组织比较,NPC 组织中SPAG6 mRNA 相对表达量降低(P<0.05),图3B。SPAG6 蛋白在NNE 细胞质和细胞膜中表达更为稳定,特别在细胞游离面的纤毛上表达更为明显,而在NPC组织中表达较弱(P<0.05),见图3C。
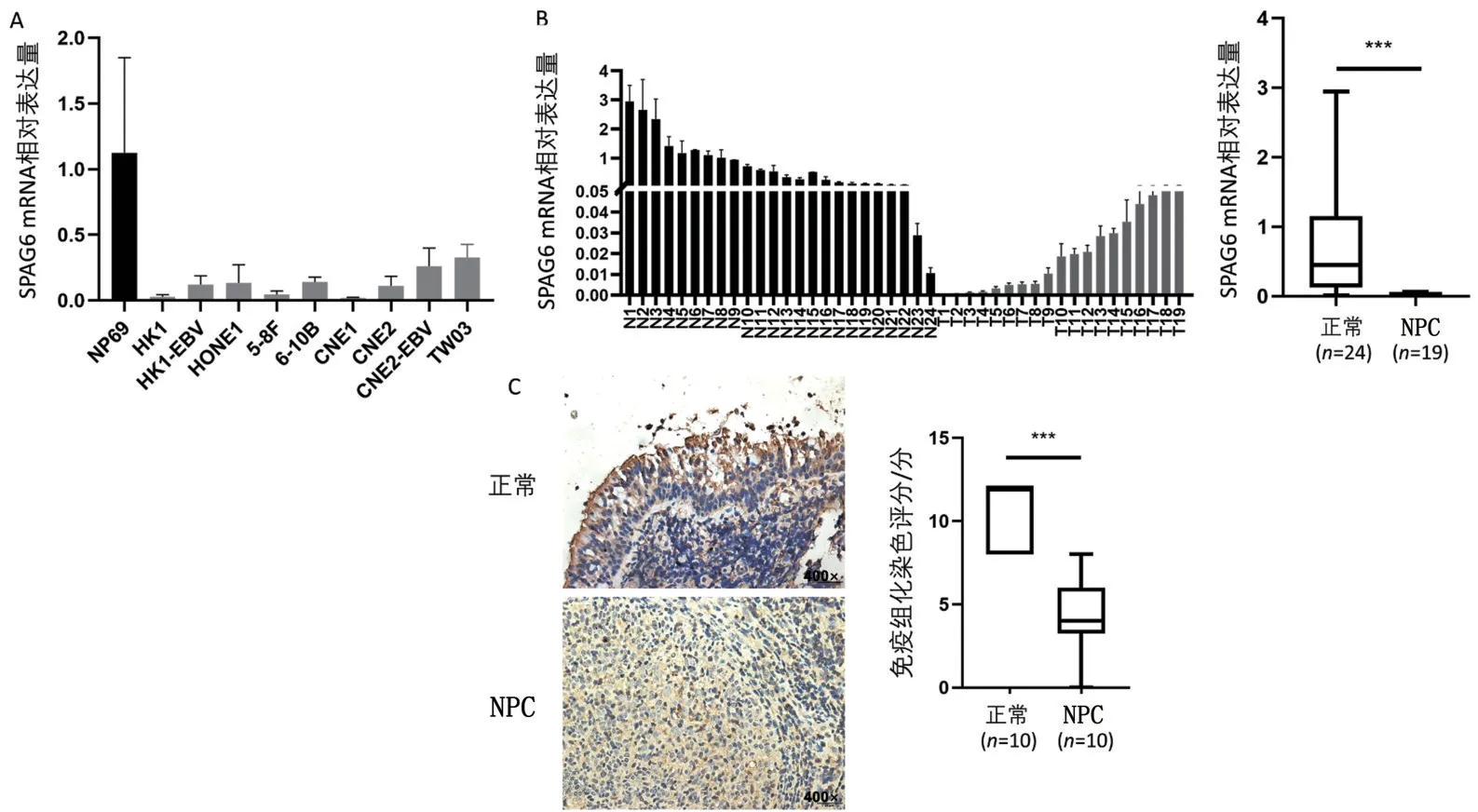
图3 SPAG6在NPC细胞及组织中的表达
2.3 DNA高甲基化导致SPAG6基因转录失调 在SPAG6 的启动子区域发现了一个长度为770 bp(从转录起始位点-365~+404 bp)的CpG岛(图4A)。该启动子区域包括8 个CpG 位点,与NNE 组织比较,NPC 组织中所有CpG 位点的平均甲基化率升高(P<0.05),见图4B。5-aza-dC去甲基化处理后,NPC细胞(HONE1、5-8F、6-10B、TW03)SPAG6 mRNA相对表达量升高(均P<0.05),见图5。

图4 NPC和正常组织中SPAG6的DNA启动子甲基化程度

图5 去甲基化处理的NPC细胞中SPAG6 mRNA相对表达量
2.4 过表达SPAG6基因在体外抑制NPC细胞的增殖 转染过表达质粒后5-8F 细胞中SPAG6 基因和蛋白表达量升高(P<0.05),见图6A、图6B。SPAG6-5-8F组细胞生长较Ctrl-5-8F组缓慢,见图6C。
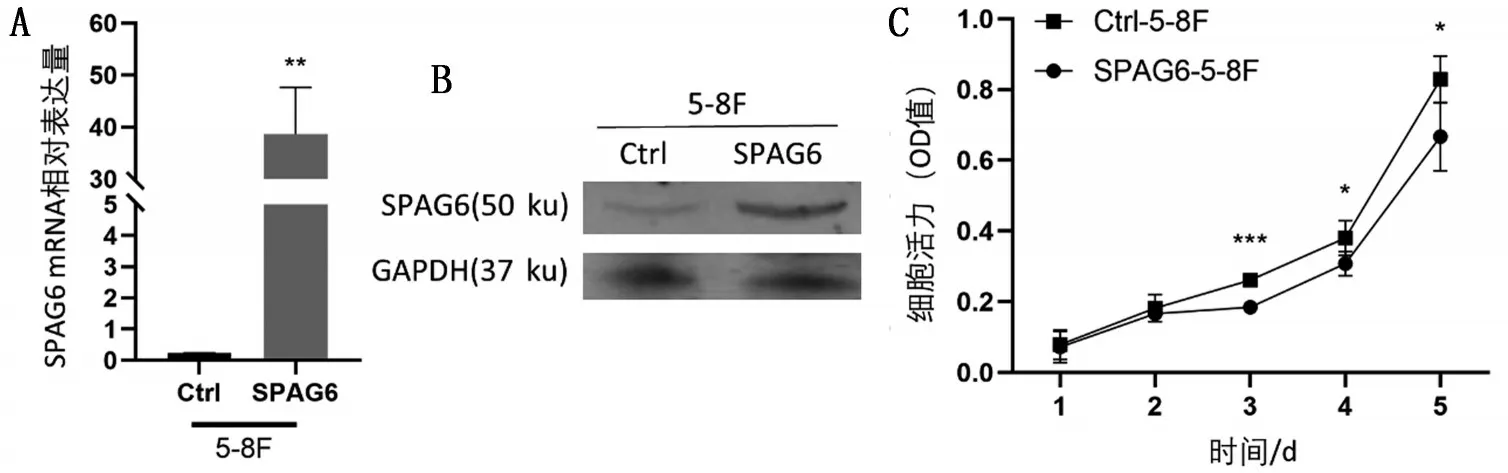
图6 过表达SPAG6抑制体外NPC细胞增殖
3 讨论
SPAG6是一种新型癌睾丸抗原,主要调节某些细胞的增殖及分化,是CTA家族一员。癌睾丸抗原是最具前景的抗癌免疫反应激活蛋白质之一,仅在特定组织中表达,若其含量异常增多,则表明该肿瘤具有免疫原性[16]。研究表明,SPAG6 在肺癌及骨髓增生异常综合征等肿瘤中的表达升高,揭示该基因对肿瘤形成起到关键作用[13,17];SPAG6 通过激活PTEN/PI3K/AKT 通路促进伯基特淋巴瘤生长[10];Yang 等[11]报道,在沉默SPAG6 表达后,恶性骨髓细胞的生长被显著抑制。
在NPC 的研究进展中广泛观察到表观遗传学改变,包括DNA、RNA、蛋白质、miRNA 的差异修饰[18],导致一系列抑癌基因表达失调。其中DNA高甲基化是目前报道最多的NPC 的发生机制[19]。有学者在非小细胞肺癌及骨髓增生异常综合征中发现SPAG6高甲基化[12-13]。本研究发现,SPAG6 在NPC中亦呈现高甲基化状态,利用甲基转移酶抑制剂处理后,NPC细胞能恢复SPAG6的表达水平。提示在NPC中DNA高甲基化是SPAG6转录失活的重要机制之一。
本研究首先通过GEO 数据库中的SPAG6 在NPC中的转录表达数据进行了分析,发现在NPC中SPAG6 mRNA相对表达量低于正常组织,RT-qPCR法分别对NPC 细胞及组织中SPAG6 转录水平进行验证,结果与GEO 数据库分析一致;免疫组化染色技术对SPAG6在NPC中的蛋白表达水平进行分析,发现其在NPC 中的表达低于正常组织。为进一步探索SPAG6在NPC中转录表达失调机制,本研究进行甲基化芯片分析,发现在NPC中SPAG6启动子区甲基化程度高于正常组织;利用甲基转移酶抑制剂5-aza-dC 处理NPC 细胞后,采用RT-qPCR 法检测SPAG6表达情况,发现5-aza-dC能恢复NPC细胞的SPAG6 表达水平;通过CCK-8 实验探索SPAG6 对NPC细胞增殖能力的影响,结果显示SPAG6过表达在体外能有效抑制NPC 细胞的增殖。甲基化修饰介导的基因表达失活是可逆的,通过甲基转移酶抑制剂恢复SPAG6表达可逆转癌细胞的表型。因此,SPAG6可作为NPC基因治疗的新靶点。
综上,SPAG6基因上调能有效抑制NPC细胞增殖。SPAG6 有望作为抗癌药物靶点应用于临床治疗。然而,SPAG6在NPC和其他肿瘤中的巨大治疗潜力有待进一步探索。

