LncRNA CASC15通过miR-153-3p/Nrf2反馈环调控胃癌细胞增殖、侵袭和上皮间质转化*
郭 沁,热依拉· 加帕尔,伊尔潘· 库尔班,肖 勇,徐 蓉,苏莎莎
(1.新疆维吾尔自治区第三人民医院消化科,乌鲁木齐 830002;2.新疆维吾尔自治区人民医院肿瘤科,乌鲁木齐 830001;3.新疆医科大学附属中医医院消化内科,乌鲁木齐 830000)
胃癌是第四大常见的癌症,也是全球第二大癌症相关死亡原因。尽管在外科手术和其他治疗方式方面取得了进展,但患者的预后仍然较差[1]。因此,阐明胃癌发生的调控网络,开发新的诊断和靶向治疗的生物标志物是非常必要的。长链非编码RNA(long noncoding RNA,LncRNA)是一类转录本长度超过200 nt 的非编码RNA[2],在癌症的发展中具有重要的调控作用,可作为检测癌症的血液生物标志物[3-4]。有文献已经证明LncRNA参与了胃癌进展和肿瘤发生[5],如LncRNA-PVT1 和FOXM1 的正反馈回路促进胃癌的生长和侵袭[6]。CASC15 是一种保守的LncRNA,已被证明在不同的癌症中发挥了重要的生物学功能。如LncRNA CASC15可通过调控miR-221/ARID1A 轴抑制卵巢癌进展[7]。LncRNA CASC15 通 过 调 控miR-4310/LGR5/Wnt/βcatenin信号通路促进结肠癌细胞增殖和转移[8]。但是,它在胃癌中的作用仍然是未知的。本研究旨在探讨LncRNA CASC15 对胃癌SGC-7901 细胞发展的影响,研究胃癌的发病机制,为患者的治疗提供一个有价值的预后生物标志物和治疗靶点。
1 材料与方法
1.1 样本来源
经本院医学伦理委员会批准,并在患者知情同意下,于2020 年10 月至2021 年4 月在手术后从本院病理科收集了45例胃癌组织和40例癌旁正常组织标本,患者未经过任何放/化疗治疗,其中男26例,女19 例,平均(48.56±6.79)岁,经过病理诊断确诊,标本置于液氮中保存。
1.2 主要材料
胃癌SGC-7901细胞和人正常胃黏膜上皮GES-1细胞来自中国科学院上海细胞库。基质胶来自上海吉至生化科技有限公司。CASC15 siRNA、Nrf2 siRNA等质粒由北京擎科生物公司合成。miR-153-3p 抑制剂(miR-153-3p inhibitor)、miR-153-3p 模拟物(miR-153-3p mimics)来自Genepharma公司。
1.3 方法
1.3.1 细胞培养 SGC-7901 和GES-1 细胞置于新鲜DMEM 培养基中,加入10%FBS、100 U/mL 青霉素和100 U/mL链霉素,培养皿放置于培养箱中常规培养(37 ℃、5%CO2、饱和湿度),用胰酶分离后传代培养。
1.3.2 细胞转染 SGC-7901细胞接种于12孔培养板中12 h,用无FBS 的DMEM 培养基覆盖细胞,按照Turbofect说明书将质粒分别转染至SGC-7901细胞,培养皿置于培养箱中,实时荧光定量聚合酶链式反应(RT-qPCR)检测转染效率,48 h后收集细胞。
1.3.3 细胞活力测定 质粒转染后的SGC-7901 细胞稀释并接种于96 孔板,设置3 个复孔,放置于培养箱中48 h 后,取浓度为5 mg/mL 的MTT,每孔滴入20 μL,并于4 h后加入DMSO 150 μL,震荡10 min,酶标仪上检测570 nm处的光密度值。
1.3.4 双荧光素酶报告基因活性检测 预测LncRNA CASC15 和miR-153-3p 的靶基因,组 建LncRNA CASC15 wt载体和Nrf2 wt载体,突变后的质粒命名为LncRNA CASC15 mut 和Nrf2 mut。用转染试剂将LncRNA CASC15、Nrf2 野生与突变质粒分别与miR-153-3p mimics、mimics NC 共转染至SGC-7901细胞并检测荧光素酶活性。
1.3.5 细胞侵袭实验 Transwell上室中加入200 μL稀释的Matrigel 基质,静置12 h。SGC-7901 细胞调整密度为1×105个,铺于Transwell上室,下室中加入400 μL DMEM培养基,24 h后用PBS清洗,加入4%多聚甲醛固定,0.1%结晶紫染色浸染20 min后用显微镜观察并拍照,每样片随机取4个视野计数迁移细胞,计算平均值。
1.3.6 RT-qPCR Trizol 方法提取细胞总RNA,将OD260/280值为1.8-2.0 的RNA 反转为cDNA,得到的cDNA 为模板,参照说明书进行qPCR,每组重复3次,以SYBR Green染料法进行PCR反应,GAPDH和U6为内参基因,采用2-△△CT法计算基因的相对表达水平。引物序列见表1。

表1 引物序列
1.3.7 Western blotting 实验 提取各组细胞蛋白,BCA 蛋白检测试剂盒测定所提取的蛋白浓度。每孔50 μg 总蛋白进行SDS-PAGE,然后转印到PVDF膜上,用PBST封闭2 h,加入一抗(N-cadherin 1∶1 000;E-cadherin 1∶1 000),置于4 ℃冰箱孵育过夜,TBST洗3 次,二抗(1∶3 000)37 ℃孵育2 h,ECL 化学发光,Bio-Rad凝胶成像系统采集图像,进行灰度值分析,每组实验重复3次。
1.4 统计学方法
采用SPSS 17.0 软件进行数据分析。实验均独立重复3次,结果以均数±标准差(±s)表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 下调LncRNA CASC15 抑制SGC-7901 细胞的增殖、侵袭及EMT
RT-qPCR 检测结果显示,胃癌组织中CASC15表达高于癌旁正常组织(P<0.01),见图1A。SGC-7901 细胞中CASC15 表达高于GES-1 细胞(P<0.01),见图1B。通过siRNA技术下调了CASC15表达,结果显示,CASC15 siRNA组细胞内CASC15表达低于siRNA NC 组(P<0.01),见 图1C。将CASC15 siRNA及其siRNA NC转染细胞,进一步分析了细胞增殖、侵袭和EMT 能力,结果显示,CASC15 siRNA 组细胞活力低于siRNA NC 组(P<0.01),见图1D;与siRNA NC 组比较,CASC15 siRNA组N-cadherin表达降低(P<0.01),E-cadherin表达上升(P<0.01),见图1E~图1F。CASC15 siRNA组细胞侵袭数目减少(P<0.001),见图1G~图1H。表明下调LncRNA CASC15 抑制SGC-7901 细胞增殖、侵袭及EMT。
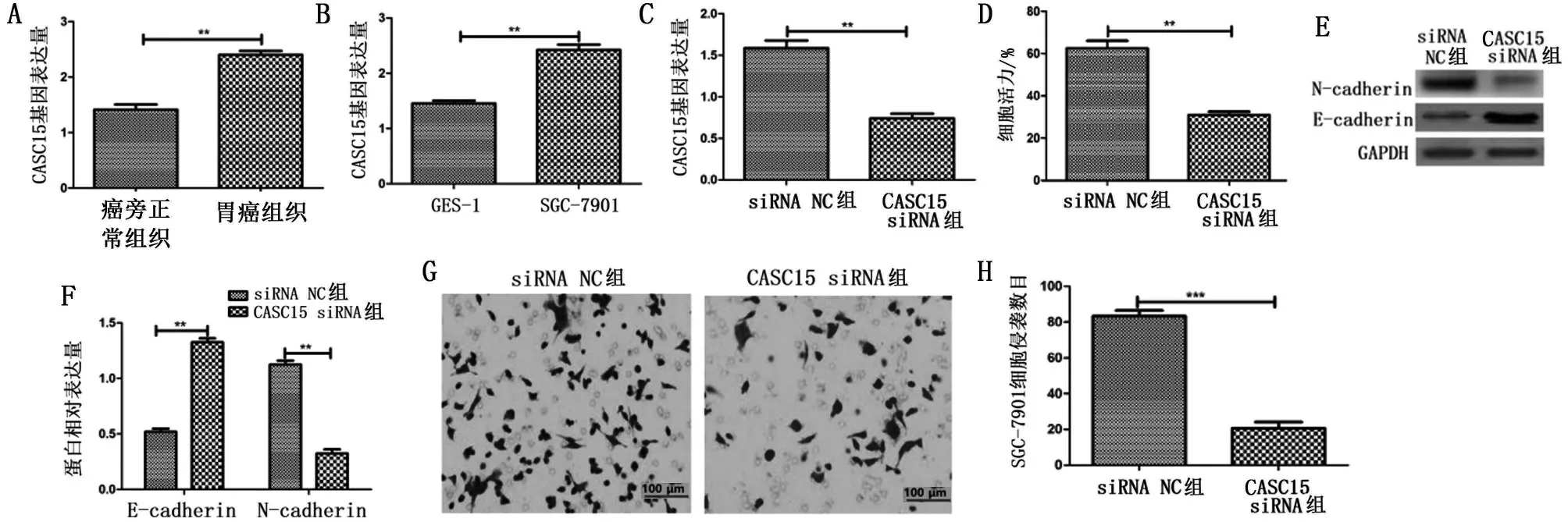
图1 下调CASC15抑制SGC-7901细胞增殖、侵袭及EMT
2.2 LncRNA CASC15 与miR-153-3p之间的靶向关系
利用miRcode 软件预测发现,CASC15 3’UTR和miR-153-3p 存在结合位点(图2A)。双荧光素酶实验进一步验证发现,与mimics NC+CASC15 wt组比较,CASC15 wt+miR-153-3p mimics 组荧光素酶活性降低(P<0.01),与mimics NC+CASC15 mut组比较,CASC15 mut+miR-153-3p mimics组荧光素酶活性无明显变化(P>0.05),见图2B。说明CASC15与miR-153-3p之间具有靶向关系。
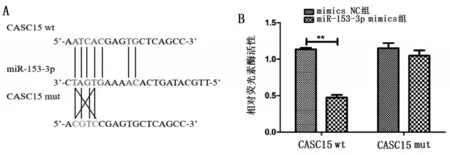
图2 LncRNA CASC15与miR-153-3p的靶向关系
2.3 下调miR-153-3p 促进SGC-7901 细胞的增殖、侵袭及EMT
RT-qPCR 检测结果显示,胃癌组织中miR-153-3p 表达低于癌旁正常组织(P<0.01),见图3A;SGC-7901 细胞中miR-153-3p 表达低于GES-1 细胞(P<0.01,),见图3B。表明miR-153-3p在胃癌组织和细胞中低表达。下调了miR-153-3p 后发现miR-153-3p inhibitor 组细胞内miR-153-3p 表达低于inhibitor NC 组(P<0.01),见图3C。将miR-153-3p inhibitor 及inhibitor NC 转染细胞,并分析了细胞增殖、侵袭和EMT 情况,发现miR-153-3p inhibitor 组细胞活力高于inhibitor NC 组(P<0.05),见图3D;与inhibitor NC 组比较,miR-153-3p inhibitor 组Ecadherin 表达降低(P<0.01),N-cadherin 表达上升(P<0.01),见图3E~图3F。miR-153-3p inhibitor 组细胞侵袭数目增加(P<0.05),见图3G~图3H。说明下调miR-153-3p 促进SGC-7901 细胞增殖、侵袭及EMT。

图3 下调miR-153-3p 促进SGC-7901细胞的增殖、侵袭及EMT
2.4 上 调LncRNA CASC15 通 过miR-153-3p 促 进SGC-7901细胞的增殖、侵袭及EMT
RT-qPCR 检测结果显示,与pcDNA-3.1(+)+mimics NC组比较,pcDNA-CASC15+mimics NC组CASC15表达升高(P<0.01),miR-153-3p表达降低(P<0.01),pcDNA-3.1(+)+miR-153-3p mimics 组miR-153-3p表达升高(P<0.01),CASC15表达降低(P<0.01);与pcDNA-3.1(+)+miR-153-3p mimics 组比较,pcDNA-CASC15+miR-153-3p mimics 组CASC15 表达升高(P<0.01),miR-153-3p 表达降低(P<0.01),见图4A。分析上调LncRNA CASC15通过miR-153-3p 对SGC-7901 细胞增殖、侵袭及EMT的影响,结果表明,pcDNA-CASC15+mimics NC 组SGC-7901细胞活力高于pcDNA-3.1(+)+mimics NC组(P<0.05),pcDNA-3.1(+)+miR-153-3p mimics组细胞活力低于pcDNA-3.1(+)+mimics NC 组(P<0.01),pcDNA-CASC15+miR-153-3p mimics 组细胞活力高于pcDNA-3.1(+)+miR-153-3p mimics 组(P<0.01),见图4B。分析Western blotting 结果可知,与pcDNA-3.1(+)+mimics NC 组比较,pcDNACASC15+mimics NC 组N-cadherin 表达上升(P<0.01),E-cadherin 表达下降(P<0.01),pcDNA-3.1(+)+miR-153-3p mimics 组E-cadherin 表达上升(P<0.01),N-cadherin 表达下降(P<0.01);与pcDNA-3.1(+)+miR-153-3p mimics 组比较,pcDNACASC15+miR-153-3p mimics 组N-cadherin表达上升(P<0.01),E-cadherin 表达下降(P<0.01),见图4C~图4D。此外,Transwell 检测结果表明,pcDNACASC15+mimics NC 组细胞侵袭数目高于pcDNA-3.1(+)+mimics NC 组(P<0.01),pcDNA-3.1(+)+miR-153-3p mimics 组细胞侵袭数目低于pcDNA-3.1(+)+mimics NC 组(P<0.01),pcDNA-CASC15+miR-153-3p mimics 组细胞侵袭数目高于pcDNA-3.1(+)+miR-153-3p mimics 组(P<0.01),见图4E~图4F。

图4 上调LncRNA CASC15通过miR-153-3p促进SGC-7901细胞的增殖、侵袭及EMT
2.5 miR-153-3p与Nrf2的靶向关系
用TargetScan 预测发现miR-153-3p 与Nrf2 3’UTR 存在结合位点,见图5A。后续双荧光素酶实验结果分析可知,与mimics NC+Nrf2 wt 组比较,Nrf2 wt+miR-153-3p mimics 组荧光素酶活性降低(P<0.01);与mimics NC+Nrf2 mut 组比较,Nrf2 mut+miR-153-3p mimics 组荧光素酶活性无明显变化(P>0.05),见图5B。说明miR-153-3p 与Nrf2 具有靶向关系。

图5 miR-153-3p与Nrf2的关系
2.6 下调Nrf2对SGC-7901细胞增殖、侵袭及EMT的影响
RT-qPCR检测结果显示,胃癌组织中Nrf2表达高于癌旁正常组织(P<0.01),见图6A;SGC-7901细胞中Nrf2表达高于GES-1细胞(P<0.01),见图6B。结果表明,Nrf2在胃癌组织和细胞中高表达。通过siRNA技术下调了Nrf2表达,发现Nrf2 siRNA组细胞内Nrf2 表达低于siRNA NC 组(P<0.01),见图6C。分别将Nrf2 siRNA 及siRNA NC 对照转染细胞,进一步分析了细胞增殖、侵袭和EMT,结果表明,Nrf2 siRNA 组细胞活力低于siRNA NC 组(P<0.01),见图6D;与siRNA NC组比较,Nrf2 siRNA组N-cadherin 表达降低(P<0.01),E-cadherin 表达上升(P<0.01),见图6E~图6F。细胞侵袭数目减少(P<0.01),见图6G~图6H。说明下调Nrf2 能够抑制SGC-7901细胞的增殖、侵袭及EMT。

图6 下调Nrf2抑制SGC-7901细胞增殖、侵袭及EMT
2.7 LncRNA CASC15 通过miR-153-3p 上调Nrf2表达
分析CASC15 通过miR-153-3p 对Nrf2 表达的影响,结果显示,CASC15 siRNA+inhibitor NC 组Nrf2 mRNA 和蛋白表达低于siRNA NC+inhibitor NC 组,siRNA NC+miR-153-3p inhibitor 组Nrf2 mRNA 及蛋白表达高于siRNA NC+inhibitor NC 组(P<0.01)。CASC15 siRNA+miR-153-3p inhibitor组Nrf2 mRNA 及蛋白表达低于siRNA NC+miR-153-3p inhibitor组(P<0.01),见图7A~图7C。表明LncRNA CASC15通过miR-153-3p上调Nrf2表达。

图7 LncRNA CASC15通过miR-153-3p上调Nrf2表达
3 讨论
越来越多的证据表明,LncRNA 在人类癌症中发挥着越来越重要的作用[9]。在肿瘤发生过程中,LncRNA 已被报道调控转录或转录后调控过程,以及染色质重塑和亚细胞信号通路[10]。CASC15是一种新发现的LncRNA,LncRNA CASC15的高表达是胃癌预后的危险因素[11]。有文献报道LncRNA CASC15通过调控miR4310/LGR5/Wnt/βcatenin 信号通路促进结肠癌转移[12]。LncRNA CASC15 通过调控miR-221/ARID1A 轴抑制卵巢癌进展[7]。本研究发现,CASC15在胃癌细胞和组织中增加,体外实验也证实了敲低CASC15 抑制胃癌细胞增殖、侵袭和EMT(P<0.05)。由此说明,CASC15可能作为治疗胃癌的一个有价值的预后生物标志物。
大量实验证明了LncRNA 与miRNA 在胃癌中相互影响从而发挥作用。例如,LncRNA PAPAS 通过调控miRNA-188-5p 加重胃癌的进展[13]。在胃癌中,MEG3/miR-21轴通过抑制上皮-间质转化影响细胞流动性[14]。另外还发现LncRNA SNHG16通过miR-135a 发挥致癌基因的作用[15]。为进一步研究LncRNA CASC15 在胃癌肿瘤中发生的深层次机制,通过生物信息学在线工具预测LncRNA CASC15 的下游靶点是miR-153-3p,然后通过荧光素酶报告基因检测进行确认。很明显,LncRNA CASC15 可以作为miR-153-3p 的海绵,且上调LncRNA CASC15 通过miR-153-3p 促进SGC-7901 细胞增殖、侵袭及EMT。另外,发现下调miR-153-3p促进SGC-7901 细胞的增殖、侵袭及EMT。以上论述表明,LncRNA CASC15 通过miR-153-3p 调控胃癌细胞发展。后续进一步研究表明,miR-153-3p靶向且调控Nrf2。越来越多的研究发现,Nrf2的异常表达在肿瘤发展过程中发挥着重要作用。例如,Nrf2 通过调节mRNA 翻译促进胰腺癌的肿瘤维持[16]。NRAL通过miR-340-5p/Nrf2轴介导肝细胞癌顺铂耐药性[17]。实验结果表明,Nrf2 在胃癌组织和细胞中上调,而且siRNA下调Nrf2抑制胃癌细胞增殖、侵袭和EMT,由此说明Nrf2 在胃癌的发病机制中发挥了很重要的作用。
综上所述,CASC15 作为一种致癌基因,通过miR-153-3p/Nrf2轴调控胃癌肿瘤发展。因此,研究CASC15 可能对治疗胃癌有很大的帮助,并成为治疗胃癌的一个潜在新靶点。
——一道江苏高考题的奥秘解读和拓展

