宫颈脱落细胞中人乳头瘤病毒58型感染及整合状况分析
徐 媛,张 放,王 静,杨佳宁,李淑英
(华北理工大学基础医学院,河北省慢性疾病重点实验室,河北唐山 063210)
宫颈癌是全球范围发病率及死亡率位居第9位的恶性肿瘤,每年新发病例约为60.4万,死亡人数约为34.2万[1]。HPV感染与宫颈癌发生有关[2],宫颈癌患者中约90%是HPV 16、18、31、33、35、45、52、58型感染[3]。国外有研究显示,在鳞状上皮内病变和宫颈癌患者中HPV 58阳性率为18.3%[4];我国不同地区HPV 58感染率不同:广西宫颈癌患者中HPV 58感染率为22.8%[5],福建省流行病学调查显示女性中HPV 58阳性率占6.2%[6]。为探讨宫颈脱落细胞中HPV 58感染及整合状况,本研究对所收集的1 269例宫颈脱落细胞用HPV L 1区通用引物MY 09/11进行PCR扩增,检测HPV总感染状况;同时,用HPV 58 E6型特异性引物检测HPV 58感染状况;用荧光定量PCR检测HPV 58 E6、E2及人管家基因β-actin的拷贝数,通过E2与E6比率确定HPV 58整合状态;应用HPV 58癌基因转录扩增方法,分析整合型HPV 58整合在宿主染色体的位置,以便对宫颈病变患者进行早期筛查。
1 材料与方法
1.1 材料
收集2019年1月至12月,于华北理工大学附属医院妇科门诊就诊女性的宫颈脱落细胞标本及其相关病理资料1 269例,就诊患者年龄范围在22~66岁,平均(41.5±5.0)岁。
HPV 58 E2、HPV 58 E6/E7及β-actin质粒,293细胞基因组DNA,Hela宫颈癌细胞基因组DNA在华北理工大学基础医学院病原生物学系科研室均有保存。
1.2 方法
1.2.1 病理细胞学诊断应用离心沉淀式液基薄层制片技术制备标本片后,染色,光学显微镜观察阅片,依据TBS(the 2014 Bethesda system)分级系统进行病理细胞学诊断。
1.2.2 引物设计与合成HPV感染相关疾病细胞中,HPV E6/E7基因保持完整,并整合在宿主细胞染色体,其E2区域基因不稳定,容易成为HPV E6/E7整合入宿主细胞染色体的缺失或断裂部位[7];因此,在设计引物时,根据GenBank提供的HPV 58基因序列,选择HPV 58 E2基因的3个区域,即HPV 58 E2基因起始区2753-2981序列,“绞链区”或“中心区”基因3211-3387序列,接近终点区基因3740-3829序列,应用VectorNTI 11软件设计HPV 58 E2的3对引物,以便真实反映HPV 58缺失或断裂情况,并能准确分析出HPV 58整合状态;同时,应用VectorNTI 11软件设 计HPV 58 E6、P1-HPV 58 E7、P2-HPV 58 E7引物,并合成MY09/11、β-actin、Oligo(dT)17-p3及P3引物(表1)。上述引物由上海生工合成。
1.2.3 标本基因组DNA及总RNA提取应用QIAamp DNA Mini Kit,提取收集标本基因组DNA(按照说明书操作),基因组DNA提取后进行浓度测定,保存于-20℃;用Trizol法提取宫颈脱落细胞总RNA,所提总RNA于-80℃保存。
1.2.4 标本质量检测以人管家基因β-actin作内参引物,每例标本基因组DNA为模板,PCR扩增检测所提标本质量。PCR扩增每个反应总体系为20μL:2×TaqPCR Master Mix,2 pmol/Lβ-actin引物,加入所提标本基因组DNA 0.5μL(浓度100 ng/μL),以无菌双蒸水补足体积至20μL。PCR循环参数:95℃/5 min;95℃/30 s,55℃/30 s,72℃/30 s(31个循环);72℃/5 min;20℃保存。PCR产物经10 g/L琼脂糖凝胶(含有0.01%Gold ViewⅡ型核酸染色)电泳检测。
1.2.5 标本HPV检测HPV L 1区通用引物MY09/11[8]PCR扩增所得产物为包括HPV 16、18、31、33、52、58型等二十多个型别的HPV,可以将其作为HPV总感染状况;用表1中HPV 58 E6引物PCR扩增检测HPV 58感染状况。PCR扩增体系和循环参数同上述标本质量检测程序。
1.2.6 HPV 58病毒载量及整合状态分别将HPV 58 E2、HPV 58 E6/E7及β-actin质粒进行倍比稀释成6个梯度,用其作为标准品,用表1中HPV 58 E2、E6及β-actin引物,用6个梯度标准品及每例HPV 58阳性样品作为模板,分别进行实时荧光定量PCR,平行分析3次,取3次实时荧光定量PCR结果的平均值,计算病毒载量及整合状态;应用(E6copy/β-actincopy)×2计算每例标本病毒载量拷贝数;通过E2/E6的比值,分析HPV 58整合状态。PCR扩增体系和循环参数同上述标本质量检测程序。
1.2.7 HPV 58整合在宿主细胞染色体的位置按照HPV癌基因转录扩增(amplification of papillomavirus oncogene transcripts,APOT)[9]方法,用表1中引物Oligo(d T)17-p3将所提总RNA进行逆转录,得到产物cDNA。然后用HPV 58 E7型特异性引物进行两轮PCR扩增。第一轮:用表1中P1-HPV 58 E7与P3引物,用所得cDNA为模板进行PCR扩增;PCR扩 增 参 数 设 定:95℃/5 min;95℃/1 min,55℃/1 min,72℃/3 min(35个循环);72℃/5 min;4℃保存。第二轮:用表1中P2-HPV 58 E7与(d T)17-P3引物,用第一轮PCR产物作为第二轮PCR扩增的模板进行PCR扩增;PCR扩增参数设定除退火温度改为65℃/1 min外,其他参数均与第一轮PCR扩增参数相同。将第二轮PCR扩增产物经琼脂糖凝胶电泳后,切胶纯化回收所得片段,将回收片段连接到T载体,经克隆筛选后,提取质粒并进行测序,将测序结果在GenBank中进行nucleotide BLAST,分析所得结果,确定HPV 58整合在患者染色体的物理位置。
1.3 统计学分析
建立所得数据Excel数据库,用SPSS 17.0统计软件进行分析。组间比较采用χ2检验,计数资料样本量太小时组间采用非参数检验分析,以P<0.05为差异具有统计学意义;采用Spearman进行相关性分析,以P<0.05为具有统计学意义。
2 结 果
2.1 标本DNA质量的检测结果
用β-actin引物,PCR扩增产物经琼脂糖凝胶电泳结果显示:所有标本基因组DNA经β-actin引物PCR扩增后,都有289 bp PCR产物(图1),说明所有标本基因组DNA可以进行下一步实验。
图1 标本β-actin扩增结果Fig.1 The results ofβ-actin amplification for specimens
2.2 标本中HPV检测结果
经MY 09/11引物扩增后,1 269例宫颈脱落细胞标本中检测到295例有HPV感染(图2),其中有34例为HPV 58阳性(图3)。
图2 标本MY09/11扩增结果Fig.2 The results of my09/11 amplification for specimens
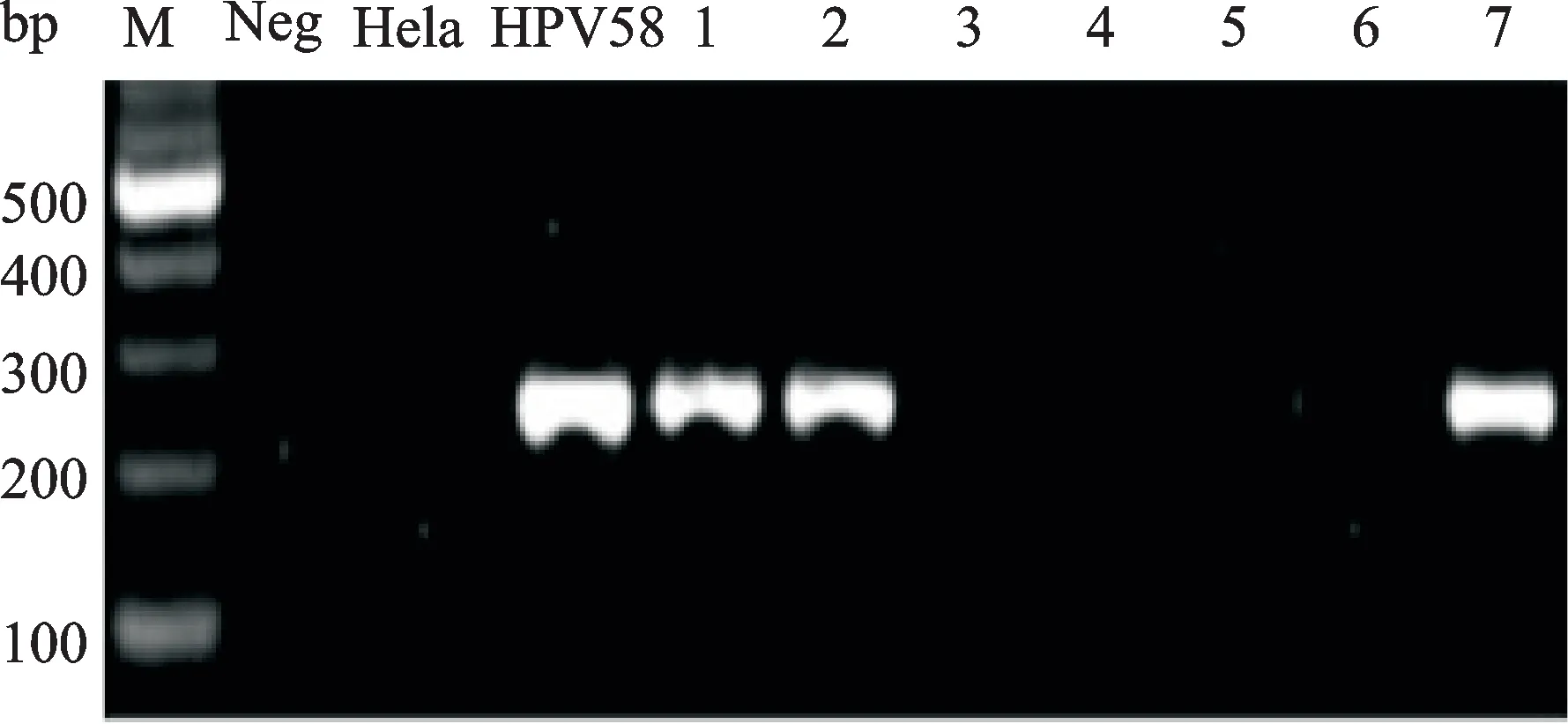
图3 标本HPV 58扩增结果Fig.3 The results of HPV 58 amplification for specimens
2.3 病理细胞学诊断结果与HPV感染的关系
依据TBS分级系统,将所收集1 269例标本进行病理细胞学诊断,结果显示:高度鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)标本128例;低度鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)标本157例;不能排除高级别鳞状上皮内病变(atypical squamous cells-cannot exclyde high-grade squamous intraepithelial lesion,ASCH)标本189例;未明确诊断意义的不典型鳞状上皮细胞(atypical-squamous cells of undetermined significance,ASCUS)标本286例,未见上皮内细胞病变(negative forintraepithelial lesionor malignant lesions,NILM)标本509例。所收集1 269例标本中;检测到295例HPV阳性,其阳性率为23.2%。病理细胞学诊断结果与HPV感染的关系见表2,从表2可以看出,病理细胞学诊断结果中;从NILM至HSIL随病变程度加重,HPV阳性率呈现增高的趋势,差异具有统计学意义(P<0.05)。
2.4 宫颈病变程度与HPV58感染的关系
34例HPV 58阳性标本病理细胞学诊断结果:HSIL标本9例,LSIL标本13例,ASCH标本5例,ASCUS标本7例(表3)。
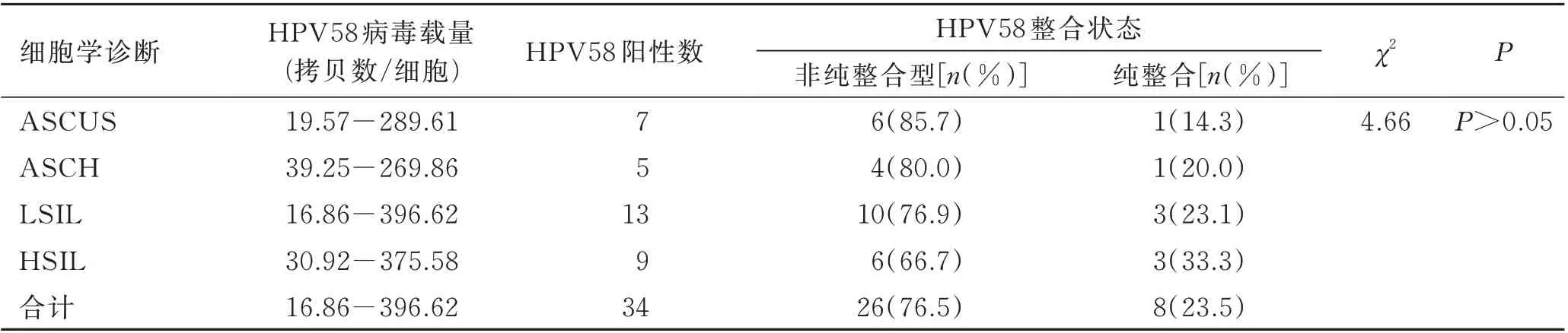
表3 HPV58阳性者病毒载量及整合状态分布情况Tab.3 Distribution of viral load and integration status in HPV 58 positive patients
2.5 HPV 58病毒载量检测结果
将HPV 58 E2、HPV 58 E6/E7、β-actin质粒的6个梯度标准品及每例宫颈脱落细胞标本DNA进行实时荧光定量PCR扩增后,将所得HPV 58 E2、E6及β-actin拷贝数,依据(E6copy/β-actincopy)×2计算出每例样品中HPV 58病毒载量(表2)。Spearman相关分析显示:所收集标本中HPV 58阳性感染者的病毒载量与宫颈病变程度之间无相关性(rs=0.196,P=0.597)。
按照HPV 58 E2与E6比值,确定HPV 58整合状态,结果显示:34例HPV 58阳性标本中,有4例E2/E6=1,为纯游离型;8例标本E2/E6=0,为完全整合型;22例标本中0<E2/E6<1,为整合与游离的混合型。将完全整合型与非完全整合型进行非参数检验分析发现:病理细胞学诊断结果中病变程度与HPV 58整合无相关性(χ2trend=4.66,P>0.05)。但从表2的完全整合型与非完全整合型所占百分比趋势看,随病变程度加重,整合型百分比呈现升高的趋势,非整合型百分比呈现下降的趋势,这可能与完全整合型病例较少有关。
2.6 HPV58整合在宿主染色体的物理位置
将8例HPV 58完全整合型标本进行APOT分析后,将第二轮PCR产物克隆至T载体,经筛选并培养提取质粒,测序,将所得序列结果在GenBank中进行Blast分析,发现8例整合型标本的一部分为HPV 58 E7基因序列,另一部分为人染色体的一部分;HPV 58部分与GenBank提供的HPV 58序(D90400)相比较,其中有5例标本HPV 58 DNA有一处碱基A突变为G(图4),这可能与当地流行株有关;8例整合型标本中有1例整合到宿主1号染色体(图5),2例整合到宿主2号染色体(图6),1例整合到宿主5号染色体(图7),3例整合到宿主8号染色体(图8),1例整合到宿主17号染色体(图9)。

图4 整合型标本扩增产物测序后与HPV58型序列比对结果Fig.4 Alignment sequencing results compared with HPV 58 in GenBank for the integrated specimens

图5 整合型标本1扩增产物测序后与人染色体序列比对结果Fig.5 The sequencing result of integrated specimen 1 compared with the human chromosome sequence

图6 整合型标本2,3扩增产物测序后与人染色体序列比对结果Fig.6 The sequencing results of integrated specimen 2,3 compared with the human chromosome sequence

图7 整合型标本4扩增产物测序后与人染色体序列比对结果Fig.7 The sequencing result of integrated specimen 4 compared with the human chromosome sequence

图8 整合型标本5,6,7扩增产物测序后与人染色体序列比对结果Fig.8 The sequencing results of integrated specimen 5,6,7 compared with the human chromosome sequence

图9 整合型标本8扩增产物测序后与人染色体序列比对结果Fig.9 The sequencing result of integrated specimen 8 compared with the human chromosome sequence
3 讨 论
高危型HPV感染及整合在宫颈病变中起着重要作用,随着宫颈病变的发展,HPV整合样本比例和数量逐渐增加[10]。本研究对1 269例门诊就诊女性宫颈脱落细胞标本分析,结果显示295例HPV阳性,其阳性率为23.2%,病理细胞学诊断结果显示随着患者病变程度的加重,HPV感染率呈现增高的趋势。
KIM等[11]研究显示,HPV 16、18及58型感染的HSIL患者中,随着病变程度的加重,病毒载量及整合状态不断增加,因此,HPV 16、18及58型感染的病毒载量和整合状态可以作为HSIL患者诊断的生物标记;GONZALEZ-LOSA等[12]研究显示,HPV 16及58型感染的宫颈病变患者中HPV E2基因的断裂与宫颈病变程度无关;LONG等[13]研究显示,HPV 16、33及58型感染患者中病毒载量与病变程度有关。这些研究结果表明:高危型HPV感染患者的病毒载量和整合状态作为宫颈病变诊断的标记尚未确定。本研究通过对34例HPV 58阳性标本病毒载量进行Spearman相关分析,结果显示所收集标本中HPV 58阳性感染者的病毒载量与宫颈病变程度之间无相关性(rs=0.196,P=0.597)。通过计算E2/E6比率,进行整合状态分析发现4例为纯游离型,8例为完全整合型,22例为整合与游离的混合型,表明HPV 58感染的宫颈病变患者中,整合型高于游离型,但统计分析显示HPV 58感染型宫颈病变患者中,宫颈病变程度与整合状态无相关性(P>0.05)。8例整合型标本进行定位分析显示,标本1 HPV 58整合到宿主1号染色体,标本2、3感染的HPV 58整合到宿主2号染色体,标本4感染的HPV 58整合到宿主5号染色体,标本5、6、7感染的HPV 58分别整合到宿主8号染色体,标本8感染的HPV 58整合到宿主17号染色体。从这些结果可以看出HPV 58随机整合到宿主细胞染色体中。并且HPV基因组的整合,引起HPV E1或E2区基因断裂,使一些区域DNA片段随整合丢失,使得E6和E7基因与宿主细胞染色体整合,并相互作用,导致宿主细胞对DNA合成修复能力降低,容易出现错误的基因结构,或造成宿主细胞DNA重排,造成宿主基因不稳定,从而向恶性转化[13-15]。

