MPFC-QuEChERS结合GC-MS/MS测定血液中γ-羟基丁酸
李润康,李佳宜,张云峰,董林沛,何洪源,魏春明
(1.公安部物证鉴定中心,北京 100038;2.中国人民公安大学 侦查学院,北京 100038)
γ-羟基丁酸(GHB)是一种存在于多种哺乳动物组织中的内源性短链脂肪酸,对多巴胺能和γ-氨基丁酸(GABA)能系统具有特殊的神经调节作用[1]。羟丁酸钠(GHB的钠盐)可用于治疗由1型发作性睡病引起的日间睡眠亢进、猝倒、睡眠瘫痪、幻觉和夜间睡眠严重紊乱等症状[2]。在一些欧洲国家,羟丁酸钠也用于酒精戒断综合症的治疗和酗酒者的戒酒维持[3-4]。但近年来,我国娱乐场所中出现以GHB作为滥用药物对女性受害者实施性侵犯案件[5],各类毒驾、死亡等案件也常涉及GHB[6-8]。GHB在体内的代谢非常迅速,血中的检测窗口为6 h,但至今仍未发现一种可靠的代谢物可作为人体摄入GHB的生物标志物[9]。因此,通过测定血液中GHB的含量判别供体是否摄入GHB仍然十分必要,但血液成分复杂,存在个体差异,且具有内源浓度干扰而难以获得空白样品,使得常规的方法验证和高效批量的定量测定难以实现。
目前,血液中GHB的检测方法主要有液相色谱-串联质谱法(LC-MS/MS)[10-11]、气相色谱-质谱法(GC-MS)[12]和气相色谱-三重四极杆质谱法(GC-MS/MS)[13]等,定量分析大多采用忽略血液中GHB内源浓度的策略,这在一定程度上对定量结果造成了较大误差。同时,许多方法在前处理过程中未进行样品净化,使得进样液中可能存在大量的干扰物质,导致方法基质效应高、灵敏度低或稳定性差[14]。在众多方法中,LC-MS/MS和GC-MS法的灵敏度较低,检出限仅达到0.1 mg/L或更高,而GC-MS/MS法具有灵敏度高、选择性强、抗干扰能力强等优点,在检测低浓度的血液样品时,可有效防止假阴性结果[15]。
针对上述问题,本研究旨在建立一种基于快速多滤过型净化柱(MPFC)-QuEChERS净化和GCMS/MS的检测血液中GHB的分析方法。针对血液样品中存在内源性GHB而导致的定量不准确问题,通过优化样品前处理条件与仪器条件,采用MPFC-QuEChERS柱净化提取液,能够减少基质中杂质对分析仪器的损害,同时大大降低基质效应,提高方法的准确度和灵敏度。
1 实验部分
1.1 仪器与试剂
GCMS-TQ8050 NX气相色谱-三重四极杆质谱仪(日本Shimadzu公司);DB-5ms色谱柱(30 m×0.25 mm×0.25μm,美国Agilent公司);CUTE MIXER CM-1000型高速振荡器(日本Tokyo Rikakaka公司);Thermo-Fisher Biofuge Primo R型台式高速冷冻离心机(美国Thermo公司);电子温控烘箱(上海美墨尔特贸易有限公司);W880旋蒸浓缩仪(北京吉艾姆科技有限公司)。
1.0 mg/mL的GHB钠盐标准品、内标物GHB-D6钠盐标准品(美国Cerilliant公司),分别用甲醇稀释后得到50、100、250、500、750、1 000 ng/mL的GHB标准溶液与1μg/mL的GHB-D6标准溶液。
衍生化试剂:N,O-双三甲基硅烷基三氟乙酰胺(BSTFA,99%)+三甲基硅烷(TMCS,1%)(上海罗恩试剂公司);甲醇、乙腈、乙酸乙酯、环己烷、二氯甲烷(美国Fisher Scientific公司,色谱纯);叔丁基甲醚、氯化铵、盐酸(分析纯,美国Fisher Scientific公司);QuSEL多功能针式过滤器(MF-3301,天津阿尔塔科技有限公司);m-PFC快速滤过型(高脂类)净化柱、MPFC-QuEChERS净化柱(北京绿绵科技有限公司);实验用水为一级水。血液样品均取自未使用过GHB的健康人。
1.2 仪器条件
色谱条件:Agilent DB-5ms色谱柱(30 m×0.25 mm×0.25μm);升温程序:初始温度60℃,保持2 min,以10℃/min升至260℃,保持2 min;进样口温度为260℃;载气为高纯氦气(99.999%),柱流量:1.56 mL/min;不分流进样模式,进样量:1μL。
质谱条件:电子轰击电离源(EI源),离子源温度为230℃,接口温度为320℃,溶剂延迟时间为2 min,扫描方式为多反应监测(MRM)模式,扫描间隔0.15 s,碰撞气为高纯氩气(99.999%)。
1.3 样品前处理
取0.1 mL全血样品置于15 mL塑料离心管中,加入10μL 1μg/mL的GHB-D6标准溶液,再加入0.5 mL pH 1~2的氯化铵饱和溶液,涡旋混匀后加入3 mL乙酸乙酯,将离心管密封,振荡10 min,以8 000 r/min离心10 min,转移上清液至MPFC-QuEChERS净化柱中。使用推杆缓慢下压净化柱顶部,用尖底玻璃管收集滤液,挥干,加入150μL乙酸乙酯复溶并转移至装有内衬管的进样瓶中,加入10μL衍生化试剂BSTFA密封,将进样瓶放入烘箱80℃反应20 min,冷却后供GC-MS/MS分析。
1.4 内源浓度校正
本文借助Desharnais等[16]开发的内源浓度自动校正工具,对血液样品中内源性的GHB浓度进行校正。
1.4.1工作溶液的配制与测定采用同一份血液样品配制加标浓度为0、50、100、250、500、750、1 000 ng/mL的系列基质匹配标准工作溶液(含100 ng/mL的GHB-D6),在最优前处理和仪器条件下测得系列浓度所对应的分析物与内标物的峰面积比值。
1.4.2内源浓度自动校正工具的使用将上述系列加标浓度与所对应的分析物与内标物峰面积比值数据输入内源浓度自动校正工具,计算得到工作溶液中分析物的实际浓度,采用实际浓度对GHB与GHB-D6的峰面积比值进行线性拟合,得到近似经过零点的工作曲线从而实现内源浓度校正。内源浓度自动校正工具通过开源统计软件RStudio(图形界面,https://www.rstudio.com/)和R(编程环境,https://www.r-project.org/)编写和运行,原版脚本和使用说明参见文献[16]。
2 结果与讨论
2.1 质谱条件的优化
将质量浓度为100 ng/mL的GHB与GHB-D6混合标准溶液按本方法前处理后,在GC-MS/MS的全扫描采集模式下进行检测,获得GHB衍生物(GHB-2TMS)与GHB-D6衍 生 物(GHB-D6-2TMS)的离子碎片和保留时间,选择丰度高且质荷比大的特征离子作为母离子。在5~45 eV的碰撞能量(CE)范围内对母离子进行碰撞解离,选择合适的产物离子作为子离子,组成监测离子对,得到各离子的丰度比并确定最优碰撞能量,最终优化的MRM参数见表1。在优化条件下,测得加标100 ng/mL GHB与GHB-D6的血液样品的MRM色谱图见图1。
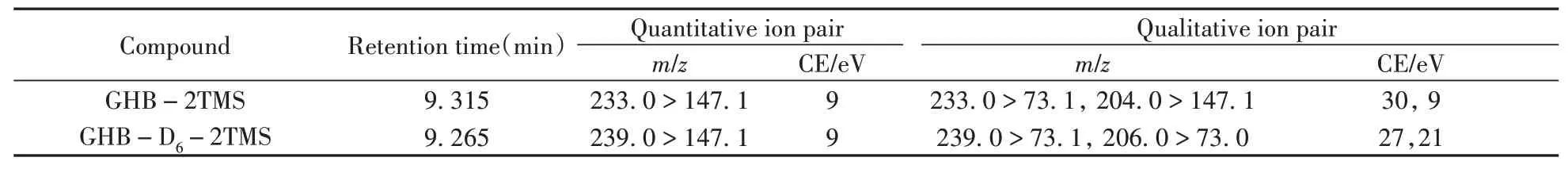
表1 GHB与GHB-D6衍生物的MRM参数Table 1 MRM parameters of GHB and GHB-D6 derivative
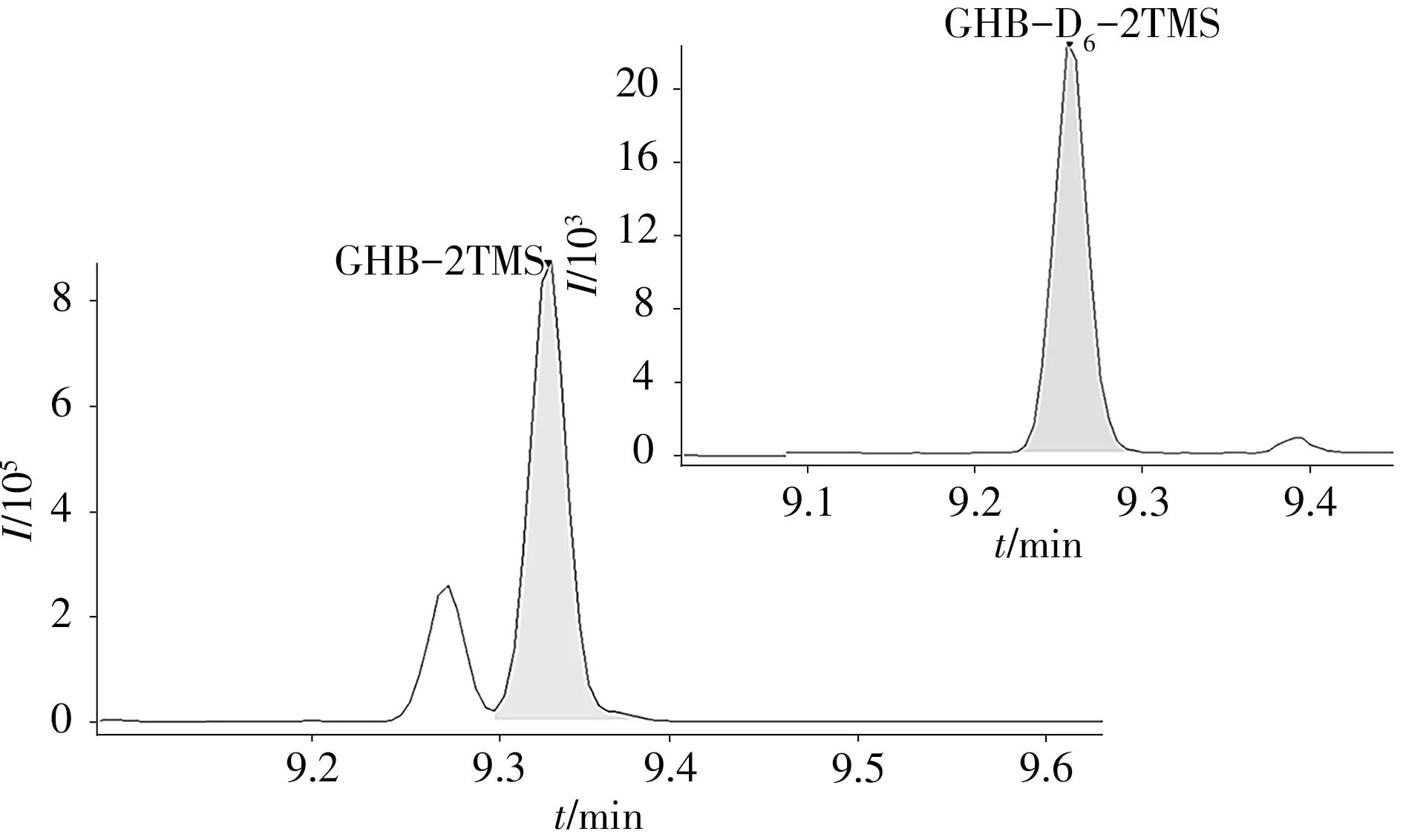
图1 GHB与GHB-D6衍生物的MRM色谱图Fig.1 MRMchromatograms of GHB and GHB-D6 derivative
2.2 前处理方法的优化
2.2.1提取溶剂的优化考察了环己烷、二氯甲烷、乙腈、乙酸乙酯、叔丁基甲醚等常见有机溶剂对GHB的提取效率。结果表明,乙酸乙酯对GHB的提取效率最高(图2A)。由于乙酸乙酯较易挥发,所需挥干时间短,对操作人员健康损害较小,实验选择乙酸乙酯作为提取溶剂。
2.2.2样品溶液pH值的优化GHB的羧酸基团在样品溶液中会发生电离,而酸性环境能有效抑制其电离,同时盐析作用也可促进GHB向有机层转移,因此考察了氯化铵饱和溶液的pH值分别为1~2、2~3、3~4、4~5、5~6、6~7时GHB的提取效率。结果表明,pH值越小,GHB的提取效率越高,pH值为1~2时的提取效率明显高于其他pH值(图2B)。因此,实验选择pH 1~2的氯化铵饱和溶液为缓冲液。
2.2.3衍生化试剂用量的优化衍生化试剂不但会损害色谱柱,而且会增加杂质干扰,大大降低检测灵敏度。因此,考察了衍生化试剂BSTFA用量(1、5、10、15、20、25μL)对GHB提取效率的影响。结果表明,衍生化试剂用量为1μL时不足以衍生化完全;用量为5μL时GHB的峰面积有较大提高,接近峰值;用量为10μL时GHB的峰面积最大(图2C)。可知5μL的衍生化试剂可将大部分GHB衍生化。为保证所用的衍生化试剂过量,同时减少其用量,实验选择衍生化试剂用量为10μL。
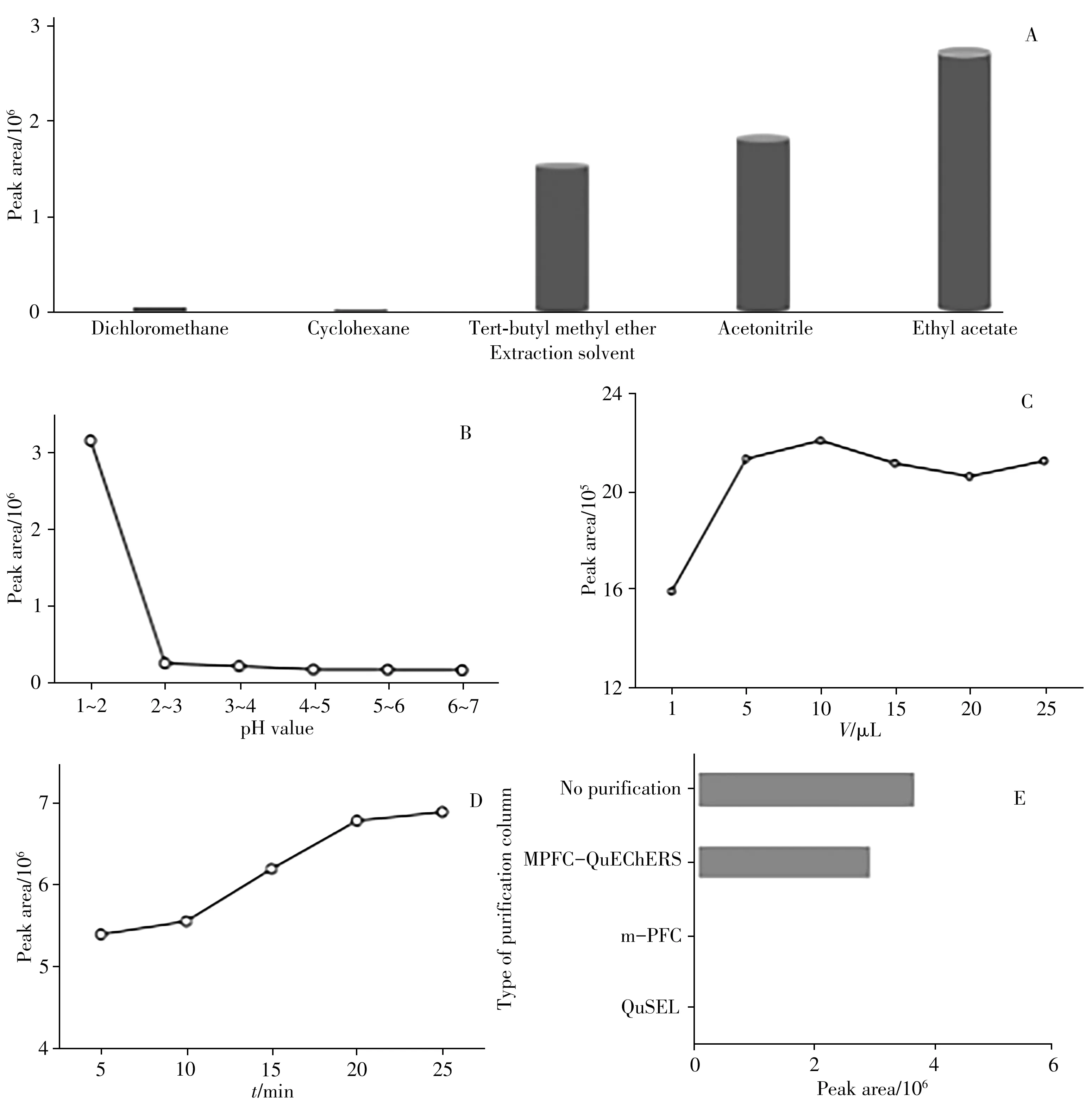
图2 不同前处理条件对GHB提取效率的影响Fig.2 Effect of different preparation conditions on extraction efficiency of GHB
2.2.4衍生化时间的优化考察了衍生化时间(5、10、15、20、25 min)对GHB提取效率的影响。结果表明,提取效率随着衍生化时间的增加而增大,衍生化时间为20 min和25 min时的提取效率相差不明显(图2D)。为节省前处理时间,实验选择衍生化时间为20 min。
2.2.5净化柱的优化实验采用pH 1~2的氯化铵饱和溶液,使得样品溶液的酸性大大增强,导致全血中存在的大量血细胞、蛋白质、色素和脂质等会发生破裂、变性、解离并释放出许多小分子杂质。这些杂质易被有机溶剂提取并残留在样品提取物中,使最终进样液呈浑浊状态,从而导致基质效应增强和仪器检测灵敏度下降,并且需要频繁地进行清洁电离源、更换衬垫等仪器维护。通过使用净化柱可有效去除提取液中的杂质,降低基质干扰,但不同净化柱的净化和提取效果不同。
乙二胺-N-丙基硅烷(PSA)能吸附有机酸、脂肪酸、糖类等,C18主要吸附油脂类物质,MgSO4主要用于除水,多壁碳纳米管(MWCNTs)可有效去除水溶性和脂溶性杂质,本实验采用的特定除脂材料能够选择性吸附基质中的脂质、蛋白质。考察了QuSEL多功能针式过滤器(MF-3301)、m-PFC快速滤过型(高脂类)净化柱、MPFC-QuEChERS净化柱3种市售净化柱的效果,净化材料和用量见表2。提取液经3种净化柱净化后及未净化的提取效率见图2E。结果显示,QuSEL多功能针式过滤器和m-PFC快速滤过型净化柱中均填充了50 mg的PSA,可有效去除提取液中的杂质,但也大量吸附GHB,使提取效率下降。MPFC-QuEChERS净化柱可有效去除杂质,且对GHB的提取效率影响不大,因此实验选择MPFC-QuEChERS净化柱对提取液进行净化。

表2 3种净化柱的净化材料及用量Table 2 Purification materials and dosage of three purification columns
2.3 方法学验证
2.3.1线性关系与检出限为减少血液中内源性GHB的影响,实验筛选GHB内源浓度最小的血液样品用于方法验证。采用所选样品分别配制加标浓度为0、50、100、250、500、750、1 000 ng/mL的系列基质匹配标准工作溶液(含100 ng/mL的GHB-D6),按上述优化的仪器条件进行检测(n=5),以GHB的加标浓度(X,ng/mL)为横坐标,GHB与内标的峰面积比(Y)为纵坐标绘制工作曲线(不过零点)。结果显示,GHB在0~1 000 ng/mL质量浓度范围内线性关系良好,线性方程为Y=0.013 9X+6.293 1,相关系数(r2)为0.995 1。由于难以找出真实的空白血液样品,故通过逐级稀释零样品(加标浓度为0)评估方法的检出限。根据所得零样品的响应比值算得血液样品中GHB的内源浓度(xe)为435.8 ng/mL,而稀释1 000倍后仍能测得较大响应值,考虑到稀释倍数越大,则血液环境越接近纯水,这将导致提取回收率增加,据此估算方法的检出限(LOD)和定量下限(LOQ)分别为0.2、0.5 ng/mL,均远低于血液样品中GHB的内源性浓度。
2.3.2回收率与基质效应评估方法的基质效应与提取回收率时,基质加标和血液加标样品所测得的峰面积须减去零样品的峰面积(内源背景浓度的峰面积)[17]。采用上述选定的血液样品进行加标实验,配制加标浓度水平分别为50、250、750 ng/mL的质控样品及相同浓度水平的GHB标准溶液,在优化条件下按照本方法进行分析(n=3),并按下式分别计算基质效应(ME)和提取回收率(R):ME=(B-D)/A×100%,R=(C-D)/(B-D)×100%。
其中,A表示标准溶液中测得目标物的峰面积,B表示血液样品在前处理后加入标准品测得的峰面积,C表示血液样品在前处理前加入标准品测得的峰面积,D表示零样品在前处理后测得的峰面积。结果显示,GHB的回收率为80.1%~84.7%,基质效应为87.4%~94.4%(见表3)。表明该方法具有较高的准确性,净化步骤大大降低了样品中的基质干扰。
2.3.3相对标准偏差采用本方法对上述质控样品分别重复测定6次,连续测定3 d,以所得日内、日间相对标准偏差(RSD)评价方法的日内和日间精密度。由表3可知,方法的日内、日间RSD均小于15%,表明方法具有较好的稳定性和重现性。

表3 GHB的基质效应、回收率与相对标准偏差Table 3 Matrix effect,recovery and relative standard deviation of GHB
2.4 内源浓度校正与定量
基质中不存在内源性分析物时,其工作曲线(在实验误差限度范围内)应大致经过原点,而当基质中存在内源性分析物时,工作曲线将整体向上平移。曲线平移是由分析物的内源浓度在整个校准浓度范围内产生的恒定响应所致,仪器检测到的分析物响应实际上是内源浓度响应与加标浓度响应之和。因此,内源性分析物工作曲线的y截距(b0)将会大于0。本实验借助内源浓度自动校正工具准确计算出血液样品中GHB的内源浓度(xe)为435.8 ng/mL,并获得加标样品中的实际浓度(校正浓度,xc)。用校正浓度替代加标浓度绘制工作曲线,使原工作曲线发生平移,从而实现内源浓度校正并得到校正线性方程y=0.013 9x+0.226 7(r2=0.995 1)(图3)。内源浓度校正过程极大消除了由血液样品中内源性GHB引入的系统性偏差,利用校正工作曲线可以实现其他实际案例血液样品中GHB的准确定量。

图3 校正前(虚线)和校正后(实线)GHB的工作曲线Fig.3 Calibration curves of GHB before correction(dashed line)and after correction(solid line)
3 结 论
本研究建立了MPFC-QuEChERS结合GC-MS/MS测定血液中GHB的方法。该方法具有成本低廉、绿色环保、选择性强、灵敏度高等优点,MPFCQuEChERS净化柱使整体方法对分析仪器的损耗大大降低,在大样本检测时,降低了清洁离子源、更换色谱柱和衬管等仪器维护次数,提高了批量样品检测的稳定性和精密度。实验所采用的血液样品中存在内源性GHB,表明方法可用于实际案件血液样本中GHB的检测。对于血液样品中存在内源GHB的问题,通过引入内源浓度自动校正工具,利用校正的工作曲线可以准确定量分析物,不受内源含量的干扰并能获得更加可靠的定量结果。内源浓度校正过程通过R脚本自动完成,操作过程简单高效,为实际案件检材中GHB的准确定量提供了一种新方法。

