泡腾辅助液相微萃取/高效液相色谱法检测蜂蜜中7种喹诺酮类药物
王艺霞,杨琳燕,黄 迪,李留安,李 娜,张 伟,
郭永泽2*,李 存1*
(1.天津农学院 动物科学与动物医学学院,天津市农业动物繁育与健康养殖重点实验室,天津 300384;2.天津市农业科学院农业质量标准与检测技术研究所,天津 300381)
作为一类重要的合成抗菌药物[1],喹诺酮类药物(QNs)由于广谱抗菌活性被广泛应用于各种疾病和感染的治疗[2]。然而,不当使用或滥用QNs会在蜂蜜中造成兽药残留,对消费者产生直接的毒性影响,如过敏反应、毒性反应和抗药性。因此,开发高选择性和高灵敏度的动物源性食品中兽药残留的测定方法势在必行[3-4]。目前的仪器方法如高效液相色谱法(HPLC)[5]、毛细管电泳法[6-7]和气相色谱法[8]均能较好满足兽药残留的测定需求,样品前处理技术从而成为制约动物源性食品中残留检测发展的关键[9]。
液相微萃取技术(LPME)集样品采集、萃取、富集等过程于一体,具有操作简便、富集倍数高、成本低等优点,被广泛应用于多个领域的分析检测[4,10-11]。与液-液萃取和固相萃取技术相比,LPME操作简单,降低了有毒有机溶剂的用量[12]。其强大的预浓缩能力和较短的提取时间,不仅为仪器检测提供了高效、准确的基础,也为基质复杂样品的分析提供了一个非常有效的处理方案[13]。
为了克服传统有机溶剂作为萃取剂的不足,新型绿色的可切换溶剂(SS)逐渐被应用于LPME[14],以减少对实验人员及环境的危害。SS是可转换亲水亲油特性的一种特殊液体,在通入或去除CO2的情况下能够可逆地从一种形式切换到另一种形式[15]。它主要包括可切换亲水性溶剂(SHS)和可切换极性溶剂(SPS)。SHS通常由中链脂肪酸和叔胺组成,价格更低,更稳定,且与水的混溶性是完全可逆的,因此SHS较SPS更合适作为提取溶剂。基于SHS的液相微萃取方法具有绿色、快速、简单、廉价、方便等优点[16]。
本文提出了一种注射器内完成的基于可切换亲水性溶剂的泡腾辅助液相微萃取技术(EA-LPMESHS),并以可切换亲水性溶剂壬酸作为萃取剂进行提取及富集。整个萃取过程均在注射器内完成,操作简便、省时,克服了传统LPME中因萃取相过少而分离困难的缺点。并结合高效液相色谱-荧光检测法(HPLC-FLD)实现了蜂蜜中麻保沙星、诺氟沙星等7种喹诺酮类药物的同时测定。
1 实验部分
1.1 试剂与仪器
麻保沙星(MAR,99.0%)、诺氟沙星(NOR,99.0%)、环丙沙星(CIP,92.3%)、洛美沙星(LOM,98.7%)、恩诺沙星(ENR,99.9%)、二氟沙星(DIF,98.0%)、氟甲喹(FLU,99.4%)购于德国Dr.Ehrenstorfer;戊酸、己酸、辛酸、壬酸(纯度大于98%,上海麦克林公司);Na2CO3、H2SO4、NaHCO3、HCl(分析纯,天津风船化学试剂公司);庚酸(98%,上海梯希爱化成工业发展有限公司);乙腈(色谱纯,德国Merck公司)。
Waters e2695高效液相色谱仪、Waters 2475荧光检测器(美国Water公司)。
1.2 色谱条件
色谱柱为Inertsustain C18(4.6 mm×150 mm,5.0μm);流动相:A为0.2%甲酸水溶液,B为乙腈;流速为1.0 mL/min;进样量为10μL;柱温为(30±5)℃。梯度洗脱条件如下:0~10 min,12%~30%B;10~18 min,30%~60%B;18~19 min,60%~90%B;19~22 min,90%B;22~23 min,90%~12%B;23~30 min,12%B。荧光检测器波长设置如下:0~6.6 min,激发波长为297 nm,发射波长为515 nm;6.6~10.5 min,激发波长为280 nm,发射波长为450 nm;10.5~20 min,激发波长为320 nm,发射波长为365 nm。
1.3 标准溶液的配制
分别称取MAR、NOR、CIP、LOM、ENR、DIF、FLU标准品各10 mg,溶于2.0 mL 0.03%NaOH,充分溶解后用甲醇稀释定容至100 mL棕色容量瓶中,配制成100.0 mg/L的标准储备液。使用时以甲醇稀释至所需质量浓度,所有溶液储存于4℃黑暗条件下。
1.4 样品前处理
从天津市当地购买6种不同品牌的蜂蜜样品,用于实际样品检测。
称取2.0 g蜂蜜于50 mL离心管中,添加500 ng/g的QNs,涡旋混匀后加入18 mL 60℃去离子水,涡旋至均一溶液。将所得蜂蜜水溶液(20 mL)于4℃保存,待萃取。
1.5 液相微萃取过程
用移液枪吸取2.0 mL加标蜂蜜水溶液于5.0 mL注射器内,依次加入200μL壬酸和400μL 2.0 mol/L Na2CO3,混合均匀,溶液呈浑浊状态并伴有气泡,继续加入300μL 2.0 mol/L H2SO4,涡旋混匀1.5 min,溶液产生大量气泡。将注射器倒置几分钟,溶液出现分层,上层为萃取相,下层为水相,推动注射器将水相排出,保留萃取相,并用冰醋酸定容至2.0 mL,待HPLC-FLD分析。微萃取过程见图1。
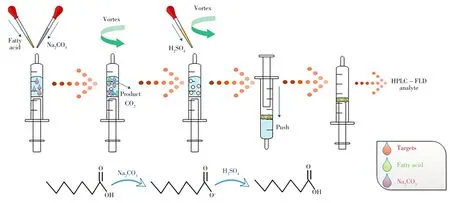
图1 EA-LPME-SHS方法操作过程Fig.1 Procedure of EA-LPME-SHS approach
2 结果与讨论
采用“一次一个变量”的原则,改变相应的实验条件,对含有500 ng/g QNs的空白蜂蜜样品进行分析,以确定最佳提取条件(n=3)。
2.1 萃取剂种类的选择
理想的SHS应满足以下条件:能够通过调节溶液pH值在水混溶状态和水不混溶状态之间可逆切换;对疏水形式分析物的溶解性较强;毒性低,沸点高。考察了满足上述要求的5种中链饱和脂肪酸(戊酸、己酸、庚酸、辛酸、壬酸)作为萃取剂时对目标分析物萃取效率的影响。提取过程中,5种脂肪酸均具有可切换能力,在pH值高于pKa的条件下能解离成亲水形式。结果显示,壬酸的提取效果优于其他4种脂肪酸,尤其是NOR和CIP的提取回收率明显高于其他组(见图2A),这可归因于其较低的粘度和较高的目标分析物溶解度。因此,选择壬酸作为萃取剂。
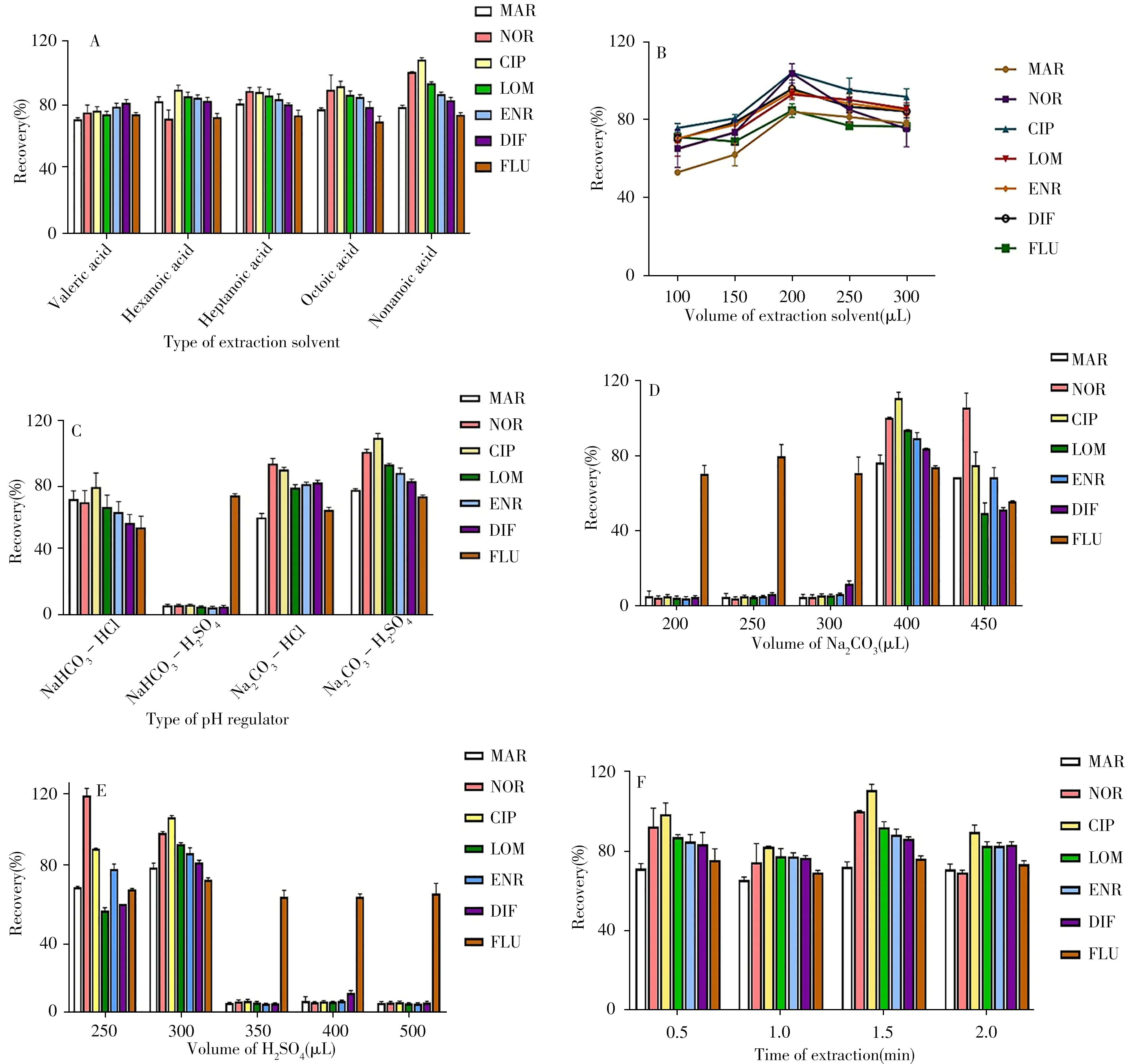
图2 萃取溶剂种类(A)、萃取溶剂体积(B)、pH调节剂类型(C)、Na2CO3体积(D)、H2SO4体积(E)及提取时间(F)的影响Fig.2 Effects of extraction solvent type(A),extraction solvent volume(B),pH regulator type(C),Na2CO3 volume(D),H2SO4 volume(E)and extraction time(F)
2.2 萃取剂体积的优化
萃取剂体积是影响提取回收率的重要参数。向2.0 mL蜂蜜溶液中添加100、150、200、250、300μL的壬酸,考察了萃取剂体积对目标分析物萃取效率的影响。结果表明,当壬酸体积由100μL增至200μL时,7种目标分析物的提取回收率显著提高;而壬酸体积继续增至300μL时,目标分析物的提取回收率呈下降趋势(图2B)。这可能是由于萃取剂过多带来的稀释效应导致回收率降低。最终确定萃取剂体积为200μL。
2.3 pH调节剂类型的选择
根据Shih等[17]报道,当pH值高于其pKa至少3个pH单位时,大约99.9%的脂肪酸会被解离成阴离子形式,并作为一种阴离子表面活性剂存在;相反,当pH值低于其pKa至少3个pH单位时,99.9%以上的脂肪酸呈中性疏水形式。壬酸的pKa为4.96,可通过添加强碱和强酸改变其疏水和亲水性能。此外,二氧化碳的鼓泡有利于增大混合物的接触面积,从而提高回收率。因此,分别选择Na2CO3和NaHCO3作为碱性调节剂,HCl和H2SO4作为酸性调节剂,测定NaHCO3-HCl、NaHCO3-H2SO4、Na2CO3-HCl和Na2CO3-H2SO44种pH调节剂对萃取效率的影响。由图2C可见,Na2CO3-H2SO4和Na2CO3-HCl的提取效果优于NaHCO3-HCl和NaHCO3-H2SO4,这可能是因为Na2CO3的碱性强于NaHCO3,相同用量下,以Na2CO3为碱性调节剂时壬酸的转化率高,对分析物的提取效率更强。而且NaHCO3的鼓泡能力弱于Na2CO3,这也会导致萃取效率降低。与Na2CO3-HCl相比,以Na2CO3-H2SO4为pH调节剂的提取回收率更高。因此,选择Na2CO3和H2SO4分别作为碱性和酸性调节剂。
2.4 pH调节剂体积的优化
在Na2CO3存在下,壬酸可转变为水溶性形式,即转化为阴离子表面活性剂壬酸钠。Na2CO3溶液的加入量越大,壬酸的转化率越高。因此,考察了不同体积(200、250、300、400、450μL)2.0 mol/L Na2CO3溶液对目标分析物萃取效率的影响。结果表明,当2.0 mol/L Na2CO3溶液的添加体积增至400μL时,提取回收率才有明显提高,而添加体积增至450μL时,萃取效率降低(见图2D)。一方面可能是因为Na2CO3添加较少,而H2SO4用量不变,溶液pH值过低,使得弱酸性的QNs解离成离子形式而难于富集,导致回收率降低;另一方面,随着Na2CO3的增加,H2SO4的量不足以使全部壬酸转变为疏水状态,而导致萃取效率降低。因此,选择2.0 mol/L Na2CO3的最佳用量为400μL。
H2SO4的加入可使壬酸转变为原来的疏水性形式,从而实现相分离。考察了不同体积(250、300、350、400、500μL)2.0 mol/L H2SO4溶液对目标分析物萃取效率的影响。结果显示,当2.0 mol/L H2SO4溶液的添加体积从250μL增至300μL时,所有QNs(除NOR外)的萃取回收率明显提高;当添加体积超过300μL时,萃取效率明显下降(图2E)。其原因可能是随着H2SO4体积的增加,溶液pH值逐渐降低,水相中发生解离的QNs无法富集,导致回收率低。因此,选择2.0 mol/LH2SO4的最佳用量为300μL。
2.5 提取时间的优化
涡旋可增强分析物在水相与有机相中的传质作用,加强CO2的鼓泡能力,从而提高萃取效率。考察了不同涡旋时间(0.5、1.0、1.5、2.0 min)对7种QNs萃取回收率的影响。结果显示,当涡旋时间增至1.5 min时,所有QNs的回收率均达到最高;而涡旋时间增至2.0 min时,所有QNs的回收率降低(图2F)。理论上,涡旋时间越长,萃取效率越高,而实验结果显示,随着涡旋时间的增加,一些药物的结构可能被破坏,导致萃取效率降低。因此,选择最佳提取时间为1.5 min。
2.6 方法验证
配制质量浓度分别为2.0、5.0、10、50、100、200μg/L的混合标准工作溶液,采用本方法进行测定,并以7种QNs的峰面积(y)对其质量浓度(x,μg/L)进行线性拟合。结果表明,5种QNs在2.0~200μg/L质量浓度范围内(NOR和CIP为2.0~100μg/L)呈良好线性关系,相关系数(r2)为0.999 5~0.999 9,方法的检出限(LOD,S/N=3)和定量下限(LOQ,S/N=10)分别为3.0 ng/g和10 ng/g(见表1)。

表1 优化条件下7种QNs的线性关系、检出限及定量下限Table 1 Linear relations,LODs and LOQs of seven QNs under the optimal conditions
采用本方法对空白蜂蜜样品进行3个浓度水平(10、100、500 ng/g)的加标回收实验,重复进样3次,连续测定6 d。结果表明,7种QNs的回收率为62.8%~117%,日内、日间相对标准偏差(RSD)均不大于6.2%(见表2)。上述结果表明,该方法的LOD和LOQ较低,具有良好的准确性、重复性和线性。
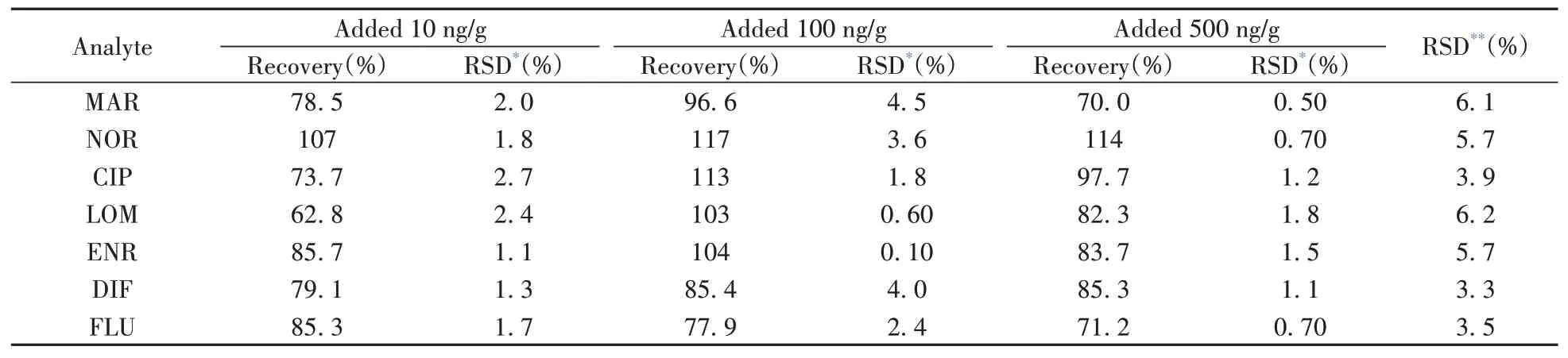
表2 7种QNs的回收率与相对标准偏差Table 2 Recoveries and relative standard deviations of seven QNs
2.7 实际样品检测
为评价方法的适用性,在最佳条件下对6种不同品牌的蜂蜜样品进行检测(n=3),所有蜂蜜样品均未检出上述7种QNs。选择3种蜂蜜样品进行100 ng/g QNs的加标实验,得到7种QNs的回收率为78.8%~120%,RSD小于5.1%。图3分别显示了在优化条件下添加100 ng/g QNs的蜂蜜样品、10 ng/mL QNs标准溶液以及空白蜂蜜样品的色谱图。结果表明,该方法适用性较好,可用于蜂蜜样品中QNs的检测。
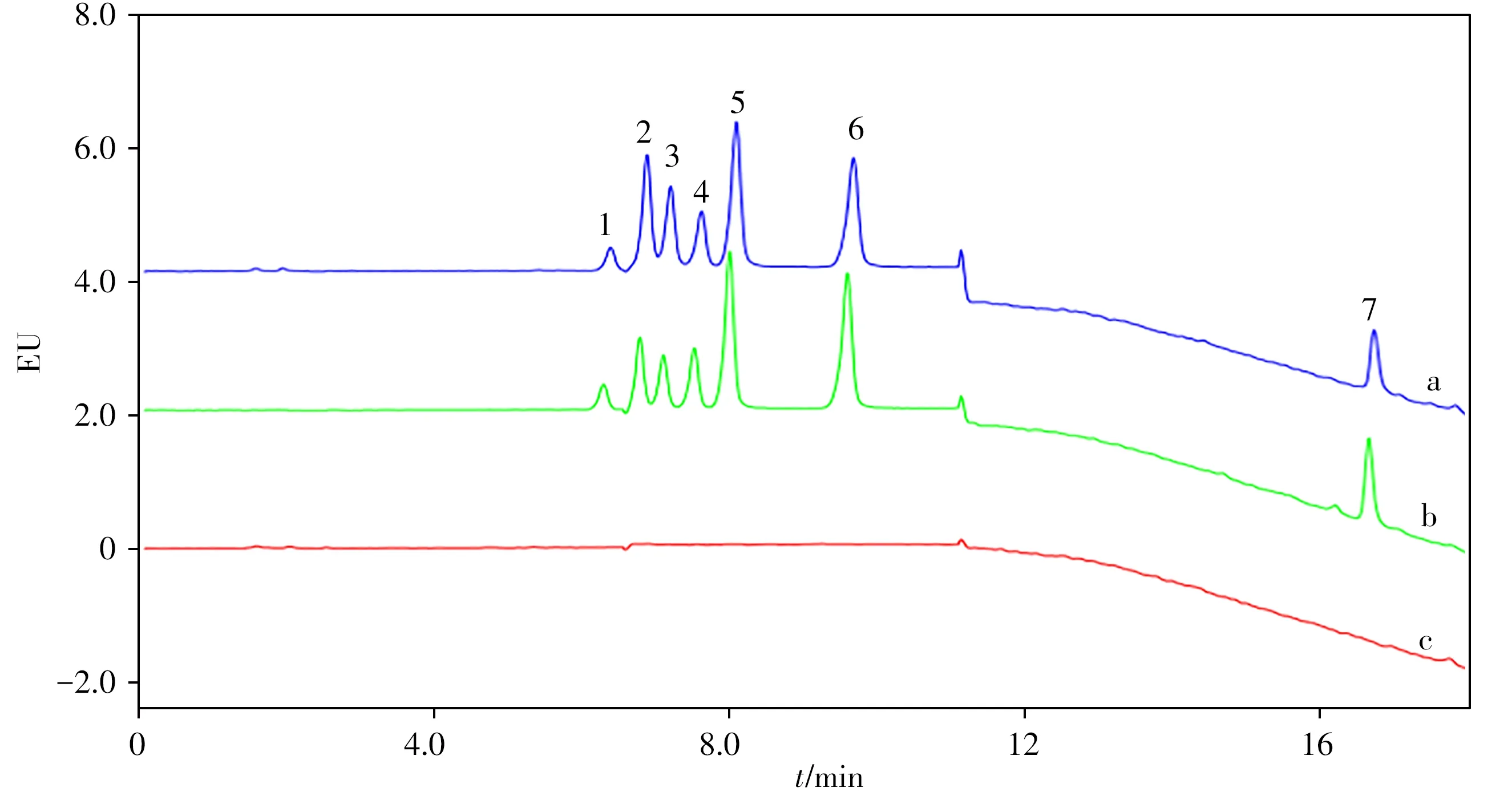
图3 蜂蜜样品添加100 ng/g QNs(a)、10 ng/mL QNs标准溶液(b)与空白蜂蜜样品(c)的色谱图Fig.3 Chromatograms of real honey sample spiked with 100 ng/g QNs(a),10 ng/mL QNs standard solution(b)and blank honey sample(c)
2.8 与其他方法的比较
将EA-LPME-SHS方法与检测QNs的其他文献方法进行了比较(表3)。与其他方法相比,本方法具有萃取剂用量少和提取时间短的优点[5,18-19]。此外,采用可切换亲水性溶剂壬酸为萃取剂,对环境和实验人员友好。该方法是一种绿色、快速、灵敏、简便、省时的前处理方法,可用于蜂蜜样品中QNs的检测。

表3 与其他萃取方法的比较Table 3 Comparison with the previous extraction methods
3 结 论
本文建立了一种基于注射器内的可切换亲水性溶剂-泡腾辅助液相微萃取技术联合高效液相色谱-荧光检测分析蜂蜜中7种喹诺酮类药物的方法。通过调节pH值改变壬酸的亲水性与疏水性,从而对分析物进行提取,整个提取过程均在注射器中完成,无需离心,克服了萃取相少、分离困难的缺点。该方法具有回收率高、灵敏度好、成本低、重复性好、操作方便、提取时间较短和环境友好等优点。

