小麦类钙调素TaCML8-A基因的克隆和表达分析
贾伟哲,焦 博,王 娇,陈文烨,杨 帆,刘永伟,董福双,赵立群,周 硕
(1.河北师范大学 生命科学学院,河北 石家庄 050024;2.河北省农林科学院 生物技术与食品科学研究所,河北省植物转基因中心,河北 石家庄 050051)
Ca2+是一种普遍存在于真核生物中的重要细胞信使,其介导的信号转导途径参与了植物的生长发育以及对各种胁迫的响应[1]。生物胁迫(病原体、病毒等)和非生物胁迫(冷、热、光、干旱等)都会引起细胞质内Ca2+浓度的短暂升高,从而形成钙信号[2]。植物钙调素(Calmodulin,CaM)和类钙调素(Calmodulin-like protein,CML)是重要的钙离子结合蛋白,可感知和响应环境刺激而引起的细胞内Ca2+浓度的变化[3],并激活下游的信号转导通路。目前在拟南芥中发现了7个CaM基因和50个CML基因[4],水稻中有5个CaM基因和32个CML基因[5]。典型的CaM基因高度保守,其本身没有酶的活性,与Ca2+结合后构象变化,和依赖于CaM介导的无活性酶相互作用使其构象进一步发生改变,激活其催化活性[6-7]。CML是一类钙调素钙受体蛋白,与钙调素蛋白的氨基酸相似性大于16%。与含4个EF手型的CaM不同的是,CML含有的EF手型数目1~6个不等,AtCML1含有1个,AtCML12含有6个[7]。
CaM参与了酶活性调节[6]、细胞分裂与分化[8]、光合作用[9]及基因表达等生理过程;在植物盐胁迫(GmCaM4[10])、渗透胁迫(AmCaM1[11])、冷胁迫(AtCaM4[12])、热激(AtCaM3[13]和TaCaM1-2[14])及生物胁迫(GmCaM4[10])等信号通路都有参与。与CaM功能相似,CML对脱落酸(AtCML9[15])、干旱(AtCML10[16]和AtCML20[17])、盐(AtCML18[18])、冷(ShCML44[19])等非生物胁迫与生物胁迫(AtCML9[20]和AtCML42[21])均有响应。目前发现,CML中也存在CaM所没有的信号序列,如CaM不包含任何棕榈酰化或肉豆蔻酰化位点,然而在少数CML中却有发现[22]。CaM和CML基因家族的成员数量差异较大,并且与生物体的基因组大小无关。进化研究表明,CML比CaM进化得更早,更具多样化[22]。
钙调素/类钙调素基因的功能研究在作物物种中研究相对较少。目前小麦中已知10个CaM基因[23]和2个CML基因(TaCML36[24]和TaCML79[25])。本试验从小麦中成功克隆出类钙调素基因TaCML8-A,并研究了其在不同逆境胁迫下的表达特征,旨在为后续研究其生物学功能提供基础理论支撑。
1 材料和方法
1.1 试验材料及处理
供试小麦品种为金禾9123(河北省农林科学院生物技术与食品科学研究所转基因中心实验室保存)。
正常生长14 d后进行胁迫处理:盐胁迫(200 mmol/L NaCl)、渗透胁迫(16.1% PEG 6000)和冷胁迫(4 ℃),分别于0,1,3,6,12,24,48 h取样;热激处理(42 ℃)于0,10,20,30,60,120,180 min分别取样。样品液氮速冻后,-80 ℃保存。
1.2 试验方法
1.2.1 植物总RNA的提取及反转录 参照EasyPure Plant RNA Kit(TRANS)试剂盒使用说明提取小麦总RNA,并根据PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa)反转录试剂盒使用说明将RNA反转录为cDNA,于-20 ℃保存。
1.2.2 引物设计与合成 根据拼接的TaCML8-A基因序列,使用Primer Premier 5.0设计了克隆基因全长的引物和qRT-PCR引物,内参选用小麦18SrRNA,所有引物序列均由生工生物上海有限公司合成(表1)。

表1 引物序列信息Tab.1 Primer sequence information
1.2.3TaCML8-A基因的克隆序列分析 以金禾9123的cDNA为模板,使用TransStart FastPfu Fly DNA Polymerase试剂盒对TaCML8-A基因进行扩增。反应体系为50 μL:cDNA模板2 μL,TaCML8-A-F/R引物各2 μL,FastPfu Ply DNA聚合酶1 μL,5×PCR缓冲液10 μL,PCR Stimulant 10 μL,无核酸酶水23 μL。扩增程序为:95 ℃ 5 min(预变性);95 ℃ 30 s(变性),62 ℃ 30 s(退火),72 ℃ 1 min(延伸),共35个循环;72 ℃ 10 min,4 ℃保存。目的片段回收并与T载体连接,转化大肠杆菌感受态DH5α,利用菌落PCR鉴定阳性克隆并进行测序验证。
1.2.4TaCML8-A基因的生物信息学分析 使用生物信息学软件对小麦TaCML8-A基因进行分析(表2)。

表2 生物信息学分析软件及内容Tab.2 Bioinformatics analysis software and content
1.2.5 融合表达载体构建及亚细胞定位分析 亚细胞定位选用pEGAD载体,该载体存在EcoRⅠ和Hind Ⅲ酶切位点。设计引物TaCML8-A-F-EcoRⅠ和TaCML8-A-R-Hind Ⅲ,扩增目的基因,回收后用EcoRⅠ和Hind Ⅲ进行酶切并回收;而后与经过EcoRⅠ和Hind Ⅲ酶切并回收的pEGAD-35S-EGFP载体片段进行连接,转化大肠杆菌DH5α后进行重组子筛选,将鉴定正确的融合表达载体通过冻融法转化到农杆菌感受态细胞,并利用农杆菌侵染法对烟草叶片叶肉细胞进行瞬时表达,以pEGAD空载体为对照,暗培养2 d后在激光共聚焦显微镜下观察GFP和DAPI的荧光信号。
1.2.6TaCML8-A基因的组织表达分析 根据已得到的TaCML8-A基因为模板,利用TaKaRa SYBR Green qPCR试剂盒进行qRT-PCR反应,检测小麦不同组织及不同胁迫下TaCML8-A基因的表达水平。反应体系为20 μL:cDNA 2.5 μL,上下游引物各0.5 μL,qPCR Master Mix(2×)10 μL,ROX Dye 0.4 μL,去离子水 6.1 μL。反应程序为:95 ℃ 30 s;95 ℃ 5 s,58 ℃ 30 s,72 ℃ 34 s,40个循环;在72 ℃延伸时收集荧光信号。根据扩增曲线计算基因和样本对应的Ct值,逆境胁迫处理0 h的表达量设为“1”,组织特性检测将幼嫩的根中目的基因的表达量设为“1”,相对表达量采用2-ΔΔCt方法计算,每个样品设置3个重复。最后数据用SPSS进行显著性分析,并用Prism 8绘制柱形图。
2 结果与分析
2.1 TaCML8-A基因克隆及序列分析
以小麦cDNA为模板进行扩增,得到一条519 bp左右的序列(图1),将目的条带连接到T载体上,测序结果表明,其核苷酸序列与TaCML8-A基因序列一致。TaCML8-A基因的开放阅读框为519 bp,编码172个氨基酸序列,蛋白质分子质量为18.31 ku,等电点为4.54。包含PTZ00184和FRQ1超家族,含有4个EF-hand结构域(图2),分别位于
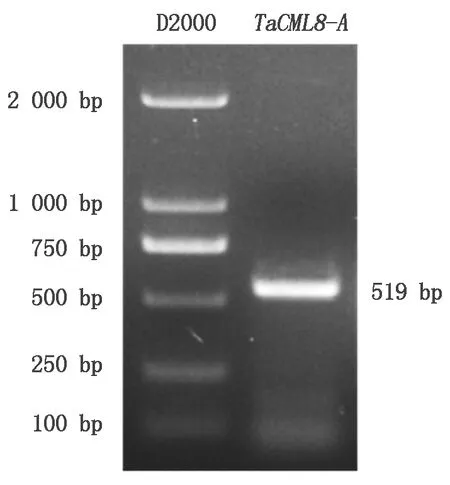
D2000.D2000 DNA Marker;TaCML8-A.TaCML8-A基因的扩增片段。D2000.D2000 DNA Marker;TaCML8-A.Gene amplification of TaCML8-A.
第17—52个,53—87个,94—129个,130—165个氨基酸,其中包含4个钙离子结合位点,分别位于第29—41个,66—77个,107—118个,141—155个氨基酸(图3)。
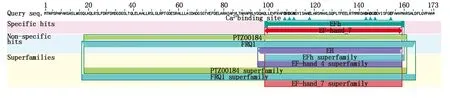
图2 预测的TaCML8-A蛋白保守结构域Fig.2 Predicted conserved domain of TaCML8-A protein

横线为EF手型结构域;虚线为Ca2+结合结构域。The horizontal line is EF-hand domain;The dotted line is the Ca2+ binding domain.
2.2 TaCML8-A蛋白的生物信息学分析
利用NCBI选取了与TaCML8-A基因同源的5个物种的氨基酸序列进行比对,这5个同源的物种分别为野生稻(Oryzabrachyantha)(OB05G34390)、水稻(Oryzasativa)(OsCML14:Os05g0577500)、短柄草(Brachypodiumsylvaticum)(BrADI_2g15570v3)、拟南芥(Arabidopsisthaliana)(AtCML15:AT1G18530)和小麦(Triticumaestivum)(TaCML8-B:TraesCS3A02G446400、TaCML9-A:TraesCS3A02G216300)。结果显示(图3),TaCML8-A与TaCML8-B亲缘关系最近,为98.26%;与水稻OsCML14和野生稻OB05G34390相似性分别为79.17%和78.11%;与短柄草BrADI_2g15570v3相似性为77.19%;与小麦TaCML9-A相似性为60.47%;与拟南芥AtCML15相似性为60.26%。
将TaCML8-A的氨基酸序列与来自小麦、玉米、水稻、野生稻、短柄草、黄瓜、烟草和拟南芥的氨基酸序列进行系统进化树分析,结果显示(图4),TaCML8-A与已报道的水稻OsCML14和短柄草BrADI_2g15570v3亲缘关系较近,同属CML家族,表明TaCML8-A可能具有植物类钙调素基因的生物学功能。
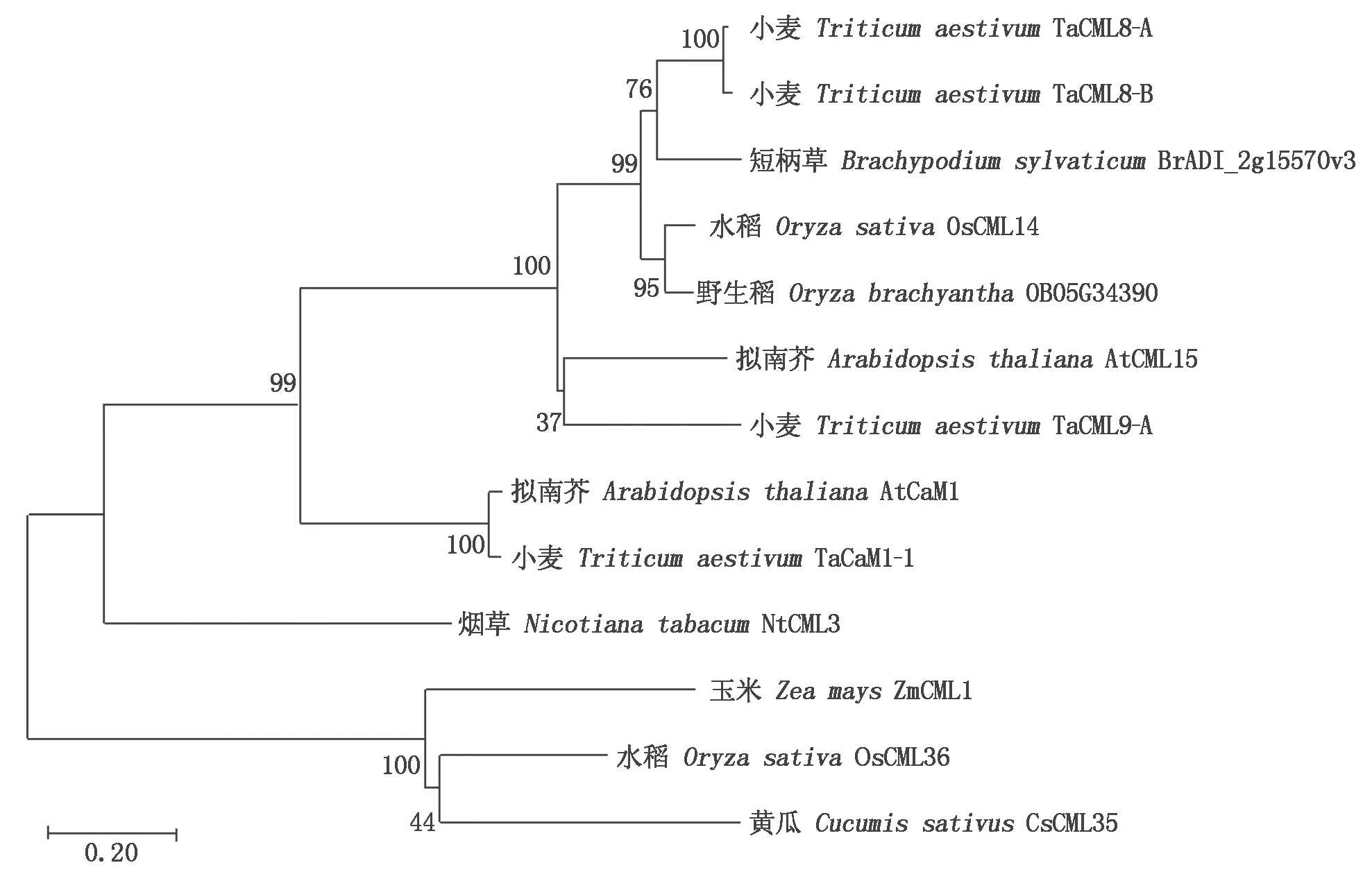
图4 8种植物的CaM/CML蛋白系统进化树分析Fig.4 Phylogenetic tree of CaM/CML proteins in 8 plants
2.3 TaCML8-A蛋白的亚细胞定位
构建了GFP-TaCML8-A的亚细胞定位载体,并利用农杆菌侵染烟草叶片的方法,在激光共聚焦显微镜下观察到TaCML8-A蛋白在细胞核、细胞膜中均有表达(图5)。
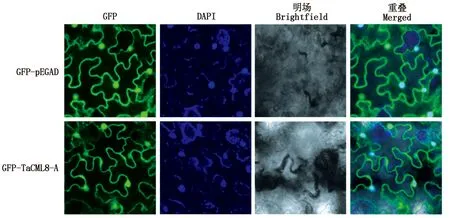
图5 TaCML8-A蛋白在烟草叶肉细胞的亚细胞定位Fig.5 Subcellular localization of TaCML8-A protein in tobacco mesophyll cells
2.4 TaCML8-A基因组织表达分析
为了研究TaCML8-A的组织表达特异性,分别选取小麦幼嫩的根和地上部分以及成熟的根、茎、叶、花和种子进行定量PCR分析,结果显示,TaCML8-A基因在小麦幼嫩的根、幼嫩的地上部分和成熟的根、茎、叶和花中均有表达,但表达丰度不同;在种子和花中几乎不表达(图6)。以在幼嫩根中的表达量为“1”,TaCML8-A基因在成熟根中表达水平显著高于其他组织,其表达量是幼嫩根中的1.144倍,在幼嫩的地上部分、成熟的茎和叶中的表达量依次为在幼嫩根中表达量的20.4%,1.6%,12.6%。
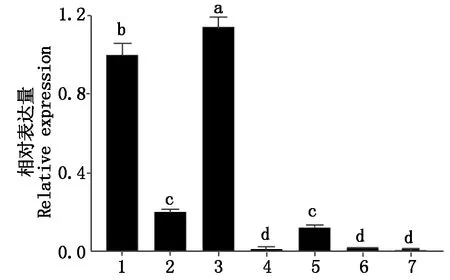
1.幼嫩根;2.幼嫩的地上部分;3.成熟根;4.成熟茎;5.成熟叶;6.成熟花;7.种子。不同小写字母表示差异显著(P <0.05)。图7同。
2.5 TaCML8-A基因的表达特性
为了研究TaCML8-A是否参与植物应对非生物胁迫,将长至三叶期的小麦分别置于盐(NaCl)、渗透(PEG)、冷(4 ℃)胁迫处理0,1,3,6,12,24,48 h,热激处理0,10,20,30,60,120,180 min,对TaCML8-A进行表达分析,结果如图7所示。NaCl处理时,TaCML8-A基因在根和地上部分的表达量变化趋势相似,均为1 h表达量达到最高,随后下降,24 h又有所上升,后下降。在根中表达量最高时上升约为5倍,而在地上部分上升约为75倍。

图7 TaCML8-A基因在各种胁迫下的相对表达Fig.7 Relative expression of TaCML8-A gene in abiotic stresses
渗透处理时,TaCML8-A基因在根中的表达量变化较明显,1 h表达量达到最高,上升约5.5倍,而后下降;在地上部分中的表达量1 h上升约24倍,而后下降,12 h又上升,随后下降至初始水平。
冷处理时,TaCML8-A基因在根中的表达量1 h上升约8倍,而后下降,6 h又有所上升,24 h开始下降;在地上部分中的表达量1 h显著上升约160倍,随后下降,6 h上升约120倍,而后下降,24 h上升约20倍,随后下降。
热激处理时,TaCML8-A基因在根中的表达量受到诱导,10 min上升约8倍,随后下降;而在地上部分中的表达量受到明显的抑制,10 min下降约3倍,随后的不同时间点表达变化不大。
3 结论与讨论
CML对盐、干旱等非生物胁迫均表现出一定敏感性。拟南芥AtCML18参与盐胁迫信号的转导[18];AtCML24能正向调节植物对脱落酸的反应,而负向调节植物对离子胁迫的抗性[26];AtCML10能通过调节抗坏血酸的合成,调节植物抵抗干旱、臭氧和紫外线的应激反应[27]。AtCML20可能作为植物体内的Ca2+信号响应蛋白,参与调控气孔运动与植物抗干旱过程[17]。水稻OsCML4[28]和OsCML31[5]均正调节了植物的耐旱性。番茄ShCML44过表达植株对寒冷、干旱和盐碱胁迫均表现出明显的耐受性,并且发芽率高,幼苗生长好[19]。
本研究从小麦中成功克隆出类钙调素基因TaCML8-A。通过生物信息学分析得知,TaCML8-A基因CDS区全长为519 bp,编码172个氨基酸,含有4个EF-hand结构域,其中包含4个钙离子结合位点。氨基酸序列比对和系统进化树分析发现,TaCML8-A基因与水稻OsCML14蛋白的同源性高于其他物种。亚细胞定位显示,TaCML8-A蛋白质在细胞核和细胞膜中均有分布。qRT-PCR结果显示,TaCML8-A基因在小麦的不同组织中均有表达,且在成熟的根中表达量最高。在受到盐、渗透、冷和热胁迫处理后的TaCML8-A基因表达量变化不同,结果显示,在NaCl、渗透和冷胁迫处理中,TaCML8-A基因在地上部分和根中的表达均上升,3 h下降,且在地上部分的表达量上升幅度远大于根中,表明植物可能通过提高TaCML8-A基因的表达来响应盐、渗透和冷胁迫,待适应逆境后,TaCML8-A基因的表达下降;热激时TaCML8-A基因在根和地上部分分别受到诱导和抑制,从而发挥不同的功能。本研究中,TaCML8-A的表达受到盐、渗透、冷和热胁迫的诱导或抑制,说明该基因可能参与调控植物的非生物胁迫,为随后研究其生物学功能提供了坚实的基础理论支撑。

