低氧条件下FGFR2在牦牛肺动脉平滑肌细胞中的表达
陈树吾,姚一凡,张 兰,刘翊中,钟 文,乔自林,杨 琨*
(1.西北民族大学 生命科学与工程学院,甘肃 兰州 730030;2.西北民族大学 生物医学研究中心 甘肃省动物细胞技术创新中心,甘肃 兰州 730030;3.西北民族大学 生物医学研究中心 生物工程与技术国家民委重点实验室,甘肃 兰州 730030)
缺氧是诱发低氧性肺动脉高压(HPH)最重要的病理因素,HPH主要发病环节为低氧性肺血管收缩反应(HPV)和低氧性肺血管重塑(HPVR)[1-2]。肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)的迁移和增殖可能会导致肺动脉血管重塑[3]。
牦牛一般生活在海拔3 000~5 000 m的区域。作为高原地区特有的牛种,牦牛肺脏微动脉中膜肌层厚度与血管直径比例较小,肺动脉的构造不仅能促进气体交换,还能预防肺动脉高压[4]。
成纤维细胞生长因子受体2(Fibroblast growth factor receptors 2,FGFR2)是调节细胞生长和分化的重要分子和受体[5]。研究表明,在缺氧条件下,FGFR2会促进细胞的迁移和侵袭[6],但截至目前,低氧引起FGFR2表达升高的信号通路还不是很清楚。本研究探讨低氧条件PAMSCs对FGFR2表达的影响。
1 材料与方法
1.1 主要材料
DMEM/F12、磷酸缓冲盐溶液(PBS)、0.25%胰蛋白酶溶液(兰州百灵生物技术有限公司)、胎牛血清(gibco)、细胞培养瓶(Corning)、EVO M-MLV反转录试剂盒(湖南艾科瑞生物工程有限公司)、TRIzolTMReagent(Thermo),2×Universal SYBR Green Fast qPCR Mix(ABclonal)。
1.2 方法
1.2.1 细胞培养 本试验所选取的牦牛PASMCs是本课题组前期所分离并培养。将PASMCs从液氮中取出,放置于37 ℃温水中快速摇晃直至完全融化,牦牛PASMCs在含有15%胎牛血清的DMEM/F12完全培养基中,在37 ℃、5%CO2的恒温培养箱中培养,完全贴壁后,转移到37 ℃、1%O2、5%CO2低氧培养箱中培养,并开始计时。
1.2.2 细胞总RNA的提取 在低氧条件下培养6 h、12 h、24 h、48 h、60 h后,迅速弃掉细胞培养液,用PBS冲洗3遍,吸去参与PBS。加入2 ml TRIzol试剂,反复在细胞瓶中吹打,室温放置5 min以彻底解离蛋白复合体。将混合物装入2个无菌无RNA酶的1.5 ml PE管中,加入200 μl氯仿使其与TRIzol混匀,用力摇晃20 s,室温静置5 min,12 000×g,4 ℃ 离心,10 min,吸取上层水相到新的无菌无RNA酶PE管中,加入500 μl 100%异丙醇到水相中,室温放置10 min用来沉淀RNA。12 000×g,4℃离心,5 min,弃沉淀,用DEPC水配制的1 ml 75%乙醇冲洗RNA沉淀。将乙醇中的RNA 7 500×g,4℃离心,5 min,然后吸去乙醇,室温干燥RNA沉淀5~8 min。加入30~40 μl DEPC水溶解彻底RNA沉淀。用2 μl RNA测量所提RNA样品A260/A280的OD值。
1.2.3 RNA样品反转录 去除gDNA反应体系如表1所示。将样品振荡混匀后离心,再放入PCR仪中42 ℃ 2 min进行基因组DNA去除反应,然后低温放置加入反转录试剂。反转录反应过程如表2所示,混匀离心后将样品在PCR仪中37 ℃ 15 min,85 ℃ 5 s进行变性、退火反应,程序结束后将样品存放于-20 ℃保存。

表1 去除gDNA反应体系

表2 反转录反应过程
1.2.4 Real Time PCR 利用Primer-BLAST根据目的基因FGFR2 Gene ID:102270743和ACTB Gene ID:102286048 设计所需要的引物(表3),并在湖南艾科瑞生物工程有限公司合成。

表3 引物序列信息
利用ABclonal的2×Universal SYBR Green Fast qPCR Mix实时荧光定量对目的基因进行检测。反应体系见表4,反应条件见表5。在Applied Biosystems 7500荧光定量PCR仪中进行RT-qPCR反应,数值均用内参ACTB进行标准化。RT-qPCR结果采用2-ΔΔCt运算方法进行分析。利用GraphPad Prism 8分析目的基因的差异性。

表4 荧光定量PCR反应体系

表5 荧光定量PCR反应条件
2 结果与分析
2.1 牦牛肺动脉平滑肌细胞的复苏与培养
将细胞培养48 h后置于显微镜下观察,细胞形态清晰,生长状态良好,可用于后续试验(图1)。

图1 细胞培养结果
2.2 提取总RNA的纯度分析
将提取的RNA进行纯度分析,所有样品OD值均在1.8~2.0之间,可用于后续试验(表6)。

表6 样品纯度检测
2.3 不同低氧时间PASMCs中FGFR2基因表达量分析
由图2和图3可知,扩增反应结束后,ACTB和FGFR2基因的扩增曲线在不同低氧时间PASMCs中均呈现完好的“S”形,斜率较高,拐点清晰,未出现杂乱条带;溶解曲线均呈单峰,且Tm值附近无明显杂峰,各样本峰值接近,无杂乱带,无引物二聚体,符合试验要求。

图2 ACTB基因的扩增曲线与溶解曲线

图3 FGFR2基因的扩增曲线与溶解曲线

图3 (续)
在不同低氧时间PASMCs中FGFR2的mRNA相对表达量在不同时间段有显著变化(P<0.01)。由图4可知,FGFR2在常氧、低氧不同时间点6 h、12 h、24 h、48 h、60 h均有表达,在低氧6 h、12 h与常氧无明显差别,24 h后FGFR2表达量开始增长,到48 h达到最高,60 h开始有所下降。
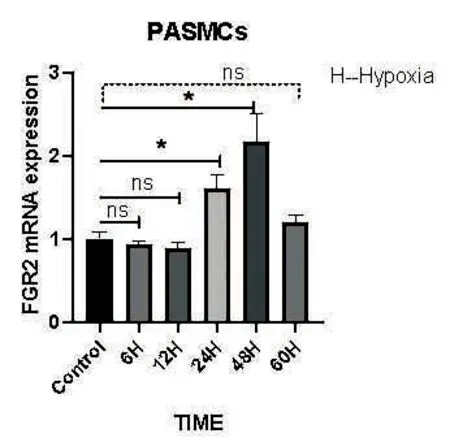
图4 不同低氧时间PASMCs中FGFR2基因的表达情况
3 分析讨论
肺动脉高压(PAH)最重要的病理因素是缺氧,它能引起许多内源性细胞因子和活性物质的异常释放,导致血管收缩和平滑肌细胞增殖[7]。缺氧明显促进PASMCs增殖,慢性缺氧通过增强PASMC的增殖和收缩能力以及细胞内Ca2+([Ca2+]i)水平来提高pH值[8]。
牦牛的肺在构造上和低海拔动物的肺不同。牦牛肺的血-空气屏障比低海拔动物要薄,可促进气体交换中氧的扩散[9]。以牦牛为突破口来研究低氧条件对肺动脉平滑肌的影响具有重要意义。本试验通过对牦牛肺动脉平滑肌细胞进行不同时间低氧培养,观察FGFR2基因表达情况,结果发现在低氧条件下,随着时间的增长,FGFR2 mRNA表达量逐渐增加。这说明PAMSC在低氧情况下是FGFR2产生的一个重要来源。同时,低氧刺激FGFR2表达增加可能是通过FGFR2基因转录的调控达到的。成纤维细胞生长因子一族具有调节细胞增殖和分化功能的活性多肽,它们在肿瘤发生与转移、创伤愈合等病理情况下具有重要意义。有研究表明,慢性低氧时,FGFR2参与了肺血管收缩及血管结构重构[10]。
4 结论
试验发现,FGFR2基因在牦牛肺动脉平滑肌细胞低氧培养中随着时间的增长,其表达量呈递增趋势。与相关文献结合进行分析,FGFR2基因在牦牛肺动脉平滑肌细胞低氧适应过程中起着重要作用,未来有望成为抗低氧环境的相关基因,但其作用的具体分子机制尚不明,有待进一步研究。

