纤维小体在合成生物学中的应用研究进展
冯银刚,刘亚君,崔球
(1 中国科学院青岛生物能源与过程研究所,中国科学院生物燃料重点实验室,山东省合成生物学重点实验室,山东 青岛266101; 2 中国科学院青岛生物能源与过程研究所,山东省单细胞油脂工程实验室,青岛市单细胞油脂工程实验室,山东 青岛266101; 3 中国科学院大学,北京100049)

合成生物学的一个基本思想是通过功能元件及操作步骤的模块化和标准化实现功能的高效组合和通量化。自然界中,许多分子机器都在不同程度上符合合成生物学模块化和标准化的要求,因而在合成生物学中具有巨大的应用价值和潜力,其中纤维小体(cellulosome)可能是自然界中最符合合成生物学策略的分子机器之一。纤维小体是一类由降解纤维素的微生物分泌的多酶复合体,目前已知的产纤维小体微生物主要是梭菌纲的一些厌氧细菌。纤维小体的种类复杂多样,不同物种产生的纤维小体其大小、架构、酶的种类千差万别,反映了不同微生物适应复杂生长环境的进化多样性。由于具有模块化、多样化、自组装、协同高效以及底物自适应等特点,纤维小体自被发现以来在生物技术中得到了广泛的应用,被称为“生物技术的宝库”[1-3]。纤维小体的模块化自组装特性尤其符合合成生物学对元件模块化、标准化的要求,随着合成生物学的发展,纤维小体在合成生物技术中也受到越来越多的关注。
纤维小体的发现至今已有近40 年的历史。20 世纪80 年代初,科学家在研究一种可高效降解纤维素的细菌--热纤梭菌时,发现了一些可结合于纤维素上的蛋白质[4-5]。这些蛋白质最初被命名为纤维素结合因子,后来发现它们是一种蛋白质复合体的组分,于是将这个蛋白质复合体命名为纤维小体[6-7]。经过20 世纪80 年代到90 年代初10 年左右的研究,人们已经明确纤维小体是由具有不同催化活性的多种酶亚基组装在无催化活性的脚架蛋白(scaffoldin)亚基上所形成的复合体[8]。随着分子克隆技术的成熟,许多纤维小体组分的基因序列被测定,到90 年代末,人们借助于结构生物学研究的进展,对纤维小体的架构已经有了比较清晰的认识[9]。在2000-2010 年间,通过对热纤梭菌和多种产纤维小体细菌的基因组测序和序列分析,发现了数目巨大的纤维小体组分,使人们对纤维小体的高度复杂性及多样性有了进一步的认识[10-11]。同时,不同来源的纤维小体的组装模块复合体结构被逐步解析,对纤维小体结构的认识程度提升到了原子水平[12]。在最近的10年间,随着复杂纤维小体调控因子σI/anti-σI和简单纤维小体转录后调控机制的发现,人们对纤维小体合成的复杂调控机制的研究也逐步深入到分子层面[13-15]。伴随着理论与机制研究的逐步深入,纤维小体的应用价值被逐步发掘和拓展,渗透延伸到包括合成生物技术在内的各种生物技术应用中。
早在90 年代初,基于纤维小体架构带来的启示,研究者就提出了人工纤维小体(designer cellulosome)的概念,这一概念在随后的合成生物学研究中得到了大量应用。人工纤维小体也逐步扩展和演化出仿纤维小体(artificial cellulosome)、电子小体(electrosome)等概念,并应用于木质纤维素生物转化、生物燃料生产、合成代谢通路、表面展示、酶固定化、生物传感器开发以及生物燃料电池构建等诸多领域。本文将在简单介绍纤维小体的架构和功能机制的基础上,总结近年来纤维小体在合成生物学中的应用进展,并对未来纤维小体的研究及其在合成生物学中的应用进行展望。
1 纤维小体的架构与功能机制
纤维小体包含由多种类型的酶类(主要是糖苷水解酶)组成的催化亚基,以及主要起组装作用的非催化亚基。非催化亚基起到了类似于建筑中脚手架的作用, 因此被称为脚架蛋白(scaffoldin,也译为脚手架蛋白或支架蛋白)。这些纤维小体亚基由多种模块(即结构域)构成,可以大致分为催化模块、组装模块、底物结合模块以及细胞结合模块4类。通常情况下,脚架蛋白由多个被称为粘连模块(cohesin)的组装模块串联而成,催化亚基则是由催化模块和一个被称为对接模块(dockerin)的组装模块串联而成。粘连模块和对接模块之间通过非常强的非共价相互作用将多个酶亚基组装到脚架蛋白上,其相互作用的KA可以达到109~1012L/mol,是自然界中最强的蛋白-蛋白相互作用之一[16-17]。底物结合模块通常为碳水化合物结合模块(carbohydrate-binding module,CBM),能够帮助纤维小体紧密结合在木质纤维素底物上。CBM 可以位于脚架蛋白上与粘连模块串联,也可以位于一些催化亚基上与催化模块串联。细胞结合模块是可以结合在细胞壁上的结构域,通常为S 层同源物模块(S-layer homology,SLH),位于部分二级脚架蛋白上,这些脚架蛋白也被称为锚定脚架蛋白 (anchoring scaffoldin)。细胞通过在脚架蛋白上组装不同的催化亚基,形成适应外界木质纤维素底物多样性的高度复杂多变的纤维小体。同一个物种中,不同纤维小体催化亚基的对接模块是高度同源的,脚架蛋白上的粘连模块也高度同源,因此,各种催化亚基与脚架蛋白的组装是通过同样的方式实现的。由于这种标准的组装接口,纤维小体的大小和架构的多样性主要由脚架蛋白的复杂程度所决定。目前发现的最简单的纤维小体是来自于Clostridium saccharoperbutylacetonicum的纤维小体,仅包含1 种带有2 个粘连模块的脚架蛋白以及8 种带有对接模块的催化亚基[18],而最复杂的纤维小体来自溶纤维假拟杆菌(Pseudobacteroides cellulosolvens),包含有31 种脚架蛋白和超过200 种的催化亚基[19]。
根据脚架蛋白数目的多少,可以将纤维小体分为简单纤维小体和复杂纤维小体[20]。简单纤维小体只有一个脚架蛋白,而复杂纤维小体具有多个脚架蛋白,且多为分级组装:酶组装在一级脚架蛋白之上,一级脚架蛋白进一步组装在二级脚架蛋白之上,有的细菌中还有将二级脚架蛋白进一步组装的三级脚架蛋白[21]。根据序列比对分析,已知的纤维小体的粘连模块和对接模块可大致分为3 种类型,其中Ⅰ型对接模块直接与酶串联,对应的Ⅰ型粘连模块串联形成一级脚架蛋白;Ⅱ型对接模块通常位于一级脚架蛋白上,对应的Ⅱ型粘连模块串联形成二级脚架蛋白;Ⅲ型对接模块和粘连模块主要发现于瘤胃球菌(Ruminococcus)中,和Ⅰ型和Ⅱ型模块有显著差异[22]。通过一级脚架蛋白和二级脚架蛋白的级联放大,组装得到的纤维小体可以包含上百个酶亚基。不同物种含有的纤维小体脚架蛋白的数目、脚架蛋白上模块的数目和种类等都存在差异,组装形成的纤维小体具有巨大的多样性。图1 展示了热纤梭菌的纤维小体组装模式,是一种典型的具有两级组装的复杂纤维小体。
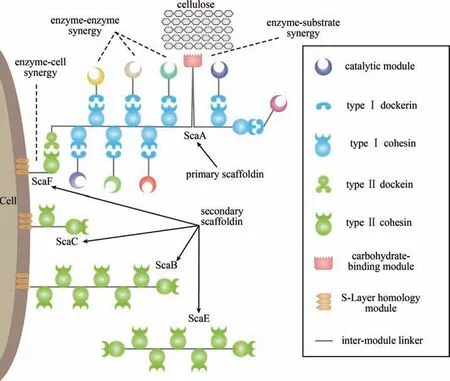
图1 热纤梭菌纤维小体的架构及其带来的协同效应Fig.1 Schematic diagram of cellulosomes from C.thermocellum and their synergistic effects
纤维小体的复杂度及多样性是细菌适应环境中复杂的木质纤维素底物的进化产物。这种适应性主要体现在两个方面:一是纤维小体体系包含了多重协同作用,能够高效降解复杂底物;二是纤维小体的结构具有高度的灵活性,能够适应木质纤维素的复杂结构。
纤维小体体系的协同作用可以分为多个层次,包括酶与酶之间的协同作用、酶与底物的协同作用以及酶与细胞的协同作用(图1)。纤维小体的酶组分具有多样性与互补性。即使是在已发现的最简单的纤维小体中,酶组分也同时包含了多种功能不同且互补的酶类,包括纤维素内切酶、纤维素外切酶、木聚糖酶、木葡聚糖酶、地衣聚糖酶等[18]。对于复杂纤维小体,其酶组分可以达到上百种,分属于不同的糖苷水解酶家族。除了酶与酶之间所具有的功能互补协同性,纤维小体还将不同种类的酶组装到脚架蛋白上,从而形成空间邻近效应,大大提升酶之间的协同作用。纤维小体的脚架蛋白和部分酶亚基上的碳水化合物结合模块将纤维小体紧密结合于底物上,有效缩短了酶对底物的搜寻时间,从而形成酶与底物的协同作用。一些脚架蛋白上具有的SLH 模块把纤维小体固定在细胞表面,由此产生两个益处:一是纤维小体降解产生的糖类在细胞附近,可以更高效地被细胞吸收,避免被周围的竞争者所利用,同时降低产物抑制,形成酶-细胞的协同作用;二是纤维小体作为合成出来的复杂大分子机器,固定在细胞表面减少了酶扩散到远处造成的损失,从而减轻了新蛋白质合成的负担。一些产纤维小体细菌中同时会产生一些并不固定在细胞表面的游离纤维小体[23]。游离纤维小体虽然不具备前述两种益处,但它可以扩散到离细胞稍远的地方,有利于降解较远处的底物,从而形成与细胞表面固定化的纤维小体之间的互补与协同。这些多层次的互补协同作用,是纤维小体降解木质纤维素高效性的基础。本研究组洪伟等[24]通过将热纤梭菌中不同脚架蛋白分别敲除来解除纤维小体的部分协同作用,从而定量分析了各类协同作用对纤维小体活性的贡献。
除了多层次的协同作用,纤维小体构象的灵活性也是其能够适应底物结构复杂性的重要原因。不同于许多分子机器(如核糖体等)较为刚性的整体结构,纤维小体结构是高度动态的[25]。纤维小体的高度动态性使其在结构复杂的木质纤维素表面,可以通过自身的形变实现对底物的高效降解。近期,奥地利格拉茨理工大学Eibinger 等[26]通过原子力显微镜观察了纤维小体在木质纤维素表面的作用过程,发现纤维小体在木质纤维素的降解过程中持续发生巨大的形变,认为这种构象上的灵活性和可变性是纤维小体高效降解木质纤维素的重要原因之一。目前纤维小体这种灵活动态形变的分子机制还不是特别清楚,除了纤维小体模块间具有一定柔性的连接区域可能对这种可变性有贡献之外,是否还有其他因素参与需要进一步研究。产纤维小体细菌除了利用纤维小体自身的自适应特性之外,还发展出一整套底物偶联的调控机制,来进一步增强纤维小体的底物适应性。产纤维小体细菌能够根据底物成分的不同,表达不同的纤维小体酶组分,从而实现对不同底物的高效降解[27-32]。这种底物偶联的纤维小体调控机制的分子基础直到最近十年才得到一定程度的揭示。目前发现的参与纤维小体底物偶联调控的新型调控元件包括新型的σI/anti-σI因子[14,33],新型的5′-UTR 元件[34],以及新的转录后加工调控等[35],这些新型的调控机制是目前纤维小体研究中的前沿课题。
2 纤维小体在合成生物学中的应用:人工纤维小体
纤维小体自发现以来,其模块化特征启示人们可以将其应用于各种生物技术中。早在1994年,以色列维茨曼科学研究所Bayer等[1]就根据当时已知的纤维小体架构,提出了利用纤维小体模块来组装特定功能的蛋白质复合体,称为人工纤维小体(designer cellulosome),但受到当时技术水平的限制(如分子生物学操作尚不成熟),难以实现。直到2001 年,法国国家科学研究中心Fierobe等[36]才报道了第1个双功能人工纤维小体。这时,人工纤维小体组装方式与最初提出的人工纤维小体已略有差别。这是由于20 世纪90 年代对热纤梭菌和解纤维梭菌的纤维小体粘连模块和对接模块相互作用的研究发现,虽然两种细菌的组装模块之间具有显著的同源性,但彼此之间不能交叉相互作用,形成了种间特异性[37]。利用这种种间特异性可以构建出特定酶组分在特定位置组装的纤维小体,即现在所说的人工纤维小体[图2(a)和(b)]。对不同来源的粘连模块和对接模块的系统分析表明,虽然存在一些例外,种间特异性(即正交性)是广泛存在的[38]。不同物种纤维小体组装的正交性的形成原因还不是很清楚,推测这种正交性可能有助于物种间的竞争。多个研究组构建了逐渐复杂的人工纤维小体,从最初的2个酶组分到2016 年的8 个酶组分,人工纤维小体最高的活性已达到热纤梭菌天然纤维小体活性的70%[39-47]。法国国家科学研究中心Mingardon 等[42]组装了一些特殊的、与天然纤维小体的串联组装方式不同的人工纤维小体,如环状的、对称的、分支的等,发现活性最高的组装方式仍然是类似于天然纤维小体的简单串联组装。此外,研究表明模块连接区(linker)的长度对人工纤维小体的组装也十分重要[48-49]。以色列维茨曼科学研究所Bayer 研究组Vazana 等[50]使用合成生物学方式构建了各种排列组合和不同连接区长度的脚架蛋白库,为人工纤维小体的高效构建和筛选奠定了基础。在人工纤维小体的研究过程中发现,人工构建的脚架蛋白随着粘连模块数目的增加其表达纯化的难度逐渐增加,并且更易于降解,导致随着酶组分的增多,使用单一脚架蛋白构建人工纤维小体的难度也不断增大。因此,在2016 年的八酶组分人工纤维小体中使用了类似于天然的两级脚架组装纤维小体的方式[45]。这些人工纤维小体的研究工作,由于具有确定的纤维小体组分和简化的纤维小体大小,不但在机理研究方面可以深入揭示纤维小体的作用机制,而且在应用研究方面也为合成生物学和其他生物技术应用提供了坚实的基础。因此,人工纤维小体架构在生物技术和合成生物学中被广泛用于构建不同功能的多酶复合体(见下面第3和4部分)。

图2 天然纤维小体、人工纤维小体与底物通道效应(a)天然纤维小体的粘连模块之间和对接模块之间都是高度同源的,不同酶组装在脚架蛋白上的位置是随机的;(b)人工纤维小体使用不同物种来源(以不同色彩表示)的粘连模块和对接模块,它们之间具有种间特异性,从而将特定的酶组装到人工脚架蛋白的特定位置上;(c)通过人工纤维小体将级联催化的酶组装起来,底物如同经过一个通道完成多步反应生成最终产物,大大提升反应的效率,形成底物通道效应Fig.2 Natural cellulosomes,designer cellulosomes,and substrate-channeling effects(a)naturally occurring cellulosomes contain highly homologous assembly modules,i.e.cohesins and dockerins,resulting in the random assembly of enzymes on the scaffoldin;(b)designer cellulosomes use assembly modules from different bacteria(shown in different colors),which have speciesspecific interactions for the enzymes to be assembled at specific positions according to the design;(c)cascading catalytic reactions are enhanced by assembling the enzyme cascade into a designer cellulosome,and the substrate is converted to the final product once it has passed through the channel,which is termed as the substrate-channeling effect
除了前述使用天然纤维小体元件进行人工纤维小体的构建,还有很多研究在人工纤维小体构建中设计或引入新元件,以超越天然纤维小体的活力或性能。人工纤维小体的设计得益于不同物种的粘连模块和对接模块相互作用的正交性,但已发现的产纤维小体的物种数目有限,因此人工设计具有正交作用的粘连模块-对接模块对具有重要的应用价值。美国内布拉斯加大学林肯分校Lawire 等[51]设计了利用定向进化高通量筛选正交性粘连模块-对接模块对的方法,并获得了一对新的正交相互作用模块。以色列维茨曼科学研究所Bayer 研究组Gefen 等[52]首次在体外将β-葡萄糖苷酶(BGL)引入纤维小体,从而解除了纤维素降解产物纤维二糖导致的反馈抑制,提升纤维小体降解纤维素的效率。在此基础上,本研究组[53-55]将外源BGL 整合到热纤梭菌基因组中,构建了基于热纤梭菌纤维小体的全菌催化剂,开发了新的木质纤维素转化技术--整合生物糖化技术。通过整合嗜热菌来源的纤维素酶,Bayer研究组Kahn等构建的超嗜热纤维小体在75 ℃展现出非常好的活性[56],随后又证明糖基化修饰可以进一步提升该纤维小体的热稳定性[57]。裂解型多糖单加氧酶(LPMO)是一类需要氧气参加的纤维素氧化降解酶,而已知的纤维小体都是厌氧微生物产生的,因此天然的纤维小体中都不存在LPMO。Bayer 研究组Arfi 等[58]将细菌的LPMO 整合到人工纤维小体中,提升了纤维小体降解纤维素的能力。Bayer研究组Davidi 等[59]则把漆酶引入到人工纤维小体中,使纤维小体具备一定的脱木质素能力,从而大大增强了其降解小麦秸秆的能力。这些研究工作表明,纤维小体的活性虽然很高,但在具体的应用中仍然可以根据需求进一步提升和改进,拓展其应用空间。
由于纤维小体组分多样,且多模块脚架蛋白的构建较为困难,一些研究组探索了使用其他方式组装或制备人工纤维小体。美国夏威夷大学Han和Su[60]设计了利用拆分内含肽(split intein)介导的自连接来合成具有多模块的脚架蛋白,并对比了具有6 个不同位置的粘连模块的脚架蛋白的差异。除了利用大肠杆菌制备人工纤维小体,其他异源体系也可用来产生人工纤维小体,如谷氨酸棒杆菌[61]和枯草芽孢杆菌[62-63]等。由于在一个细菌中分泌多个纤维小体组分可能会对菌株造成较大负担,另一个特殊的人工纤维小体制备方案是通过多个重组菌株(即菌群)分泌不同的纤维小体组分来生产纤维小体[64-65]。通过大肠杆菌或枯草芽孢杆菌等体系制备人工纤维小体的一个常见问题是产生的大分子量脚架蛋白容易降解,而通过无细胞体系合成则可以避免这个问题。日本大学Hirano 等[66-69]利用无细胞体系重构和定制了复杂的多组分纤维小体,分析了酶组分、比例以及外源BGL 等对纤维小体活性的影响。这些研究和探索为人工纤维小体的制备方案提供了多种可能性,有助于在不同场景需求下的应用和开发。
3 纤维小体架构在合成生物学中的应用:合成代谢通路
随着对纤维小体架构和高效作用机制的认识逐渐深入,人们认识到这一架构完全可以用于其他酶类的组装,而不仅仅局限于木质纤维素降解。同时,人工纤维小体构建的成功,也为将这一架构移植到其他酶类提供了具体的实现方案,从而可以构建具备邻近效应与底物通道效应等多重协同效应的高性能多酶复合体[图2(c)]。2013 年美国弗吉尼亚理工学院游淳和张以恒[70]使用人工纤维小体架构将糖酵解途径中的3 个连续的酶TIM、ALD 和FBP 串联起来,构建了合成代谢通路,首次验证了这种组装的可行性和底物通道效应。美国特拉华大学Liu 等[71]使用人工纤维小体架构在酵母表面展示3个级联反应的酶,将甲醇氧化为二氧化碳,产生NADH 的速率提升了5 倍。2014 年,日本名城大学Jindou 等[72]在蓝细菌中使用人工纤维小体构建了SAM 到乙烯的合成途径,使乙烯的产量比游离酶多了3.7 倍,展示出显著的底物通道效应。韩国首尔国立大学Kim 和Hahn[73]在酵母中构建了使用人工纤维小体架构将两个酶形成底物通道产2,3-丁二醇的工程菌株,并通过改变脚架蛋白中粘连模块的数目优化了两种酶在组装中的配比,实现了产量的显著提升。美国加州大学河滨分校Lin 等[74]使用人工纤维小体架构将多个酶定位到酵母的脂滴表面,产生乙酸乙酯的速率比未使用纤维小体架构的酶提升了两倍。华中科技大学阎金勇研究组Yang等[75]使用人工纤维小体架构在解脂耶氏酵母表面展示3个酶(脂肪酶、羧酸还原酶、乙醛脱羧酶),将甘油三酯直接一锅法转化为脂肪烃,初始反应速率提升了17 倍,转化率则由游离酶的7%~32%提升到71%~84%。该研究组Li 等[76]进一步使用人工纤维小体架构将脂肪酶和P450 脂肪酸脱羧酶固定化在纤维素上,同样实现了甘油三酯到脂肪烃的高效转化,并且固定化的催化剂可以回收和多次重复使用。
从这些研究结果可以看出,人工纤维小体可以用于构建各类不同的代谢通路,适用于多种宿主,通常可以实现反应速率或产量数倍的提升,具有非常好的实际应用效果。人工纤维小体通过酶的空间邻近效应,在级联酶之间形成底物通道,可以减少中间产物毒性、中间产物扩散导致下游酶的有效底物浓度低下等问题。对于代谢通路中存在活性较低的瓶颈酶的情况下,使用人工纤维小体的效果会尤其明显。可以预期,在未来合成生物学的代谢通路构建中,基于人工纤维小体的方案将会得到更加广泛的应用。
4 纤维小体架构在合成生物学中的应用:细胞表面展示与酶固定化
天然纤维小体可以通过SLH 模块固定于细胞表面,也可以通过CBM 模块固定在底物表面,这两个酶固定化的特性在合成生物技术中均得到了大量应用。这些应用主要包括:通过在不能降解纤维素的微生物细胞表面展示纤维小体,赋予其降解纤维素的能力;通过在细胞表面、纤维素表面或其他固体材料(如纳米颗粒)表面展示其他酶类,实现上节所述的底物通道效应。虽然天然纤维小体通常使用SLH 模块固定于细胞表面,但这一模块具有一定的物种特异性,因此在异源细胞表面展示纤维小体时,通常使用其他的适用于特定微生物的细胞壁结合蛋白。目前报道的成功将人工纤维小体展示于细胞表面的微生物包括酵母、枯草芽孢杆菌[77-78]、大肠杆菌[79-80]、乳酸乳球菌[81]、植物乳杆菌[82]和恶臭假单胞菌[83]等。其中,以酵母表面展示研究得最多,应用的方式也最为广泛,下面稍作详细介绍。
酵母具有发酵产乙醇的能力,但不能直接降解木质纤维素,因此,将人工纤维小体展示于酵母菌的表面,使其成为直接降解纤维素产乙醇的工程菌株,是实现整合生物加工的一种理想方案。整合生物加工是美国达特茅斯学院Lynd 研究组[84]提出的概念,是指将从木质纤维素降解到生物乙醇生产都整合到一个微生物中,从而大大降低生物燃料生产过程成本的工艺方案。2009 年南非和美国的两个研究组分别独立构建了在酿酒酵母表面展示两功能和三功能人工纤维小体的工程菌株,实现了通过酵母直接降解纤维素来产生乙醇[85-86]。2012 年北京化工大学谭天伟研究组范立海等[87]在酿酒酵母中构建了通过二级脚架放大的人工纤维小体的表面展示,并优化了二级脚架的长度,使得最终的乙醇滴度得到了显著提升[图3(a)]。同时美国特拉华大学Tsai等[88]也发表了类似的工作。山东大学侯进与鲍晓明研究组Tang等[89]采用二硫键连接酵母细胞壁蛋白的方式构建级联脚架,表明其组装效率高于普通的二级脚架。美国加州大学尔湾分校Srikrishnan 等[90]在酵母表面展示了三功能的木聚糖小体,大大增强了酿酒酵母对半纤维素的糖化能力。除了酿酒酵母,解脂耶氏酵母和毕氏酵母也可用来在表面展示人工纤维小体[75,91-92]。美国密西根大学Smith 等[93]定量分析了酵母表面组装多脚架人工纤维小体时的结构性能关系,揭示了酵母表面展示人工纤维小体的最优条件。2020年,台湾中央研究院Anandharaj等[94]在马克斯克鲁维酵母表面展示了具有63 个酶组分的纤维小体,并将表达的基因整合到基因组上。这是目前已报道的在酵母表面展示的最大的纤维小体,该菌株从纤维素生产乙醇的产量显著高于以前报道的其他菌株。
除了利用酵母展示纤维小体来实现生物燃料的生产,酵母表面展示人工纤维小体还可以用来提升生物燃料电池的性能[图3(b)]。以色列本古里安大学Szczupak 等[95]通过酵母表面展示人工纤维小体架构的酶级联反应来驱动生物燃料电池的阴极和阳极反应,并将这种构建生物燃料电池的人工纤维小体称为电子小体,证明了该概念的可行性。青岛大学刘爱骅研究组Fan 等[96]将酶的级联反应组装于酵母表面驱动生物燃料电池阴极反应,发现人工纤维小体在电极表面组装的顺序和比例都会对燃料电池效能产生很大影响,通过优化之后获得了36.1 μW/cm2的最大功率密度,远高于其他基于淀粉/氧气的生物燃料电池。

图3 人工纤维小体用于细胞表面展示(a)通过在酵母表面展示人工纤维小体,可以赋予酵母降解纤维素的能力;(b)利用酵母表面展示的级联酶固定到生物燃料电池的阴极或阳极,可以显著提升生物燃料电池的性能Fig.3 Cell-display using designer cellulosomes(a)designer cellulosomes displayed on yeast cell surfaces allow the yeast to degrade cellulose;(b)using yeasts displaying designer cellulosomes containing enzyme cascades to serve as a bioanode and biocathode,the performance of the biofuel cells can be significantly enhanced
除了展示于细胞表面,使用类似的思路还可以将多酶体系固定化于纤维素表面,实现对纤维素表面的功能化、提升酶的稳定性以及增强回收再利用能力等。2013 年美国弗吉尼亚理工学院张以恒研究组游淳等[97]构建了将纤维素转化为淀粉的多酶体系,包含纤维素酶、纤维二糖磷酸化酶、和α-糖苷磷酸化酶,其中纤维二糖磷酸化酶和α-糖苷磷酸化酶通过人工纤维小体上的CBM 固定化于包含纤维素的磁性纳米颗粒上,从而便于回收再利用。2016 年北京化工大学范立海研究组Li等[98]利用人工纤维小体架构,通过增加脚架蛋白的模块数目,实现了使用CBM 进行高酶载量的固定化。
以上研究表明,利用人工纤维小体进行细胞表面展示或酶固定化是一种非常有效的策略,可应用于各种不同的宿主细胞或材料,在未来的合成生物学产业应用中将发挥重要的作用。
5 纤维小体概念在合成生物学中的应用:仿纤维小体
纤维小体架构的核心启示在于超分子体系的自组装和多酶体系的协同作用。基于这一启示,人们开发了利用其他生物分子相互作用形成的超分子复合体来模仿纤维小体架构,称为仿纤维小体(artificial cellulosome)(图4)。如同人工纤维小体可以用来构建非纤维素酶的复合体,仿纤维小体的酶系可以是纤维素酶,也可以是其他各类不同的酶系,因此形成的复合体可能具备完全不同的功能特征。
一类仿纤维小体是利用自然界中已有的多亚基复合体或蛋白质交联来实现组装。来自杨树的SP1蛋白可以自发形成环状的十二聚体。人们利用这一特性,通过融合粘连模块,将多个纤维素酶组装形成类似于纳米颗粒的复合体,复合体的活性比游离酶有显著提升[99-100][图4(a)]。另一个类似的例子是利用来自极端嗜热古菌的一种十八聚体的二类分子伴侣(rosettasome)作为脚架蛋白,通过融合粘连模块构建多酶复合体,这一复合体被称为rosettazyme[101]。人们利用这一体系组装不同的酶类形成仿人工纤维小体,用于木质纤维素的糖化以及将葡糖醛酸木聚糖转化为平台化合物D-木糖酸[102-103]。美国加州大学洛杉矶分校McConnell 等[104]利用一个24 亚基的自组装蛋白笼作为脚架蛋白,并使用转肽酶将带有特定多肽标签的纤维素酶共价结合到蛋白笼表面,由此得到的仿纤维小体降解纤维素的活力显著高于游离酶系。日本九州大学Budinova等[105]利用酪蛋白可以通过转谷氨酰胺酶进行交联形成共聚物的特点,在纤维素酶上引入可以和酪蛋白交联的多肽,进而通过酶促交联形成仿纤维小体共聚物。这种酪蛋白共聚物的一个优势是可以通过加入钙离子来沉淀,从而易于回收。美国夏威夷大学Han 等[106]利用酵母朊蛋白形成的淀粉样纤维作为脚手架,将纤维素酶展示在淀粉样纤维的表面,并固定于酵母细胞壁上,该方法展示的酶的数目远远超过了常规的人工纤维小体所能展示的酶的数目。韩国高丽大学Kim 等[107]将粘连模块与烟草花叶病毒包被蛋白融合,利用烟草花叶病毒包被蛋白自组装的杆状纳米结构作为脚手架,在其表面展示了高密度的酶分子。香港中文大学夏江研究组与武汉大学刘天罡研究组[108]等合作,开发了利用AKAP信号复合体中的一对相互作用的多肽实现多酶复合体的仿纤维小体组装,并将其应用于类胡萝卜素和番茄红素合成中关键酶的底物通道建立,大大提升了产量。香港中文大学夏江研究组Liu 等[109]利用可形成共价复合体的SpyCatcher 和SpyTag 蛋白对,构建了可自组装的纳米脚手架,将维生素K合成途径中的酶组装成仿纤维小体,使其催化性能得到了显著提升。丹麦哥本哈根大学Behrendorff等[110]利用结合于细胞膜的类囊体蛋白CURT1A 作为脚手架,将多个酶组装到膜结构上,从而实现了在真核生物胞内细胞器表面展示的仿纤维小体[图4(c)]。

图4 已报道的多种仿纤维小体构建方式(a)利用蛋白质多聚体作为脚手架构建仿纤维小体;(b)利用纳米颗粒作为脚手架,可以获得高酶载量的仿纤维小体;(c)利用膜蛋白作为脚手架,可以在细胞器表面构建仿纤维小体;(d)以DNA作为脚手架,利用dCas9和引导RNA的特异性构建仿纤维小体Fig.4 Various schemes for developing artificial cellulosomes(a)Artificial cellulosomes are constructed using an oligomeric protein as scaffold;(b)using nanoparticles as scaffold for the construction of artificial cellulosomes,loading of enzymes can be significantly increased;(c)artificial cellulosomes can be constructed on surface of organelles using a membrane protein as scaffold;(d)Artificial cellulosomes can be constructed using DNA as the scaffold with the specificity of dCas9 and guide RNA.
另一类仿纤维小体则完全抛弃了使用蛋白质作为脚手架,而改用其他非蛋白类的分子作为脚手架来构建多酶复合体,如纳米颗粒和DNA 等。纳米颗粒作为脚手架具有稳定性高、易大量制备和回收等优势,文献中已报道了多种用于构建仿纤维小体的纳米颗粒,包括硒化镉纳米颗粒[111]、金纳米颗粒和金掺杂的磁性硅胶纳米颗粒[112]、四氧化三铁磁性纳米颗粒[113]以及Ni-NTA 功能化胶束[114]等[图4(b)]。DNA 分子具有非常容易合成和定制的优势,也可以作为脚手架构建仿纤维小体。2013 年日本九州大学Mori等[115]利用DNA-蛋白质交联的方式,首次将纤维素酶交联到DNA 骨架上构建了仿纤维小体。这种方式构建的仿纤维小体由于交联的位置缺乏特异性,无法实现人工纤维小体那样的组分和位置定制。为克服这个问题,美国特拉华大学Chen 研究组连续开发了多种使用DNA 作为脚手架构建仿纤维小体的方法,以实现位置特异性并体现出DNA 可定制合成的优势[116-119]。Chen 研究组[116]在2014 年报道了利用锌指蛋白和DNA 的特异性相互作用,实现基于DNA脚手架的仿纤维小体的定制组装。2016 年,Chen研究组[117]利用一种可共价结合于氯己烷的HaloTag,通过合成特定序列的带有氯己烷标记的DNA,利用双链DNA的互补实现在特定模板DNA位点链接特定纤维素酶,从而形成具有位点特异性的基于DNA 脚手架的仿纤维小体。使用这一方案,他们组装了具有4种酶组分的纤维素降解系统,以及进一步增加葡萄糖氧化酶,从而直接将纤维素转化为葡萄糖酸和双氧水的系统[118]。2019年,Chen研究组[119-120]将dCas9 蛋白与纤维素酶融合或利用SpyCatcher-SpyTag连接,利用正交的dCas9蛋白对DNA 的位点识别的特异性,组装了以DNA 为脚手架的两组分仿纤维小体。最近,美国加州大学伯克利分校的Lim 等[121]使用SpyCatcher 和SpyTag将同一种dCas9与不同的纤维素酶连接,并利用不同的引导RNA 产生对特定DNA 位点的序列特异性结合,实现多酶在DNA 特定位点的组装,并构建了具有紫色杆菌素生物合成途径的5个酶的仿纤维小体[图4(d)]。
可以看到,仿纤维小体构建研究在近10 年来得到了巨大的发展,作为脚手架使用的材料和体系复杂多样,但其核心都是通过构建脚手架使多种酶分子在空间上形成邻近效应,从而获得高效的纳米分子机器或生物功能材料。可以预期,基于纤维小体架构和协同性带来的启示,仿纤维小体在未来会有更多的构建方法和应用领域。
6 展望
纤维小体以其模块化特征和模块的多样性,成为自然界中最符合合成生物学策略的分子机器之一,因而无论是纤维小体模块本身还是纤维小体的组装策略,都在合成生物技术开发中得到了广泛的应用。纤维小体研究过程中所发现的模块化、标准接口自组装、多层次协同以及自适应调控等策略,与合成生物学中的许多工程化策略不谋而合,可以说是大自然进化出的内源的“合成生物学”策略的一个范例。对这一范例的研究,为合成生物技术开发带来了许多有益的启示,而其中一些尚未深入揭示的分子机制,有望在将来为合成生物学提供更多的工具和方法。
目前已发现的产纤维小体细菌大约有数十种,其中产复杂纤维小体的细菌有10 种左右,它们之间的纤维小体架构差异巨大。因此,自然界中可能仍存在大量的产纤维小体细菌未被发现。筛选新的产纤维小体细菌可能进一步丰富纤维小体的元件库。即使在已发现的产复杂纤维小体细菌中,由于每种细菌中的纤维小体亚基数目可达上百个,其中存在很多功能特性并未得到清晰研究的新型元件,对它们的研究有望为纤维小体应用与合成生物技术开发提供新的素材。本研究组最近在研究丙酮丁醇梭菌中的纤维小体组装元件时,发现了一对非常特殊的pH 依赖的粘连模块和对接模块,在不同的pH 下其结合力可以发生巨大的变化,而且粘连模块可以从仅结合对接模块的一个位点变为仅结合另一个位点。这种独特的pH 依赖的位点切换现象是首次在蛋白质相互作用中发现,为开发新型的pH 依赖的蛋白质相互作用元件提供了基础[122]。我们最近还发现,在一些细菌的纤维小体中存在两个或多个对接模块串联的蛋白质,虽然它们在纤维小体中的作用还不是十分清楚,但这种串联的对接模块为构建新型的纤维小体架构提供了新的思路,结合脚架蛋白上的串联的粘连模块有可能形成新的特殊的人工纤维小体架构[123]。除了组装元件,对纤维小体中催化元件的研究还可为合成生物学提供新的酶元件。葡萄牙里斯本大学Brás等[124]对一个催化模块被标注为假想蛋白的纤维小体亚基进行了研究,发现其是一类新型的糖苷水解酶,主要在纤维素的结晶区和无序区交界处进行水解。我们和以色列维茨曼科学研究所Bayer 研究组的独立研究发现,黄色梭菌中的纤维小体具有两个膨胀因子类似蛋白,它们不能水解纤维素,但能够在某种条件下增强其他纤维素酶的活性[125-126]。随着许多已知的含有纤维小体的基因组测序完成,越来越多的功能未知的蛋白质模块被发现存在于纤维小体中。这些模块既有与对接模块串联的,也有与粘连模块串联的,它们的功能机制有待进一步深入挖掘,将来可以为木质纤维素生物转化、人工纤维小体设计与合成生物学应用提供新元件。
除了纤维小体自身具有模块化的特征,研究发现纤维小体的调控也具有非常有趣的模块化特征。纤维小体作为细菌获取外部碳源(也即主要能量来源)的分子机器,其调控过程和胞外底物类型及细胞代谢过程密切偶联。近年来的研究表明,复杂纤维小体的转录受到一类新型σ/anti-σ 因子σI/anti-σI的调控,通过多对σI/anti-σI来识别不同类型的底物,并起始转录对应于该底物成分的纤维小体酶组分。我们和以色列研究组的合作研究表明,σI/anti-σI是一类新型的类似于胞质外功能(extra-cytoplasmic function,ECF)类型σ因子的调控元件,它们上面带有多种新型的蛋白质模块参与调控,且多对σI/anti-σI的调控具有一定的正交性和部分交叉性[14-5]。在过去的研究中,ECF 类型的σ 因子被改造为合成生物学的正交调控因子[127-128],因此如果能够解析σI对启动子的正交识别和交叉识别机制,产复杂纤维小体菌中大量的σI/anti-σI因子将为合成生物学提供一个新的元件库。
由于纤维小体是非常高效的木质纤维素降解系统,其异源表达往往难以超过原始菌株中纤维小体的性能。因此,对产纤维小体细菌进行合成生物学改造就成为木质纤维素利用的一个优选的方案。美国达特茅斯学院Lynd 研究组[129]基于整合生物加工策略,对热纤梭菌进行了系统的代谢工程改造,实现了29.9 g/L 的乙醇产量。我们研究组则采取了不同于Lynd 研究组的策略,在热纤梭菌纤维小体中整合外源的高效BGL,解除寡糖对纤维小体的产物抑制,从而可以将木质纤维素转化为可发酵糖,而不是直接生产生物燃料等最终产品。这种工艺策略我们称为整合生物糖化工艺[53-54]。可发酵糖可以进一步用于下游各种微生物发酵生产不同的产物,因此整合生物糖化工艺具有产物出口灵活的优势,同时又保留了整合生物加工中将各种步骤整合带来的成本降低的好处,更具有产业化应用的前景[55]。除了热纤梭菌的纤维小体具有巨大的应用价值,热纤梭菌的遗传改造在各类嗜热菌中属于研究相对较多的一个,有较多的遗传操作工具和方法,因此可以将其开发为嗜热菌的底盘细胞。我们研究组与德国格赖夫斯瓦尔德大学Bornscheuer 研究组合作,在热纤梭菌中外泌表达了一个可以降解聚对苯二甲酸乙二醇酯(PET)塑料的嗜热角质酶,实现了目前最高效的全菌PET 降解策略,证明了热纤梭菌在合成生物学应用中的巨大潜力[130]。这些例子表明,产纤维小体细菌可以为合成生物学在生物燃料生产、微生物细胞工厂构建以及环境修复等领域提供新的底盘细胞,在未来的合成生物学应用中具有巨大的潜力。
除了纤维小体元件和产纤维小体细菌在合成生物学中具有重要的应用价值,纤维小体研究中提供的高效模块化自组装、酶的邻近效应与底物通道效应、多层次协同作用和底物自适应调控等方法策略具有通用性,可用于自组装仿纤维小体开发、人工代谢通路构建、微生物细胞工厂构建和生物材料开发等诸多领域。基于脚架蛋白的复合体构建、细胞内酶级联催化和限域构建以及细胞表面工程等均已发展为重要的合成生物学和生物技术研究方向。这些通过纤维小体研究获得的方法策略在未来的合成生物学研究和开发中必将大放异彩。

