合成生物学在肠道微生态疗法研发中的应用
高梦学,王丽娜,黄鹤,2
(1 天津大学化工学院,教育部合成生物学前沿科学中心,系统生物工程教育部重点实验室,天津 300072;2 天津大学浙江绍兴研究院,浙江 绍兴 312000)
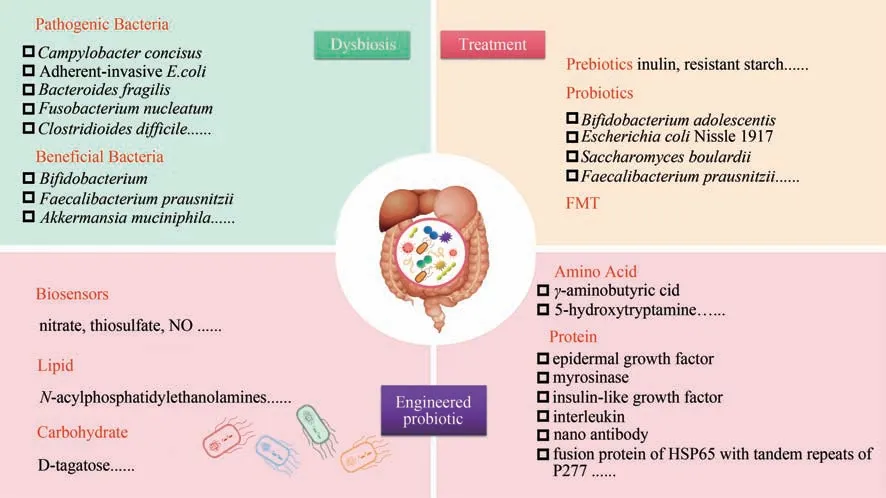
肠道菌群是指定植于哺乳动物肠道内的共生微生物群,在宿主新陈代谢、免疫调节和信号传导过程中扮演着重要角色[1-2]。健康的肠道菌群具有相对稳定的结构,能在一定程度上帮助宿主抵抗病原菌入侵、适应环境变化[3]。然而,步入工业化时代以来,尤其随着生活方式的改变、医疗卫生水平的提高,肠道菌群的结构和功能发生了显著变化[图1(a)][4-9]。这种重塑的“工业化”肠道菌群对人类健康产生了深远影响,加速了消化系统疾病、代谢性疾病和精神疾病等多种慢性疾病的发生发展[10]。在过去十几年里,以失衡肠道菌群为靶点的微生态疗法在生物医学研究界引起了广泛的关注。
常见的微生态疗法主要包括益生元疗法、益生菌疗法和粪菌移植疗法[图1(b)]。益生元(prebiotics)是一类能够被宿主微生物选择性利用并有益于宿主健康的底物[11],包括低聚果糖、低聚半乳糖、菊粉和抗性淀粉等。它们可以富集双歧杆菌等特定微生物,产生有机酸等代谢终产物,帮助机体改善健康[12-13]。益生菌(probiotics)是一类当给予足够的量时能给宿主带来健康益处的微生物[14],其主要产品益生菌膳食补充剂和非处方药已用于减轻胃肠道功能紊乱症状、提高免疫系统功能和调节能量代谢[15-24]。然而,到目前为止益生元疗法和益生菌疗法的有效性在很多应用场景存在较大争议[25-26]。Wilson 等[27]通过对11 项随机对照研究进行荟萃分析,发现β-低聚半乳糖和瓜尔胶等益生元无法显著改善肠易激综合征及其他功能性肠病患者的症状,且不同种类的益生元对症状的影响显示出差异性。Costeloe 等[28]在一项多中心随机对照3 期临床试验中发现短双歧杆菌BBG-001在预防极早产儿的坏死性小肠结肠炎及晚发性败血症方面无显著功效。另外,近期发表在JAMA等杂志上的试验结果也表明鼠李糖乳杆菌GG等益生菌在缓解轮状病毒等常见病原体感染引起的急性肠胃炎[29]和预防危重病人呼吸机相关肺炎[30]方面缺乏有效证据。粪菌移植(fecal microbiota transplantation,FMT)是指将从健康人粪便中获得的功能菌群移植到患者胃肠道内,重建新的肠道菌群并实现肠内外的疾病治疗[31]。2013 年2 月美国食品及药品监督管理局首次将FMT 写入复发性或难治性艰难梭菌感染(Clostridium difficileinfection,CDI)治疗指南[32]。近十年来,FMT 在治疗CDI 方面取得了突出的疗效,受到国内外越来越多的关注。然而作为一项尚不完全成熟、只在局地获批使用的临床治疗手段,FMT 的安全性和重现性有待进一步验证[33]。
合成生物学的出现为解决上述问题带来了转机。合成生物学是指在工程学思想指导下,按照特定目标理性设计、改造乃至从头重新合成生物体系,即生物学的工程化[34]。作为一个新兴交叉学科,它已经在农业、医药、环境等多个研究领域取得了长足发展。其中,合成生物学技术的医学转化应用研究更是受到了生物学界和医学界的重点关注。在医学应用领域,利用合成生物学技术构建的工程益生菌可在肠内生理或病理信号刺激下,表达酶、细胞因子、抗菌肽、激素、抗体等特定产物[35],改善肠道微环境[图1(c)]。与传统药物治疗相比,工程益生菌具有更高的灵活性、特异性、可预测性和可控性。目前,乳酸菌特别是乳酸乳球菌(经常作为发酵乳制品的一部分被食用),因较高的安全性常被用作递送治疗药物的表达载体,具有广泛的临床应用价值。此外,芽孢杆菌和大肠杆菌等益生菌也是重组活体生物药研究过程中常见的底盘微生物[36-37]。近年来,随着合成生物学的发展,微生物活体疗法的遗传工具箱不断扩充,CRISPR-Cas[38]和Mobile-CRISPRi[39]等工具的开发为模式和非模式微生物的基因整合研究提供了有效方法。另外,基于合成生物学技术发展起来的智能微生物工程[40],赋予了微生物自主决策能力,在精准医疗方面具有广泛的发展前景,为具有传感、生产和生物遏制作用的全功能活菌生物制剂的成功研发提供了可能。

图1 肠道微生态疗法(a)肠道菌群失衡;(b)常见微生态疗法;(c)工程益生菌疗法Fig.1 Gut microbiome therapeutics(a)Gut microbiota dysbiosis;(b)Traditional modalities to manipulate microbiome;(c)Engineered probiotics
本文将基于靶向消化系统疾病、代谢性疾病和精神疾病的微生态疗法进行综述,首先回顾工程益生菌在上述重大慢病中的调节作用,然后探究利用工程益生菌构建人工合成菌群面临的机遇与挑战,最后对应用合成生物学理念开发多细胞菌群的新型微生态疗法进行展望。
1 靶向消化系统疾病的微生态疗法
消化系统疾病是一类多发且常见的慢性肠道疾病,近年来全球流行率不断增加,给医疗系统带来了巨大的财政和资源负担[41-42]。炎症性肠病和结直肠癌都是常见的消化系统疾病。尽管具体发病机制尚不清楚,但研究表明失衡的肠道菌群为消化系统疾病的重要诱因[43-44]。靶向失衡肠道菌群的工程益生菌疗法在消化系统疾病防治研究中展现出巨大潜力。
1.1 炎症性肠病
炎症性肠病(inflammatory bowel disease,IBD)是一组病因不明的复发性肠道炎症性疾病,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn's disease,CD)[45]。其发病机制涉及遗传、环境、肠道菌群等多种因素,其中肠道菌群的作用不容忽视。在炎症反应期间,患者肠道内硫酸盐还原菌的水平升高[46],与硫酸盐还原菌相关的硫代谢物硫代硫酸盐含量增加。硫代硫酸盐是一种重要的炎症生物标志物,可作为输入信号用于IBD的诊疗。2017年,莱斯大学Tabor团队[47]在希瓦菌中首次发现了可用于检测硫代硫酸盐的双组分系统,并在益生菌大肠杆菌Nissle 1917(Escherichia coliNissle 1917,EcN)底盘细胞中进行了验证。之后在此双组分系统基础上,Woo等[48]结合布尔运算生成了同时检测硫代硫酸盐和硝酸盐等多个信号的布尔门生物传感器,Mimee等[49]整合细菌传感器与微电子设备发明了可植入胃肠道的微型检测器,为炎症相关疾病的非侵入性诊断提供了新途径。
目前,IBD尚无根治的方法,缓解炎症反应是治疗IBD 的现有目标。因此,以炎性因子为靶标肠内原位递送治疗药物的重组益生菌被认为是 治 疗IBD 的 潜在 有 效 疗 法。Steidler 等[50]和Vandenbroucke等[51]利用乳酸乳球菌分泌体系,分别构建了表达白细胞介素-10(interleukin-10,IL-10)和抗肿瘤坏死因子α(tumor necrosis factor α,TNFα)纳米抗体的递送系统。每天口服这些递送系统导致了IL-10 和抗TNFα 纳米抗体在结肠内的局部释放,提高了IL-10 和抗TNFα 纳米抗体的生物利用度,避免了全身给药导致的副反应,有效缓解了小鼠结肠炎症水平。哈佛医学院Quintana 课题组[52]通过结合定向进化和合成基因回路的方法,推出了用于治疗IBD 的自调节工程酵母菌。该工程菌能够根据肠道内促炎代谢物三磷酸腺苷(adenosine triphosphate,eATP)的水平启动三磷酸腺苷双磷酸酶的表达和分泌,以降解过多的eATP并产生抑制炎症的腺苷,从而提供局部的炎症治疗。此外,重组益生菌还可通过递送转化生长因子、超氧化物歧化酶、血红素氧合酶、胰岛素样生长因子、血吸虫免疫调节蛋白和胱抑素等蛋白类药物治疗IBD[53-54]。除蛋白类药物外,清华大学陈国强团队[55]还利用工程化的EcN 合成了3-羟基丁酸(3-hydroxybutyrate,3HB)等酮体分子,并通过调节肠道菌群结构、增加短链脂肪酸含量实现了硫酸葡聚糖钠盐(dextran sulfate sodium,DSS)诱导的小鼠结肠炎的治疗。此外,为进一步提高递送过程的可控性,天津大学王汉杰研究团队[56]结合光学传感技术和光遗传学技术,在EcN中开发了受近红外光和pH 同时调控的光治疗纳米系统,可用于UC 的家庭护理,具有一定转化应用前景。
此外,破损的肠黏膜屏障也是IBD治疗的潜在靶标。IBD发作期间肠黏膜屏障被破坏,肠道内壁及微生物群暴露于有害环境中,肠上皮完整性的快速恢复成为了治疗的关键。三叶因子(trefoil factors,TFFs)和表皮生长因子(epidermal growth factor,EGF)是两种重要黏膜干预剂,能促进细胞迁移并在较短时间内修复黏膜伤口。然而,以口服方式给药时,TFF 和EGF 易被消化酶降解且易黏附在小肠黏液上,从而导致口服生物利用度降低。已有研究证明,利用合成生物学技术,对EcN 进行遗传学改造,原位生成TFF[57-58]和EGF[59]的重组益生菌能促进肠黏膜伤口的愈合,对DSS 诱导的结肠炎发挥保护作用。
1.2 结直肠癌
结直肠癌(colorectal cancer,CRC)是一种病发部位位于结肠或直肠的癌症[60],包括散发型和结肠炎型两种类型。近年来,随着高通量测序技术和微生物培养组学技术的发展,肠道菌群在CRC 中的作用越来越受到重视。香港中文大学于君、黄曦团队[61]对不同研究队列的526 个肠道菌群宏基因组数据进行荟萃分析,确定了7 种在CRC 患者中显著富集的核心微生物。这些微生物作为潜在的诊断标志物,可用于新型生物传感器的开发,推动CRC 早期筛查技术的发展。
慢性炎症是结肠炎型CRC 发展的关键驱动因素。原位分泌抗炎药物的重组工程菌,不仅可以用于治疗IBD,还可以抑制肠息肉的形成,从而阻断CRC 的发生发展[53]。除传统的抗炎药物外,来自膳食中的植物化学物也是CRC 防治研究中常用的治疗分子。然而,这类天然存在的化学预防药物生物利用度低、吸收效果差,且通常需要依赖特定催化酶才能发挥治疗作用。针对这些问题,Ho等[62]构建了表达芥子酶的重组工程菌,成功将十字花科蔬菜中的芥子油苷转化成了具有抗癌活性的萝卜硫素,抑制了超过95%的癌细胞增殖,减少了食用十字花科蔬菜的CRC小鼠的肿瘤数量。此外,An等[63]从鼠李糖乳杆菌中分离出了新型抗癌药物p8,并将表达p8的基因引入戊糖片球菌中,构建了治疗CRC 的细菌给药系统。结果表明,该系统在CRC 异种移植和氧化偶氮甲烷/DSS 化学诱导的小鼠模型中都具有正向治疗效果。另外,Chen等[64]利用重组EcN 将葡萄糖转化为抗癌药物5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA),并结合光热治疗技术开发了一种治疗CRC 的新疗法。综上所述,与传统治疗药物和疗法相比,工程益生菌在CRC 治疗中更具先天优势,能对癌细胞进行更智能的识别并在肿瘤组织内部释放理想的治疗成分。
靶向消化系统疾病的微生态疗法总结见表1。

续表
2 靶向代谢性疾病的微生态疗法
代谢性疾病是指葡萄糖、蛋白质和脂质等营养物质在体内代谢异常引发的一类疾病,包括肥胖、糖尿病和非酒精性脂肪肝病等[65]。近年来,随着生活方式(如久坐[66]等)、饮食习惯(如高脂饮食[67]等)的改变,代谢性疾病的发病率呈逐年上升趋势。越来越多的研究表明,代谢性疾病与肠道微生态失调有关。肠道菌群紊乱不仅可以通过破坏肠屏障功能触发局部或全身性低度炎症反应,还能加速宿主对能量的摄入、影响胰岛素敏感性。近期,许多研究已经证实工程益生菌等微生态疗法在治疗代谢性疾病方面的功效。
2.1 肥胖
肥胖(obesity)是指由多因素引起,导致体内脂肪堆积过多达到危害健康程度的一种慢性代谢性疾病[68]。目前诸多研究表明,肥胖的发生与肠道菌群失衡密切相关。上海交通大学赵立平团队[69-70]通过对病态肥胖患者的肠道菌群进行分析,发现并分离了产内毒素的阴沟肠杆菌,并首次证明了它与肥胖之间的直接因果关系。此外,进一步的研究表明失衡的肠道菌群可通过影响机体能量摄入和代谢情况、激发促炎反应,加速肥胖症的形成[71]。当前预防和管理肥胖的方法包括饮食干预、有氧运动、药物治疗和手术治疗等[72-73]。这些方法主要围绕着燃脂增加能量消耗和抑制食欲减少能量摄入两方面开展。从肠道微生态入手,针对影响代谢的各因素开发治疗方法可能是预防管理肥胖的新途径。
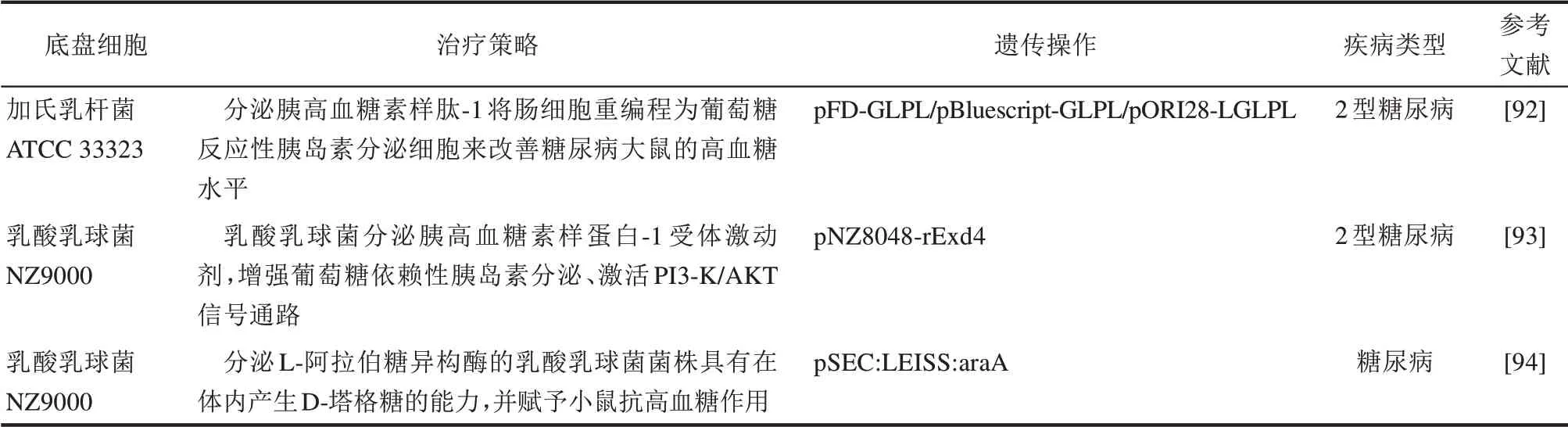
分泌激素类药物的重组益生菌有助于控制肥胖。胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)是一种肠促胰岛素分泌激素,具有延缓胃排空和控制食欲的作用[74]。GLP-1 引领了新一代的抗肥胖药物,然而目前注射仍是GLP-1 等激素类药物释放的主要途径,常伴有药物半衰期短、患者服药依从性差等问题。为解决这些问题,陈廷涛课题组[75]构建了分泌GLP-1 的质粒过表达型工程菌MG1363-pMG36e-GLP-1,顾建文团队[76]合成了分泌GLP-1长效类似物的重组EcN。给高脂饮食诱导的肥胖小鼠口服上述工程菌发现,肥胖小鼠的体重明显降低、肠道菌群多样性显著增加。除GLP-1 外,研究人员还关注了胃泌酸调节素(oxyntomodulin,OXM)、未羧基化或低羧基化的骨钙素(uncarboxylated or low-carboxylated OC,ucOC)和成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)等激素类药物。Long 等[77]以双歧杆菌为载体开发了新型口服给药系统,用于递送OXM 及其类似物。Namai等[78]基于乳链菌肽控制基因表达(NICE)系统构建了生产ucOC的基因工程乳酸菌NZ-OC,在诱导剂nisin 的存在下产生并分泌了ucOC。Cao 等[79]以LacF基因代替抗生素抗性基因作为选择标记,合成了乳酸乳球菌NZ3900/PNZ8149系统,实现了FGF21表达。
除激素类药物外,还有许多治疗分子可由益生菌合成用于治疗肥胖。N-酰基磷脂酰乙醇胺(N-acylphosphatidylethanolamines, NAPEs) 是 一类具有抗肥胖特性的脂质家族。范德堡大学Davies团队[80-81]通过研究证明,使用来自拟南芥中的NAPEs 合酶改造EcN 可产生具有生物活性的NAPEs。持续8 周服用表达NAPEs 的工程菌可降低高脂饮食小鼠的肥胖水平,改善小鼠胰岛素抵抗和肝脂肪变性情况。且研究表明,小鼠在服用工程化EcN 之前用或不用抗生素预处理肠道菌群都能得到相似的肥胖改善效果。短链脂肪酸是微生物发酵膳食纤维的主要产物,包括乙酸、丙酸和丁酸等,对宿主能量代谢具有调节作用。本研究团队[82]利用CRISRP/Cas9 基因编辑技术,在枯草芽孢杆菌基因组中引入丁酸合成途径关键酶基因,敲除自溶调控基因和乙酸合成调控基因,构建了高产丁酸的重组益生菌。通过评估产丁酸工程菌对高脂饮食诱导的肥胖小鼠的体重增加、内脏脂肪堆积、肝脏损伤、葡萄糖耐受和胰岛素抵抗的缓解改善情况,证明了产丁酸工程菌在肥胖预防管理方面的潜力。综上所述,使用重组益生菌原位递送抗肥胖药物可能是预防或治疗肥胖的一种有价值的策略。
2.2 糖尿病
糖尿病(diabetes)是一组以高血糖为常见表型的代谢性疾病,包括1 型糖尿病(type 1 diabetes,T1DM)和2型糖尿病(type 2 diabetes,T2DM)[83]。除生活方式和饮食习惯外,越来越多的证据表明,肠道菌群在糖尿病的发展过程中发挥了重要作用[84-85]。糖尿病作为一种终身性疾病,很难完全治愈。目前治疗糖尿病的一线药物通常与非靶向性和低耐受性相关[86]。抗原递送是治疗T1DM 的一种有吸引力的策略。Robert 等[87]和Takiishi 等[88]通过在小鼠肠内释放胰岛素原和IL-10,改善了非肥胖性糖尿病(nonobese diabetic,NOD)小鼠的T1DM发病率。Lang等[89]通过给NOD小鼠口服表达葡萄球菌核酸酶(staphylococcal nuclease,SNase)的重组乳酸乳球菌,降低了NOD 小鼠的发病率和死亡率。进一步研究表明,SNase 延缓T1DM 发作的机制与中性粒细胞胞外陷阱的早期干预有关。DiaPep277,一种衍生自热休克蛋白的多肽,有助于控制自身免疫系统对β细胞的攻击。之前已有研究指出,DiaPep277 以热休克蛋白65(heatshock protein65,HSP65)为免疫原性载体经鼻给药可显著降低NOD 小鼠的糖尿病发病率。然而,由于HSP65的自降解性质,HSP65-6P277在治疗过程中并不稳定。为了提供大量融合蛋白并增强长期免疫耐受效应,Ma 等[90]构建了肠内原位表达HSP65-6P277 的乳酸乳球菌。给NOD 小鼠口服此重组乳酸乳球菌导致了NOD 小鼠血糖水平的下降和胰岛炎症的减轻。
除诱导免疫耐受外,一些工程益生菌还能刺激肠上皮细胞转化为胰岛素分泌细胞,恢复并维持肠内分泌功能。Agarwal 等[91]将编码GLP-1 的质粒载体转化到乳酸乳球菌中,开发了GLP-1 的活体口服给药系统LL-pUBGLP-1。与对照相比,LL-pUBGLP-1 诱导了仓鼠胰岛β 细胞分泌胰岛素。Zucker 糖尿病肥胖大鼠模型在口服LL-pUBGLP-1 2~11 h 后血糖水平显著降低,胰岛素水平显著增加。此外,Duan 等[92]的研究结果也证明了口服分泌GLP-1的共生细菌可以刺激肠上皮细胞转化为胰岛素分泌细胞,改善糖尿病大鼠模型中的高血糖症。Exendin-4(Exd4)是GLP-1受体激动剂,由于其对二肽基肽酶4的抗性而具有更持久的生物活性,被认为是治疗T2DM的有效药物。进一步的研究发现,重组乳酸乳球菌分泌的Exd4增强了葡萄糖依赖性胰岛素的合成,并激活了PI3-K/AKT信号通路[93]。
此外,通过直接递送抗糖药物,也可以达到治疗糖尿病的效果。D-塔格糖是一种新型低热量糖,对人体健康有许多益处,可以降低血糖、控制肥胖,并表现出强烈的抗生物膜作用。D-塔格糖可以作为食品添加剂添加到饮料、食品和保健品等产品中,替代蔗糖、葡萄糖、麦芽糖等传统高能量糖类,是糖尿病患者的理想糖原。分泌L-阿拉伯糖异构酶的重编程乳酸乳杆菌具有体内原位生产D-塔格糖的能力,对糖尿病小鼠显示出良好的降血糖作用[94]。
靶向代谢性疾病的微生态疗法总结见表2。

表2 靶向代谢性疾病的微生态疗法Tab.2 Intestinal microecological treatment for metabolic diseases
续表
3 靶向精神疾病的微生态疗法
精神疾病是一组复杂的心理综合征,主要表现为认知或行为的不同程度障碍[95]。近年来,随着生活方式的改变(如长期酗酒和使用抗生素等),精神疾病的发病率逐年攀升,精神疾病患者也因此面临着沉重的健康和经济负担。常见的精神疾病包括抑郁症和阿尔茨海默症等,这些重大脑疾病都是我国即将启动的“脑计划”中重点支持的方向。目前,精神疾病的发病机制尚不完全明确,具有多种研究学说,基于这些学说开发的药物仅在部分患者中表现出缓解作用。因此,研究人员要想实现精神疾病的精准治疗,必须挖掘新的发病机制和治疗靶点。肠道菌群被认为是治疗精神疾病的下一个潜在靶点。它们可通过具有双向调节作用的肠-脑轴与大脑发生联系,从而影响大脑的发育并调节宿主行为,所以基于肠道菌群开发的新疗法有望把精神疾病患者从沉重的疾病负担中解脱出来。
3.1 抑郁症
抑郁症(depression)是临床精神科中一类常见的精神疾病,也是导致残疾和自杀的常见原因之一[96]。它具有患病率高、复发率高和疾病负担沉重等特点。单胺假说、神经内分泌假说等都是目前较为公认的抑郁症病因假说[97],但针对这些假说开发的现有抗抑郁药物对部分患者来说是无效的,这提示抑郁症可能还存在其他的病理生理学机制。其中,肠道微生态失衡导致抑郁症发病的机制受到越来越多研究人员的关注[98]。Zheng等[99]对接受健康志愿者或抑郁症患者肠道菌群的无菌小鼠进行比较研究,发现接受抑郁症患者菌群的小鼠表现出相似的抑郁样行为且其碳水化合物和氨基酸代谢过程发生紊乱。另外,Strandwitz等[100]利用共培养方法鉴定出一系列与抑郁症呈负相关的产γ-氨基丁酸(GABA)的拟杆菌属,Medina-Rodriguez 等[101]通过分析应激诱导的抑郁小鼠的肠道菌群阐释了分节丝状菌通过自体诱导物Ⅱ类分子诱发小鼠抑郁样行为的机制。这些发现都为阐明肠道菌群失调与抑郁症的关系带来了新启发,也为抑郁症的防治提供了新思路。
精神益生菌(psychobiotics)有望成为治疗抑郁症的新兴疗法。精神益生菌是一类可产生并递送神经活性物质的益生菌,最早是由科克大学的神经药理学家John Cryan 和精神病医生Ted Dinad[102]于2013 年共同提出的。精神益生菌可通过调节肠-脑轴的平衡起到抗抑郁作用。与传统的抗抑郁药物不同,精神益生菌的疗效好副作用小,且具有改善焦虑和失眠等症状的多种生理功能,是治疗抑郁症的潜在药物。产生GABA 等神经递质是精神益生菌的一个重要标志性特征。婴儿双歧杆菌、瑞士乳杆菌和干酪乳杆菌等乳酸菌都是常见的精神益生菌,也是产生GABA 的重要微生物[103]。然而许多乳酸菌在合成GABA 方面显示出菌株特异性,不同菌株的GABA 生产能力差异很大。因此,通过基因工程定向调控GABA 代谢通路是开发GABA 高产菌株的重要途径。提高GABA 产量的直接方法是过表达谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)基因[104-105]。此外,还可以通过利用葡萄糖直接生产GABA。为此,Van Dung 等[106]通过进行谷氨酸合酶、谷氨酸脱羧酶和GABA 转运蛋白的共定位,将三羧酸循环通量重定向到GABA 途径中,构建了从头合成GABA的大肠杆菌重组菌株。然而此类研究目前只停留在如何利用合成生物学和代谢工程技术对益生菌进行途径改造提高产量的阶段,未真正用于抑郁症等精神疾病的治疗研究。基于成熟的构建策略,将已有的高产菌株与疾病防治研究相结合,开发从肠道着手治愈大脑的新疗法,将会为抑郁症的治疗带来新发现。
3.2 阿尔兹海默症
阿尔兹海默症(Alzheimer disease,AD)是一种以进行性认知功能障碍和记忆障碍为特征的中枢神经系统疾病[107]。目前全球有超过5000万人正在遭受AD 的影响,但AD 的治疗仍然无药可循。AD 的具体发病机制并不清晰,但有越来越多的研究表明肠道菌群与AD 之间具有紧密的联系。与健康对照个体不同,AD 患者的菌群多样性降低,脂多糖、淀粉样蛋白等内源性有害渗出物增加[8]。这些有害渗出物有可能进一步发生“泄漏”,通过体循环到达大脑部位诱导炎症级联反应,从而增加AD的发病风险[108]。
肠内释放对大脑有益物质的工程益生菌或许可作为AD 的直接或辅助疗法,成为临床治疗脑部疾病的新选择。GLP-1除抗糖减脂作用外,可通过与神经细胞的树突膜或胞体膜上的受体结合预防β-淀粉样肽的毒副作用,从而阻止或逆转神经退行性病变过程。陈廷涛团队[109]已经通过在乳酸乳球菌乳脂亚种中引入合成GLP-1 的基因片段,构建了高效表达GLP-1 的工程益生菌。连续摄入这类工程菌的AD 小鼠的空间学习记忆障碍得以恢复,脑部的炎症反应和海马区β-淀粉样蛋白的积聚减少。这些指标的改善主要与肠球菌等病原菌的生长被抑制、MAPKs 和PI3K/Akt 的磷酸化反应被破坏等过程相关[110]。此外,还有研究发现,鲨肌醇和多功能蛋白质p62 也可以与β-淀粉样肽相互作用,减轻脑部的炎症反应。因此,Yamaoka 等[111]操纵枯草芽孢杆菌的肌醇代谢途径将肌醇转化为了鲨肌醇,构建了用于生产鲨肌醇的细胞工厂;Cecarini 等[112]使用编码p62 蛋白的工程乳酸乳杆菌,开发了用于治疗早期AD 小鼠的活菌生物制剂。综上所述,工程益生菌在防治AD 方面展现出了广阔的前景,但到目前为止此类研究还多停留在细胞水平,因此针对此类工程益生菌有必要进一步开展体内外验证和机制探究工作。
靶向精神疾病的微生态疗法总结见表3。

表3 靶向精神疾病的微生态疗法Tab.3 Intestinal microecological treatment for mental illness
4 新一代微生态疗法——人工合成肠道菌群
如上所述,益生元、益生菌、FMT 和工程益生菌在调节肠道微生态环境和防治重大慢病方面确实各有所长。然而,这些微生态疗法的功能还是相对单一。因此,有必要开发新型微生态疗法来完善现有的治疗策略。人工合成肠道菌群是新一代微生态疗法。人工合成肠道菌群的构建允许以较低的复杂性利用改造的肠道微生物生成已定义的系统。人工合成肠道菌群能提高对环境胁迫因子的鲁棒性,提高对复杂任务的功能可编程性[113]。尽管人工合成菌群已在能源开发、环境保护等领域进行了广泛的应用基础研究[34],然而靶向肠道微生态的人工合成菌群的研究仍处于初级阶段,面临着一系列的机遇与挑战(图2)。
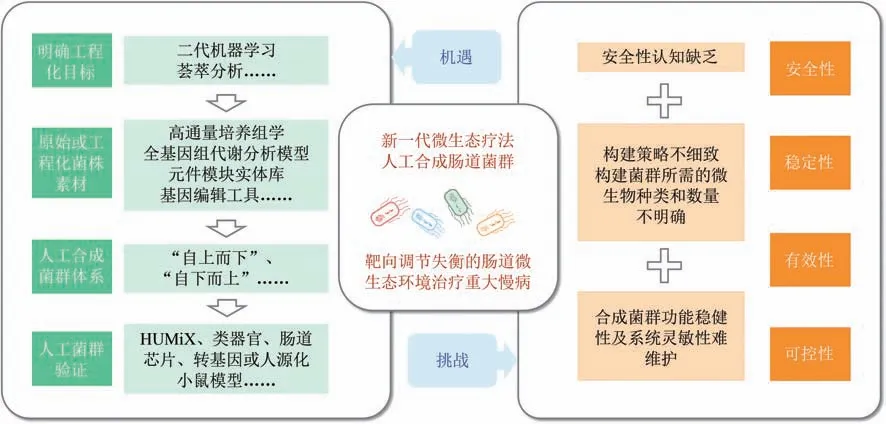
图2 肠道微生态疗法面临的机遇与挑战Fig.2 Opportunities and challenges for gut microbiome therapeutics
生物信息学、微生态学和合成生物学的快速发展加速了以合成肠道菌群为基础的治疗方法的研究。首先,明确肠道微生物群落中的种间相互作用对于设计合成综合群落至关重要。评估微生物相互作用的一种简单有效的方法是直接测量在共培养体系中生长的微生物物种的表型,对所有可能的两两相互作用进行研究。虽然这种方法在了解相对较少的群落时非常有效,但当我们试图了解包含成百上千物种的肠道微生态系统时,需要有补充策略如二代机器学习[114]和荟萃分析[115]等。这对了解重大慢病状态下肠道菌群之间复杂的相互关系及可能的生物机制具有重要作用,可以帮助研究人员从交互数据集中提取尽可能多的信息,从而鉴定健康或疾病状态下的核心菌株或菌群、明确工程化的目标。其次,高通量培养组学[116]、宏基因组学[117]、全基因组代谢分析模型[118]、“即插即用”元件模块实体库和CRISPR 基因编辑工具[119]等技术平台的开发优化,扩大可选择的合成生物学底盘的同时也对益生菌株实现了更高水平的控制。随后,自上而下、自下而上等指导策略的提出,使以工程益生菌为基石的人工合成菌群的构建成为了可能[120]。最终,研究菌群药代动力学和药效学的新工具的开发,如HUMiX[121]、类器官[122]、肠道芯片[123]、转基因或人源化小鼠模型[124-125]等,将进一步明确人工合成肠道菌群“功能多样性与物种多样性”“功能冗余与系统鲁棒性”的关系,指导候选药物选择和药物开发过程,使药物开发人员能够从临床前数据的集合中推断人体给药方案,为临床试验设计的剂量选择提供信息。
虽然目前已有许多先进设计理念和技术的支持,但人工合成肠道菌群的研究并不顺利。首先,细菌作为基因载体治疗疾病的概念早在20 世纪90 年代就被提出[126],但出于对基因工程安全性认知的缺陷,到目前为止真正用于临床研究的工程菌还是寥寥无几。工程菌确实存在将自身携带基因转移给其他微生物的部分风险。但许多研究已经通过编辑细菌的染色体而非质粒来避免此类风险[127-128]。此外,研究人员还尝试通过构建营养缺陷型菌株,使工程菌无法在自然环境中存活,来减少工程菌转移到其他宿主体内的机会[129]。这些方法确实成效显著,但没有完全规避基因转移等风险。免疫学家Carding 等[130]通过研究依赖胸苷存活的卵形拟杆菌发现,细菌间的基因交流导致了插入基因的随意扩散,从而使卵形拟杆菌具有了合成胸苷的能力。因此,在利用工程益生菌构建人工合成肠道菌群之前,需要通过实验明确工
程益生菌的安全性。基因组学[131]、蛋白组学[132]等组学数据可以帮助研究人员获得不具有致病基因等潜在危害因素的肠来源的益生菌底盘细胞,从而减少有害基因转移事件的发生。MetaCHIP 等生物信息学分析工具可以通过分析群落水平上的基因转移事件,帮助研究人员明确工程益生菌的潜在安全问题,从而使工程益生菌在解决未满足医疗需求的关键领域时能得到公众认可[133]。其次,传统微生物群落研究一般采用自上而下或自下而上的策略,自下而上策略通常又有赖于群体感应系统或营养互补关系。Vedanta Biosciences 公司研发的由11 种微生物组合而成的先导药物VE800,联合Opdivo 疗法已经进入了一期临床试验[134]。基于群体感应系统[135]或交叉喂养策略[136]开发的人工合成肠道菌群,已经成功预测了细菌群落的动态变化,增加了复杂环境中种群的均匀性。然而,目前还没有通过利用工程益生菌构建人工合成肠道菌群用于重大慢病诊疗的相关研究。因此,先前的构建策略需要进一步规范细化,构建菌群所需的微生物种类和数量需要明确标准,以适应人工合成肠道菌群的构建。另外,与其他传统的治疗方式不同,人工合成肠道菌群是一个活的并不断生长的复杂微生物群体,它们与肠内微生物及宿主之间不断发生复杂的相互作用。因此在体外研究中表现良好的人工合成肠道菌群的体内效果可能也会出现治疗效果不佳的状况,最终导致研究的失败。所以明确人工合成肠道菌群各成员的体内生长状况、移植表达产物的安全剂量、与肠道微生物组现有成员的合作竞争关系及与宿主的相互作用对人工合成肠道菌群的优化升级至关重要。最后,合成菌群系统的稳健性及灵敏性需要不断维护优化,才能使其在病理条件存在或消失的情况下自动切换治疗和非治疗状态,以应对复杂的慢病状况。通过基因工程分泌卷曲纤维形成的水凝胶可原位包裹和保护工程益生菌,提高工程益生菌的稳健性[137]。低氧或低pH 启动子可控制工程益生菌在肠道内的响应情况,增加工程益生菌的灵敏性[138]。这些单菌水平上的策略对人工合成菌群系统的构建也具有指导作用,有利于提高人工合成菌群系统的稳定性和灵敏性。
5 总结与展望
居住在人体肠道内的微生物群与宿主形成了密切的共生关系,对维持宿主健康具有重要作用,同时它也是消化系统疾病、代谢性疾病和精神疾病等重大慢病防治的关键靶点。目前,许多研究已经强调了以肠道微生物为靶点的益生元、益生菌和FMT 疗法在重大慢病防治方面的重要作用。然而,由于安全性低、可控性差等问题的存在,这些传统微生态疗法的治疗效果并不总是可靠的。作为另一种选择,利用合成生物学技术开发的工程益生菌则表现出更高的稳健性和可控性,成为了下一代微生态疗法的重要组成。合成生物学技术可促进工程益生菌在肠道内的定植和生长。利用合成生物学技术在益生菌表面展示配体、表达生物膜形成成分、合成黏附素或分泌卷曲蛋白[139],可提高工程益生菌在肠黏膜上的黏附作用,改善工程益生菌的肠道定植策略,保护工程益生菌免受黏膜更新和胃酸的破坏作用,从而提高其稳健性。合成生物学技术还可以增强工程益生菌的可控性,使工程益生菌在感知特异性群体感应信号分子[140]或非正常氧浓度[128]后才释放治疗药物。此外,工程益生菌的可控性还可以通过设计营养缺陷型菌株来实现,从而确保工程益生菌的生物安全性[129]。目前,利用合成生物学技术,单菌的定制改造已初步实现。许多初创公司也已经筹集了数亿美元,启动了相关临床试验。其中,合成学生物公司Synlogic被认为是这一领域的先驱。其用于治疗苯丙酮尿症的候选产品SYNB1618[141]和SYNB1934[142]目前已经通过二期临床试验,并有望进入三期临床试验。Synlogic公司也正在评估用于治疗肠高草酸尿症、实体瘤和IBD 等疾病的候选药物。此外,美国活体生物药公司Novome Biotechnologies 也针对肠源性高草酸尿症开发了候选药物NOV-001,其一期临床试验结果表明该药物中的工程菌株能够在肠道内安全定植,二期临床试验也正在进行中。虽然目前多家公司都在开展利用工程益生菌治疗重大慢病的临床研究,但还没有一株工程益生菌获得美国食品和药物管理局的批准[143]。一些前期临床试验结果呈阳性的工程益生菌也未能通过后期的临床试验,这可能与复杂肠道微生态环境密切相关。
因此,考虑到单一工程益生菌负荷低、抗干扰能力弱、执行复杂功能受限等问题,人工合成肠道菌群有望成为新一代的微生态疗法。合成生物学应用于人工合成肠道菌群构建有独特优势,可塑性强。合成生物学可以根据不同个体的肠道微生态环境改造微生物构建人工合成肠道菌群,同时检测多种疾病标志物开发精准诊断产品,在不对其他细胞或组织产生损伤的情况下进行个性化治疗、维护肠道健康。尽管合成生物学技术在人工合成肠道菌群研究中发挥着独特的作用,具有较大的应用潜力,但仍有较多问题亟待解决。如何确保工程益生菌的安全性、如何规范构建策略、如何明确人工合成肠道菌群的疾病诊疗机制、如何确保人工合成肠道菌群的稳定性等问题仍未得到系统的回答。未来应深化合成生物学、材料学、微生态学等多学科的交叉,充分利用各学科的优势进一步开展人工合成肠道菌群的构建工作,最终设计一套普适性强的人工合成肠道菌群构建方法,助力人类健康产业的发展。

