CRISPR/Cas9及其衍生编辑器在衰老研究中的应用进展
龚仕涛,王宇,陈宇庭
(中国科学院深圳先进技术研究院,合成生物学研究所,基因组工程与治疗研究中心,广东 深圳 518055)
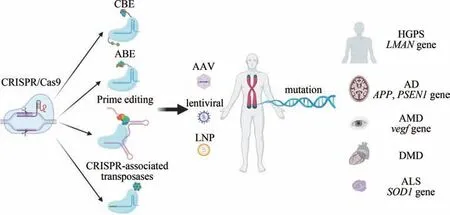
衰老及其相关疾病是威胁人类健康的重要因素之一。如何减缓衰老和减少衰老引发的疾病,使身体保持长时间的健康态,成为大家密切关注的问题。通过生活方式的干预,包括增加锻炼、减少高热量食物的摄入,可以帮助个体保持健康。此外,肠道微生物群的改变、衰老细胞的清除、从年轻个体获得血液因子和使用抗衰老的药物也可以改善个体的健康状况[1]。全面了解衰老过程和限制寿命因素一直是生物学家面临的重要挑战。过去30 年,研究人员对衰老途径的研究,已经从了解衰老表型过渡到研究衰老表型的遗传因素。衰老遗传学的研究揭示了一个复杂的细胞内信号网络和相互作用的过程,显示与衰老相关的基因在其中扮演重要角色[2]。基因突变的积累往往与衰老相关,基因编辑工具可以实现基因突变位点的精确修复,具备从根本上逆转由基因突变导致的衰老表型的潜力。目前已经有很多综述介绍了CRISPR/Cas 系统及其应用,如核酸检测、转录调控、表观修饰、RNA 编辑等[3-6]。本综述主要介绍利用最广泛的第2 类系统中的CRISPR/Cas9 及其变体和Cas蛋白衍生编辑器,并讨论这些基因编辑工具在衰老及其衰老相关疾病研究中的应用进展。
1 CRISPR/Cas系统
在自然界,CRISPR/Cas系统是一种细菌和古细菌中的适应性免疫机制,能够利用RNA指导Cas蛋白核酸酶结合并切割外源核酸[7-8]。这种适应性免疫过程包括3个主要阶段:适应、表达和干扰。在适应阶段,Cas蛋白复合物识别出一个独特的前间隔序列邻近基序(protospacer adjacent motif,PAM),并结合到靶序列,切割靶序列的一部分,并在CRISPR(clustered regularly interspaced short palindromic repeats)阵列的5′末端进行复制,复合体将靶序列片段插入CRISPR 间隔重复序列中,使其成为新的间隔区序列[9-10]。但一些CRISPR/Cas 系统也采用另一种适应机制,通过由基因座编码的逆转录酶进行逆转录,从RNA中获得间隔区。在表达阶段,CRISPR 阵列通常先被转录为CRISPR RNA 前体,然后再被加工为成熟的CRISPR RNA(crRNA),且每个crRNA 都包含间隔序列和部分侧翼重复序列[11]。然而,不同的CRISPR 系统,crRNA 前体的加工也是不同的,分别是由多蛋白Cas 复合物的不同亚单位、单体多结构域Cas 蛋白或非宿主RNA 酶介导。在干扰阶段,crRNA 与Cas 蛋白结合形成的复合物,可以通过crRNA 识别病毒或入侵质粒的核酸序列,然后具有核酸酶活性的Cas蛋白可以切割和失活靶序列[12-13]。根据这种靶向识别切割机制,研究人员重编程设计gRNA(guide RNA)中间隔序列,可广泛地靶向DNA 或RNA 序列[14-17]。
天然存在的CRISPR/Cas 免疫系统分为两大类型:第1类型是具有核酸酶切的活性多亚基效应复合物;第2 类型是具有核酸酶切活性的单体蛋白[18-19]。由于单体蛋白的优势,第2 类型系统是生物研究和转化应用最广泛的CRISPR/Cas系统。第2类型可以细分为三亚型:Ⅱ、Ⅴ与Ⅵ,每一类亚型都有一种不同的Cas 蛋白[18,20-21]。在第2 类型系统的Cas 蛋白中,常用的是Ⅱ型Cas9 变体和Ⅴ型Cas12 变体,具有RNA 引导的DNA 内切酶活性,而Ⅵ型Cas13变体具有靶向和切割RNA的活性[22]。
2 Cas9蛋白及其变体
Ⅱ型CRISPR系统的Cas9蛋白是通过RNA引导的核酸内切酶,可以在DNA靶向序列中产生双链断裂[16]。在自然条件下,Cas9需要crRNA和反式激活的crRNA(trans-activating crRNA,tracrRNA)共同引导,才能识别外源DNA并进行切割[11]。然而,大多数Cas9 介导的基因组编辑是使用单一向导RNA(single guide RNA,sgRNA),即将crRNA和tracrRNA 融合成单个RNA 分子[23]。靶位点识别开始于sgRNA和Cas9蛋白形成复合物,并与PAM 同源序列结合,随后双链DNA 解链,并在gRNA 和靶DNA 序列之间形成RNA-DNA 异源双链[16]。当非靶向DNA 链被gRNA 取代时,形成了单链DNA“R 环”,使其暴露并被其他分子接近[24]。在R 环形成后,Cas9 构象发生变化,其核酸酶结构域被活化[25-26]。最后,DNA 的磷酸二酯骨架被Cas9 的两个核酸酶结构域水解:HNH 核酸酶结构域负责切割sgRNA 结合的靶DNA 链;RuvC 样核酸酶结构域负责切割含PAM的非靶向DNA链(图1)。
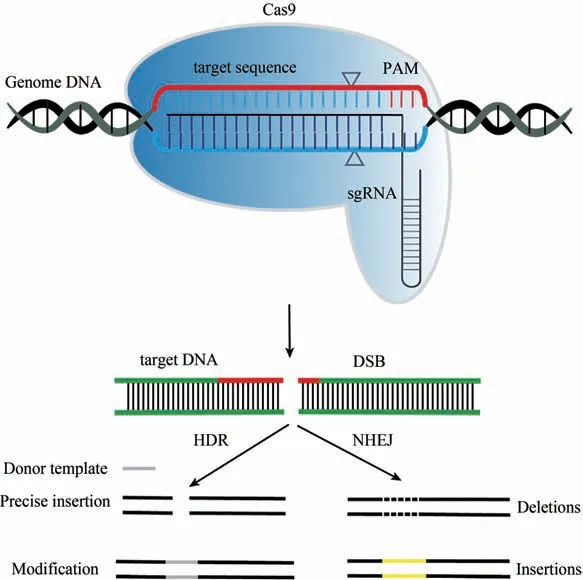
图1 CRISPR/Cas9作用Fig.1 Schematic diagram for CRISPR/Cas9
精确编辑是基因编辑技术得以广泛应用的重要前提,在一定程度上依赖于sgRNA/Cas核糖核蛋白从全基因组范围中区分靶向序列与相似的非靶向序列的能力[27]。为了提高Cas9 蛋白的靶向特异性,研究人员设计和优化了一些Cas9变体,具有较低的非靶向编辑活性(表1)。筛选得到的K848A、K1003A和R1060A突变组合eSpCas9(1.1)在人类细胞中展示出高效精确的基因组编辑[43]。SpCas9-HF1是通过降低Cas9-sgRNA复合物和目标DNA之间的结合亲和力,来减少其脱靶效率[44]。HypaCas9(N692A、M694A、Q695A和H698A)是一种利用复合物构象变化机制设计的SpCas9变体,展现出高的靶向切割活性与降低脱靶比例[45]。研究人员利用酵母正负向筛选得到evoCas9[46],表现出高保真性。利用类似策略,研究人员在大肠杆菌筛选得到Sniper-Cas9,使用缩短的sgRNAs 或正常sgRNAs均可展现与野生型相似水平的靶向编辑活性[47]。此外,CRISPR/Cas 系统以RNP 复合物的形式来靶向基因组,通常会降低脱靶水平[48]。最近,SpCas9的一种单点突变体HiFiCas9(R691A),通过RNP递送时显示出更低的非靶向编辑[49]。截短的sgRNAs 可以将非靶向编辑效率降低多达3 个数量级,同时保持高水平的靶向编辑[50]。
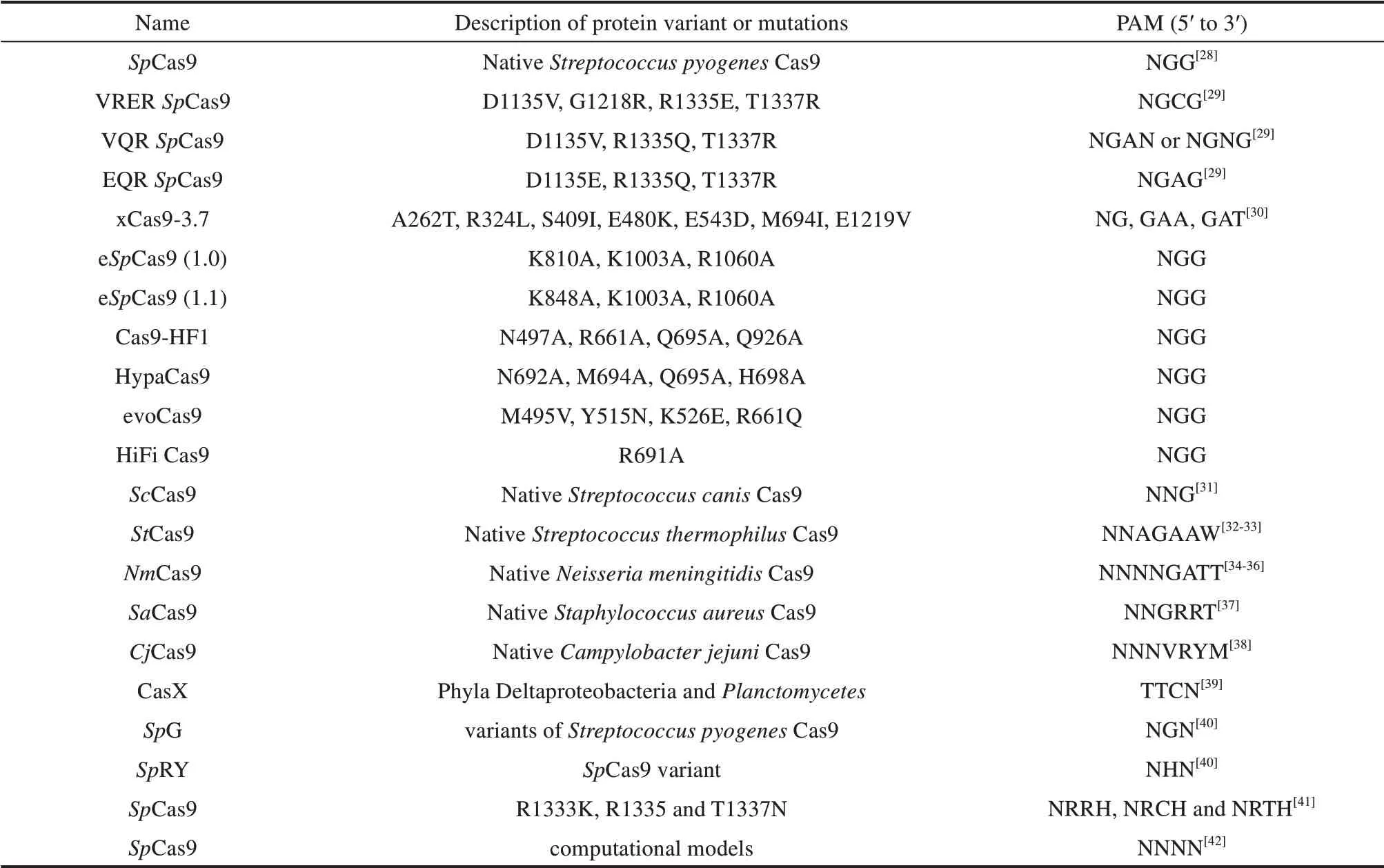
表1 Cas9变体及所识别的PAM序列Tab.1 Cas9 variants and identified PAM sequences
扩大CRISPR/Cas 的基因组靶向范围一直是技术发展的焦点。Cas蛋白结合靶序列,需要PAM序列的存在[7,30,46,51]。研究人员发现了许多Cas9 直系同源物,能够识别不同的PAM序列[52-53],可实现大部分基因组序列的靶向编辑。利用合理的蛋白结构设计和定向进化,研究人员获得SpCas9-EQR、SpCas9-VQR 和SpCas9-VRER 等SpCas9 变体,可分别 识 别NGAG、NGA 和NGCG PAM 序 列[29]。通过噬菌体连续进化(PACE)和细菌的选择,将噬菌体复制与PAM 相容性联系起来,研究人员发现了xCas9-3.7 等变体,在非NGG PAM 序列(特别是NGT 和NGA PAM) 上显示出比野生型SpCas9 更高的活性,且降低了其在哺乳动物细胞中的脱靶效率[30]。通过结构导向的设计,科学家们发现了SpCas9-NG,可以识别所有NG PAM 序列,表现出不同的编辑效率,但在多数情况下比xCas9-3.7 具有更高的效率[53]。最近,David Liu 实验室利用噬菌体的连续和非连续进化产生了3种新的SpCas9 变体,SpCas9-NRRH、SpCas9-NRCH 和SpCas9-NRTH,其活性高于xCas9-3.7,可共同识别靶向几乎任何天然序列[41]。研究人员使用结构引导的方法开发了SpG 和SpRY 变体,分别识别NGN 和NRN/NYN(Y 是C 或T)PAMs,其 中NRN比NYN的识别效率更高[40]。此外,一种嵌合Cas9 蛋白的Spy-mac Cas9 能够识别NAA PAM 序列[54]和高活性ScCas9 变体可识别NNG PAM 序列[55]。通过对PAM 相互作用结构域的突变和细菌选择,研究人员开发了SaCas9-KKH 变体[56],可以识别NNNRRT PAM 序列,与野生型SaCas9 相比,其靶向范围扩大了4 倍。具有高特异性的FnCas9,通过合理的方法设计,可以识别YG PAMs,而不是其原来的NGG PAM[57]。这些Cas9变体的发明,极大扩展了CRISPR/Cas 系统的基因组靶向能力,增强了其应用能力。
3 基于Cas9的衍生编辑器
研究人员基于Cas蛋白研发了多种精确的基因编辑器,如碱基编器、引导编辑器、转座/重组酶等[58-63](图2)。CRISPR/Cas 及其衍生的编辑器,可以实现多种形式精确的基因编辑,满足人们对不同的基因改造的需求。
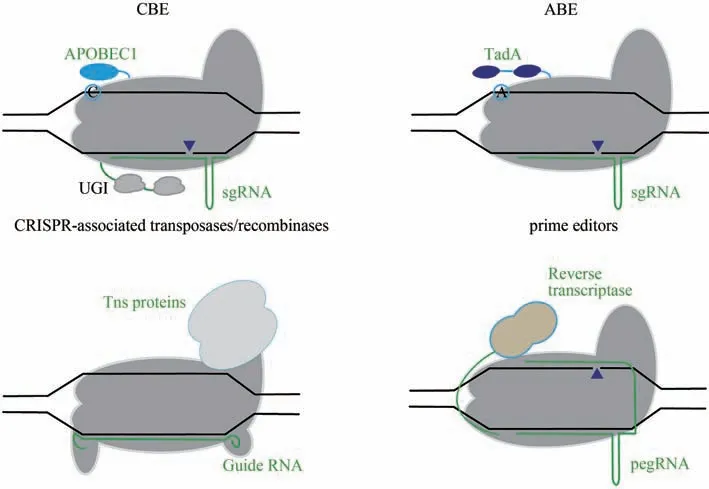
图2 CRISPR/Cas衍生编辑器的作用Fig.2 Schematic diagram for CRISPR/Cas-derived editors
3.1 碱基编辑器
由任何一个核酸酶结构域突变失活产生的nCas9 切口酶,和两个核酸酶结构域均失活产生的dCas9,仍可以与sgRNA 一起结合到特定的DNA序列[64]。研究人员通过将nCas9 与碱基脱氨酶融合,发明了碱基编辑器。该碱基编辑器可以精确实现基因组目标碱基的替换,而不需要DSB 或供体DNA模板,也不依赖HDR。
目前,主要有两类碱基编辑器:胞嘧啶碱基编辑器(CBEs)[65],催化C→T/G→A 碱基对的转换;腺嘌呤碱基编辑器(ABEs)[66],催化A→G/T→C 转换。CBEs 和ABEs 可以实现4 种碱基突变(C→T/G→A、A→G/T→C),约占目前人类致病突变的30%[67]。在CBEs 和ABEs 中,sgRNA 指导nCas9可将ssDNA 脱氨酶定位于基因组靶序列。在Cas 蛋白结合时,gRNA 与靶序列杂交引发位移,形成ssDNA R环[16]。PAM-远端核苷酸以ssDNA形式暴露,可被脱氨酶结构域催化[68]。胞嘧啶脱氨酶可将R环内的胞嘧啶转化为尿嘧啶,尿嘧啶被DNA聚合酶识别为胸腺嘧啶,然后在DNA 的修复过程中将C·G转换为T·A[65]。类似地,ABE是通过蛋白进化得到的TadA 腺苷脱氨酶将R 环内的腺苷转化为肌苷,后者被DNA聚合酶识别为鸟嘌呤,将A·T转换为G·C[69]。R 环内目标核苷酸的碱基编辑依赖于脱氨酶和底物核苷酸之间的有效相互作用,且R环内高效碱基编辑的核苷酸位置被定义为碱基编辑“活性窗口”。SpCas9 衍生的CBEs 和ABEs 的活性窗口通常是前体间隔序列的4~8位置,但也受染色体结构、不同位置或细胞类型的影响[65-66]。研究人员通过融合表达两个尿嘧啶糖基化酶抑制剂蛋白(UGIs)、使用nCas9 替换dCas9、优化融合蛋白之间的连接序列、优化密码子和核定位序列,得到了CBEmax和ABEmax 的变体,显著提高了碱基编辑器在哺乳动物细胞和体内的编辑效率[70]。随后,科研人员通过对碱基编辑器进行进一步优化与改造,提高了它们在基因组的靶向范围、扩大编辑活性的窗口以及减少脱靶和编辑副产物[59,61]。
近期,研究人员通过胞嘧啶脱氨酶的突变优化筛选,研发出CGBE,可以催化C→G/G→C 的碱基转换[71]。研究人员还通过将胞嘧啶脱氨酶和腺苷脱氨酶同时与催化缺陷的nCas9融合,得到可以同时实现C→T/G→A 和A→G/T→C 替换的编辑编辑器[72-73]。
3.2 引导编辑器
哺乳动物基因组中与疾病相关的突变存在多种形式,需要通过基因编辑工具进行纠正,更需要精确引入碱基的编写,例如碱基替换,小片段的插入和缺失。通过核酸酶产生DNA 双链断裂后,虽可通过NHEJ 引入插入和缺失,或者通过HDR 精确改变,但往往会伴随各种错误的编辑。碱基编辑器可以实现C→T/G→A、A→G/T→C 的编辑,但是其他形式的碱基替换还无法实现[74]。此外,当在编辑活性窗口存在多个编辑活性位点时,也会存在一定的脱靶效应,且会受到PAM 的限制。引导编辑器可以实现12 种点突变的转换和小片段的插入与缺失。引导编辑器是nCas9和结构优化的逆转录酶融合形成的功能蛋白,通过pegRNA(prime editing guide RNA)可以靶向编辑目标序列。当结合到靶向序列后,Cas9 RuvC 核酸酶会在含PAM 的DNA 链形成缺口。逆转录酶以pegRNA 作为模板合成所需编辑的序列,DNA 在修复的过程中将编辑序列留存在基因组中,实现靶位点的编辑[74]。引导编辑已经被应用在多种人类细胞系和小鼠皮质神经元[74]、人诱导多能干细胞[75]和T 细胞[76]、小鼠胚胎[77]和斑马鱼胚胎[76]等。目前引导编辑器的编辑效率还不高,且会产生较高水平非靶向编辑的副产物,但通过pegRNA的设计和逆转录酶结构的改进有望改善上述问题[78]。
3.3 dCas9融合的转座酶/重组酶
在活细胞中实现大片段靶向整合,一直是基因组编辑领域的难点。通过Cas蛋白与转座酶形成的融合蛋白,可以将外源基因整合到基因组中。研究人员通过dCas9 和Himar1 转座酶的融合,使用靶向的sgRNA,可以实现在大肠杆菌胞内质粒上介导靶向DNA 序列整合[79]。此外,研究人员还报道了CRISPR 相关转座子酶(CRISPR-associated transposase,CAST),可以在E.coli实现转座子酶活性[80]。Cas融合重组酶可以插入、删除、倒置或替换目标DNA。Ginβ 重组酶和dCas9 的融合,通过两个相邻的gRNA,形成必需的二聚体,可进行靶向重组。这种编辑系统可以在哺乳动物细胞中修饰质粒底物,也能实现低效率的大片段基因组的删除,但对目标序列有大量限制[81]。因此,进一步研发识别基因组的靶向转座子,改造CRISPR和重组酶,可实现在基因组中精确重排大片段的DNA序列[32,82-84]。
4 CRISPR/Cas 系统工具在衰老研究中的应用
衰老的特点是随着时间的推移,维持机体平衡的能力下降,增加许多慢性疾病和退行性疾病的患病风险,最终导致个体死亡[85]。衰老受多种基因和表观遗传因素的影响,增加了研究衰老表型及相关疾病的难度[86]。为了解影响细胞衰老的遗传和表观遗传学因素,研究人员在Werner 综合征(Werner syndrome,WS)病人来源的人间充质前体细胞(human mesenchymal progenitor cells,hMPCs)中,进行了全基因组靶向基因失活筛选。通过筛选,研究人员发现一些基因的缺失可减轻细胞衰老,如KAT7 的失活可在两种早衰hMPC 模型中减轻衰老表型。接着,通过静脉注射编码Cas9/sgRNA-Kat7 的慢病毒载体,可以延长生理衰老小鼠和早衰小鼠的寿命。基于Cas9 筛选是一种系统性发现与衰老相关基因的方法,这些衰老基因也可能被发展为抗衰老的治疗靶点[87]。此外,CRISPR/Cas 系统及其衍生编辑器可以在多种传统衰老模型中操控和调节基因功能,将揭示基因在端粒损伤、表观遗传失调和细胞衰老的作用,也将大大加速新的动物和细胞衰老模型的建立,用于研究衰老疾病的病理及研发抗衰老的治疗策略。
4.1 早衰综合征
早衰综合征(Hutchinson-Gilford progeria syndrome,HGPS)是由于LMNA基因(编码核结构蛋白lamin A)在11 号外显子产生了同义突变(c.1824C>T;p.Gly608Gly),导致RNA 错误剪接,从而产生早衰蛋白(progerin)[88]。早衰蛋白是一种诱导早衰症儿童快速衰老,并将其寿命缩短至大约14 岁的有毒蛋白质,因此,通过CRISPR/Cas系统来降低progerin 蛋白的表达量,可能是一种有效的治疗手段。研究人员用慢病毒CRISPR/Cas 系统,可以降低小鼠和人早老症成纤维细胞中progerin的蛋白量并恢复了异常的核型。在新出生3 天HGPS 小鼠模型的腹腔内注射了AAV-CRISPR 病毒,能有效降低小鼠体内progerin 的蛋白量,显著改善小鼠的健康状况[89]。在另一项研究中,研究人员把AAV9-gRNAs 通过面部静脉给药的方式注射入HGPS-Cas9 小鼠模型体内,发现小鼠的皮肤、心血管系统和肌肉抓力等指标显著变好,整体健康状态得到改善,并显著延长了小鼠的寿命[90-91]。最近,研究人员使用ABE 直接纠正来自早衰症儿童的成纤维细胞和HGPS 小鼠模型的致病性HGPS突变。慢病毒将ABE 传递给HGPS 患者的成纤维细胞,可以实现87%~91%的致病性等位基因的纠正、RNA 错误剪接的缓解、progerin蛋白水平的降低和细胞核异常的改善。在人类LMNAc.1824纯合的转基因小鼠中,通过单次眼球注射编码ABE 靶向对C>T 等位基因的腺相关病毒(AAV9),可显著、持久地纠正致病性突变(注射6个月后各器官约20%~60%纠正效率),恢复正常RNA 剪接,并降低progerin蛋白水平。在出生后第14天,单次注射表达ABE 的AAV9 可以提高小鼠的活力,并大大延长小鼠的中位寿命(从215 天延长到510 天)。这些研究表明,体内碱基编辑技术可直接纠正导致HGPS和其他遗传疾病的点突变,可能成为一种治疗HGPS和其他遗传疾病的治疗方法[91]。
4.2 心血管疾病
在心脏疾病治疗中,具备靶向编辑心肌细胞的能力非常重要,因为心脏不具有典型的干细胞群。CRISPR/Cas 系统可以在非分裂的细胞内进行基因组编辑。研究人员开发了一个在心肌细胞中特异性表达Cas9 的小鼠模型,通过向小鼠注射携带靶向特异基因的sgRNAs的AAV病毒,可以实现靶向心肌细胞内的任何基因[92],可用于纠正心肌细胞中存在的致病性突变[93]。
4.3 年龄相关性黄斑变性
年龄相关性黄斑变性(age-related macular degeneration AMD)是老年人失明的主要原因,但目前对湿型AMD 的治疗依赖于频繁的眼部药物注射,费用昂贵,对患者来说经济负担较重。CRISPR/Cas可以永久改变导致湿性AMD的基因突变,成为一种治疗湿性AMD 的潜在疗法。目前抗血管内皮生长因子(anti-VEGF)药物是治疗湿性AMD 的重要选择。研究人员将靶向vegf基因的Cas9核糖核蛋白(RNA-binding protein,RNPs)注射到成年小鼠眼睛,实现了在视网膜色素上皮细胞的靶基因进行编辑,阻止了新生血管形成。Cas9 RNPs有效减少AMD小鼠模型中激光诱导的脉络膜新生血管(choroid neovascularization,CNV)的面积,改善模型小鼠的视力[94]。
4.4 神经退行性疾病
近年来,CRISPR/Cas编辑工具在研究肌萎缩性脊髓侧索硬化症(amyotrophic lateral sclerosis,ALS)、阿尔茨海默病(Alzheimer's disease,AD)、帕金森病(Parkinson's disease,PD)等年龄相关神经退行性疾病的分子发病机制方面也做出了重要贡献。
肌萎缩性脊髓侧索硬化症(ALS)是一种致死性疾病,由超氧化物歧化酶1(SOD1)基因突变引起。ALS 目前是不可治愈的,但CRISPR 碱基编辑器具有产生无义突变的能力,有可能成为治疗这种疾病的方法。无义突变可以使SOD1基因表达永久失效。研究人员将编码CBE 碱基编辑器的DNA 拆分并装到两个AAV 载体上,然后将两种AAV 病毒注射到遗传性ALS 小鼠模型体内,沉默了致病基因的表达,改善了小鼠的病理症状,并延长小鼠的寿命[95]。
阿尔茨海默病(AD)是一种主要的神经退行性疾病,其特征是脑中淀粉样蛋白斑块和神经纤维缠结的形成。这些异常蛋白的聚集会导致进行性神经元丧失、造成严重的认知障碍和痴呆,最终导致患者过早死亡。研究人员利用CRISPR/Cas9,在人类iPSC 细胞系中高效建立了淀粉样前体蛋白(amyloid precursor protein,APPSwe)和早老蛋白1(presenilin proteins,PSEN1M146V)基因的纯合子和杂合子突变,并诱导分化形成神经元,且这些细胞表现出基因型依赖的疾病相关表型。在另一项研究中,研究人员将携带早老蛋白2(PSEN2)突变的患者来源的人类诱导多能干细胞转化为基底前脑胆碱能神经元,然后对其进行靶向编辑,纠正突变,可以减少Aβ 的产生,恢复神经元正常的电生理功能[96]。通过AAV 或纳米复合物将CRISPR 编辑系统递送到活体小鼠体内,纠正了神经元中的突变[97]。此外,利用CRISPR 靶向APP基因的特定区域,可在人类iPSC 来源的神经元以及成年小鼠大脑齿状回减少Aβ的产生[98]。
帕金森病(PD)是一种常见的神经退行性疾病,仅次于阿尔茨海默病。在世界范围内,估计约有1000万人患有PD 病,且确诊时患者的平均年龄为60 岁,因此帕金森病主要是一种与年龄相关的疾病。CRISPR/Cas9也被用于开发新的PD模型,通过产生携带多个PD 相关基因突变的小型猪,如Parkin、DJ-1 和PINK1[99]。富 亮 氨 酸 重 复 激 酶2(LRRK2)G2019S 是一种相对常见的突变,与全球1%~3%的帕金森病(PD)病例相关。研究人员成功地使用CRISPR/Cas9 介导的同源重组,将LRRK2 G2019S 突变和LRRK2 激酶结构域的截断突变引入狨猴胚胎和诱导的多能干细胞中,建立一种新的PD普通狨猴模型[100]。
5 结语
CRISPR/Cas 系统及其衍生编辑器的发明与优化,改变了生命科学研究的方法和方式,在生命医学基础研究上取得了许多突破性的进展,并为新一代人类疾病疗法的研发奠定了良好的基础。精确且多功能的基因组编辑工具的发明,使我们能够对任何活细胞的基因组进行序列改变,且减少或者不产生编辑副产物。基因组编辑技术的快速发展将我们带入了一个新时代,我们不仅可以编辑及修复人类基因组中的致病突变,也可以编辑那些影响人类生命健康的其他生物体的基因组。这些编辑工具不仅可以用于研究候选基因在基因组中的功能,也可以用于建立有效的疾病动物模型,同时也成为基因治疗的有效工具。但是,CRISPR/Cas 系统及其衍生编辑器仍然存在靶向编辑效率较低的问题,且有脱靶风险,同时也需要更加安全有效的递送工具。
随着全球人口老龄化越来越严重,衰老及其相关疾病将会越来越受关注。引起衰老的原因很多,其中体内细胞基因组突变的积累是其中一个重要原因,基因突变的增加和细胞修复能力的减弱,直接影响细胞正常功能的维持。越来越多精确高效基因编辑工具的发现与广泛使用,不仅可以使我们更加充分地理解衰老基因组与表型组之间的关系,也可以通过编辑或编写基因组,达到抵抗衰老和治疗衰老相关疾病的目的。目前基于CRISPR/Cas9系统及其衍生编辑器的治疗技术尚未获得FDA 的临床批准。如果能够实现临床应用,这些编辑器将会极大地改善人类衰老相关疾病的病理症状、减少疾病负担、降低死亡率,最终实现健康衰老。

