circ_0000285靶向miR-625对缺氧/复氧诱导的心肌细胞氧化应激损伤的影响
庄媛 郝艳丽 黄莺 李延辉 孙颖 李悦 卢云凤 吴涛
缺血性心脏病是由冠状动脉闭塞或狭窄引起的心血管疾病,是世界范围内致残和死亡的主要原因之一。血流恢复是缓解心肌缺血损伤的有效干预手段,然再灌注本身可导致额外的心肌损伤和病理性重构,即心肌缺血/再灌注(I/R)损伤[1]。因此,减弱I/R导致的心肌损害对改善缺血性心脏病患者预后意义重大。环状RNA(circRNA)是由前体mRNA反向剪切形成的单链封闭环结构的RNA分子,通过与miRNA结合调节靶基因表达发挥功能,与心肌梗死、心脏衰老、心脏肥大、动脉粥样硬化发生关系密切相关,是心血管疾病治疗的理想靶点[2,3]。circRNA 0000285(circ_0000285)是一种致癌基因,研究发现糖尿病肾病小鼠和高糖诱导的肾足细胞中circ_0000285表达升高,干扰circ_0000285表达减弱高糖诱导的足细胞损伤[4]。生物信息学预测显示,miR-625是circ_0000285的潜在靶点。miR-625对心肌肥厚具有抑制作用[5]。然而,circ_0000285是否靶向miR-625在心肌I/R损伤中发挥作用并不明确。本研究构建心肌细胞缺氧/复氧(H/R)模型模拟I/R损伤过程,探讨circ_0000285对H/R诱导的心肌细胞凋亡和氧化应激损伤的影响,分析其机制是否与调miR-625表达相关。
1 材料与方法
1.1 材料 大鼠心肌细胞H9C2购于中国典型培养物保藏中心;miRNA检测试剂盒购于美国GeneCopoeia公司;逆转录试剂盒、SYBR-Green PCR试剂盒购于北京天根生化科技公司;针对circ_0000285的小干扰RNA(si-circ_0000285)及其阴性对照(si-NC)、miR-625模拟物及(mimics)其阴性对照(miR-NC)、miR-625抑制物(anti-miR-625)其阴性对照(anti-miR-NC)、双荧光素酶报告载体由北京六合华大基因公司提供;膜联蛋白V-异硫氰酸荧光素(annexin V-FITC)/碘化丙啶(PI)凋亡检测试剂盒购于上海锐赛生物公司;丙二醛(MDA)含量检测试剂盒、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性检测试剂盒北京索莱宝科技有限公司;兔源B细胞淋巴瘤-2蛋白(Bcl-2)、Bcl相关x蛋白(Bax)、磷酸甘油醛脱氢酶(GAPDH)抗体和羊抗源IgG二抗购于美国Abcam公司。微量分光光度计(型号NanoDrop 2000)购于美国Thermo Scientific公司;流式细胞仪(型号CytoFLEX)购于美国贝克曼公司;湿式转膜仪(型号1703930)购于美国BIO-RAD公司。
1.2 方法
1.2.1 H9C2细胞培养、H/R模型构建:用含有10%胎牛血清、1%青链霉素双抗DMEM培养液在37℃、5% CO2、95%空气培养箱中培养H9C2细胞,当在显微镜下观察到细胞60%汇合时,消化细胞,按照1∶4比例传代培养。取对数期H9C2细胞接种缺氧培养基,置于缺氧培养箱(37℃、5% CO2、94% N2)培养3 h,磷酸盐缓冲液洗涤细胞2次,更换为复氧培养基,放置常氧培养箱(37℃、5% CO2、95% 空气)中继续培养4 h,构建H9C2细胞H/R模型[6]。
1.2.2 实时定量PCR(RT-qPCR)检测circ_0000285和miR-625表达:TRIzol试剂提取对照组、H/R组H9C2细胞的总RNA,分光光度计检测RNA质量。采用miRNA检测试剂盒测定miR-625表达。采用逆转录试剂盒、SYBR-Green PCR试剂盒检测circ_0000285表达。GAPDH和U6分别作为circ_0000285和miR-625的内参基因,2-ΔΔCt法计算其相对表达量。circ_0000285上游引物5’-TACCTCTGCAGGCAGGAACT-3’,下游引物5’-TCACATGAATTTAGGTGGGACTT-3’;GAPDH上游引物5’-GCCATCACAG CAACACAGAA-3’,下游引物5’-GC CATACCAGTAAGCTTGCC-3’;miR-625上游引物5’-GCGGCAGACTATAGAACTTT-3’,下游引物5’-CAGTGCGTGTCGTGGA-3’;U6上游引物5’-CGCTTCGGCAGCACATATAC-3’,下游引物5’-TTCACGAATTTGCGTGTCAT-3’。
1.2.3 细胞转染和实验分组:将对数期H9C2随机分为以下组别。对照(Con)组为正常培养的H9C2细胞;H/R组参照上述建模方法;H/R+si-NC组、H/R+si-circ_0000285组、H/R+miR-NC组、H/R+miR-625组、H/R+si-circ_0000285+anti-miR-NC组、H/R+si-circ_0000285+anti-miR-625组为采用脂质Lipofectamine 2000将si-NC、si-circ_0000285、miR-NC、miR-625 mimics、si-circ_0000285+ anti-miR-NC、si-circ_0000285+anti-miR-625分别转染至H9C2细胞,转染48 h后进行H/R处理。
1.2.4 流式细胞术检测细胞凋亡:用胰蛋白酶收集各组H9C2细胞,重悬于结合缓冲液中调整细胞密度为2×105个/ml。取500 μl细胞悬液加入EP管中,随后加入5 μl的annexin V-FITC和5 μl的PI孵育10 min。混匀后,流式细胞仪检测细胞凋亡率。
1.2.5 试剂盒检测MDA含量、SOD和GSH-Px活性:收集各组H9C2细胞EP管,弃去上清液。按照试剂盒说明书加入提取液,超声波破碎细胞,按照10 000 r/min在4℃离心机离心10 min,收集上清液于EP管置于冰上。参照试剂盒说明书测定MDA含量以及SOD和GSH-Px活性。
1.2.6 免疫印迹法检测Bcl-2和Bax蛋白表达:使用RIPA裂解液提取各组细胞总蛋白,采用二喹啉甲酸法测定每个蛋白样品的浓度。将适量蛋白样品与等体积的2×蛋白上样缓冲液混合,沸水浴加热5 min。取40 μg 蛋白样品加至SDS-PAGE凝胶加样孔,设定电压100 V、时间110 min进行电泳。设定转膜电流为300 mA、时间为60 min利用标准湿式转膜装置将蛋白转移至聚偏二氟乙烯膜上。洗膜液漂洗膜2 min,加入5%脱脂牛奶在摇床上摇动封闭60 min。吸尽封闭液后,加入稀释好的一抗4℃缓慢摇动过夜。洗膜液漂洗膜5 min,漂洗3次。稀释好的二抗在侧摆摇床上室温孵育1 h。采用化学发光液进行显色反应,Image J软件分析目的条带灰度值。蛋白相对表达量=灰度值目的条带/灰度值GAPDH。
1.2.7 双荧光素酶报告实验:合成Circ_0000285野生型(WT)序列(包含miR-625结合位点)或Circ_0000285突变型(MUT)序列(含有突变位点),将上述序列分别插入pmirGLO载体,构建荧光素酶报告载体WT-circ_0000285、MUT-circ_0000285。分别用Lipofectamine 2000试剂将这些载体与miR-625 mimic或miR-NC共转染至H9C2细胞。转染48 h后,使用双荧光素酶报告基因检测系统测定相对荧光素酶活性。将pcDNA、pcDNA-circ_0000285、si-NC、si-circ_0000285分别转染H9C2细胞,按照1.2.1步骤检测转染48 h后细胞中miR-625表达量。
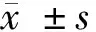
2 结果
2.1 circ_0000285和miR-625在缺氧复氧诱导的H9C2细胞损伤中的表达 H/R组H9C2细胞中circ_0000285表达量与Con组比较显著升高(P<0.05),而miR-625表达量与Con组比较显著降低(P<0.05)。见表1。

表1 circ_0000285和miR-625在缺氧复氧诱导的H9C2细胞损伤中的表达
2.2 抑制circ_0000285表达对缺氧复氧诱导的H9C2细胞氧化损伤的影响 与Con组比较,H/R组H9C2细胞circ_0000285表达量显著升高(P<0.05),凋亡率、Bax蛋白表达量、MDA含量显著升高(P<0.05),而SOD和GSH-Px活性、Bcl-2蛋白表达量显著降低(P<0.05);与H/R+si-NC组比较,H/R+si-circ_0000285组H9C2细胞circ_0000285表达量显著降低(P<0.05),凋亡率、Bax蛋白表达量、MDA含量显著降低(P<0.05),而SOD和GSH-Px活性、Bcl-2蛋白表达量显著升高(P<0.05)。见图1,表2。


图1 抑制circ_0000285表达对缺氧复氧诱导的H9C2细胞凋亡的影响;A 凋亡相关蛋白表达;B 细胞凋亡流式图

表2 抑制circ_0000285表达对缺氧复氧诱导的H9C2细胞氧化损伤的影响
2.3 circ_0000285靶向调控miR-625的表达 miR-625与circ_0000285序列间存在特异性互补结合位点。与转染miR-NC比较,转染miR-625 mimics显著降低H9C2细胞WT-circ_0000285的性对荧光素酶活性(P<0.05),而对MUT-circ_0000285的相对荧光素酶活性物显著影响。pcDNA-circ_0000285组H9C2细胞中miR-625表达量与pcDNA组比较显著降低(P<0.05);而si-circ_0000285组H9C2细胞中miR-625表达量与si-NC组比较显著增加(P<0.05)。见图2,表3、4。

表3 双荧光素酶报告实验

图2 circ_0000285的序列中含有与miR-625互补的核苷酸序列
2.4 miR-625过表达对缺氧复氧诱导的H9C2细胞氧化损伤的影响 与H/R+miR-NC组比较,H/R+miR-

表4 circ_0000285调控miR-625的表达
625组H9C2细胞miR-625表达量显著升高(P<0.05),凋亡率、Bax蛋白表达量、MDA含量显著降低(P<0.05),而SOD和GSH-Px活性、Bcl-2蛋白表达量显著升高(P<0.05)。见表5,图3。

表5 miR-625过表达对缺氧复氧诱导的H9C2细胞氧化损伤的影响

图3 miR-625过表达对缺氧复氧诱导的H9C2细胞凋亡的影响;A 凋亡相关蛋白表达;B 细胞凋亡流式图
2.5 抑制miR-625表达逆转抑制circ_0000285表达对缺氧复氧诱导的H9C2细胞氧化损伤的作用 与H/R+si-circ_0000285+anti-miR-NC组比较,H/R+si-circ_0000285+anti-miR-625组H9C2细胞miR-625表达量显著降低(P<0.05),凋亡率、Bax蛋白表达量、MDA含量显著升高(P<0.05),而SOD和GSH-Px活性、Bcl-2蛋白表达量显著降低(P<0.05)。见图4,表6。

表6 抑制miR-625表达逆转了抑制circ_0000285表达对缺氧复氧诱导的H9C2细胞氧化损伤的作用

图4 抑制miR-625表达逆转了抑制circ_0000285表达对缺氧复氧诱导的H9C2细胞凋亡的作用;A 凋亡相关蛋白表达;B 细胞凋亡流式图
3 讨论
心肌I/R损伤涉及广泛的生物学过程,包括细胞凋亡和氧化应激损伤。缺血和再灌注阶段可产生活性氧,过量活性氧可直接损伤蛋白质、脂质和DNA分子等细胞成分,诱导细胞凋亡级联反应,最终导致心肌损伤[7]。本研究显示H/R处理后,细胞凋亡率、脂质过氧化终产物MDA含量显著增加,而抗氧化酶SOD和GSH-Px活性显著降低,提示H9C2细胞H/R损伤模型构建成功。目前关于circ_0000285相关研究主要集中在肿瘤方面,干扰其表达可抑制肝癌[8]、骨肉瘤[9]、喉癌[10]等恶性肿瘤细胞增殖和转移。本研究发现H/R处理的H9C2细胞中circ_0000285表达量显著增加,提示circ_0000285表达改变可能与H9C2细胞H/R损伤有关。验证circ_0000285功能显示,干扰其表达显著降低MDA含量、凋亡率,提高SOD和GSH-Px活性,说明干扰circ_0000285表达通过提高H9C2细胞抗氧化能力来减轻氧化应激以抵抗H/R损伤。Bcl-2基因家族是最重要的凋亡调节因子,Bcl-2是一种凋亡抑制蛋白,其过表达可以阻断各种刺激诱导的凋亡,而Bax在凋亡刺激下移位至线粒体膜诱导细胞色素c释放发挥促凋亡作用[11]。本研究中干扰circ_0000285表达显著上调Bcl-2蛋白表达、上调Bax蛋白表达,与其对H/R处理的H9C2细胞的抗凋亡作用吻合。以上研究表明,干扰circ_0000285可拮抗H/R诱导的心肌细胞凋亡和氧化应激损伤。
对circ_0000285相关研究进行分析表明,其生物学作用的发挥多与调节miRNA表达有关[12]。如干扰circ_0000285通过负调控miR-197-3p表达诱导宫颈癌细胞G0/G1期阻滞、自噬和凋,抑制宫颈癌进展[13]。本研究通过双荧光素酶实验证实miR-625是circ_0000285的靶基因,并进一步证实过表达或干扰circ_0000285可下调或上调miR-625表达水平。miR-625已被证实具有神经保护功能,敲减长链非编码RNA p21(lncRNA-p21)表达通过上调miR-625表达可增加SOD活性,减轻1甲基4苯基吡啶离子(MPP+)诱导的神经元毒性、细胞凋亡、氧化应激和神经炎症[14]。miR-625还可改善脂多糖诱导的支气管上皮细胞炎性反应[15]。本研究发现H/R处理的H9C2细胞中miR-625表达量显著降低,过表达miR-625显著提高H9C2细胞抗氧化能力、降低氧化应激损伤和细胞凋亡,保护H9C2细胞免受H/R损伤。进一步研究发现,抑制miR-625表达显著减弱干扰circ_0000285表达对H/R处理的H9C2细胞凋亡、氧化应激损伤的影响,这间接证实circ_0000285对H9C2细胞H/R损伤的调控功能是通过靶向负调控miR-625表达实现的。
综上所述,H/R刺激可诱导circ_0000285在H9C2心肌细胞中表达,抑制miR-625表达。干扰circ_0000285表达通过上调miR-625可减弱H/R诱导的心肌细胞凋亡和氧化应激损伤。因此,circ_0000285/miR-625途径在开发缺血性心脏病药物干预可行靶点方面可能具有潜在临床应用价值。

