lncRNA GAS5靶向调控miR-136对高糖诱导的人肾小管上皮细胞中炎性和纤维化因子表达影响及机制研究
宿晶 王吉磊 刘世宾
肾间质纤维化(RIF)是糖尿病肾病(DN)最常见特征之一,其在糖尿病肾损伤早期出现,是DN等慢性肾病发展为终末期肾病的最终共同途径。因此,探讨RIF进展的分子机制对开发有效的DN治疗策略意义重大。长链非编码RNA(lncRNA)定义为一类长度超过200核苷酸蛋白编码潜能缺失的RNA转录本,其可在转录和转录后水平调节基因表达广泛参与表观遗传调控、细胞周期、细胞分化、凋亡等生物学过程[1]。lncRNAs的异常表达与包括DN在内的多种疾病进展有关[2]。生长抑制特异性转录本5(GAS5)是一种lncRNA,研究指出2型糖尿病患者外周血单核细胞中GAS5表达显著升高[3]。淋巴管内皮细胞中GAS5的表达差异可能与糖尿病相关并发症发病机制有关[4]。然而GAS5在RIF中的作用和分子机制鲜有报道。miR-136是一种与多种病理过程相关的非编码RNA,研究指出过表达miR-136显著抑制肾癌、肺癌细胞的上皮间质转化进程[5,6]。本研究通过生物信息学分析发现miR-136是GAS5的潜在靶基因,于是推测GAS5可能通过靶向miR-136参与调控RIF进程。因此,本研究以高糖诱导的人肾小管上皮细胞(HK-2)建立RIF体外细胞模型[7],探讨GAS5靶向miR-136对高糖诱导的HK-2细胞炎性和纤维化因子表达的影响,以期为改善RIF、延缓DN进展提供有效靶点。
1 材料与方法
1.1 实验材料 人肾小管上皮细胞HK-2购于中国科学院上海细胞库;miR-136模拟物(mimics)、抑制物(anti-miR-136)以及相应对照(miR-NC、anti-miR-NC),GAS5小干扰RNA(Si-GAS5)、过表达质粒(pcDNA-GAS5)以及相应对照(Si-NC、pcDNA),荧光素酶报告载体购自上海吉玛制药公司;PrimeScript逆转录Master Mix购于大连TAKARA公司;Power SYBR Green PCR Master Mix购于美国ABI公司;IL-6、TNF-α酶联吸附测定(ELISA)试剂盒购于上海康朗生物公司;兔源肌动蛋白α(α-SMA)、纤维连接蛋白(FN1)、磷酸甘油醛脱氢酶(GAPDH)抗体以及山羊抗兔IgG二抗购于北京博奥森生物公司。
1.2 方法
1.2.1 细胞培养与模型构建:HK-2细胞采用含10%胎牛血清的低糖DMEM培养基,在37℃、CO2浓度为5%的细胞培养箱中培养。当细胞密度达到90%时,加入胰酶消化后按照1∶3比例接种新的培养瓶进行传代。用含30 mmol/L葡萄糖的培养液孵育HK-2细胞24 h建立RIF体外细胞模型[7],记为高糖(HG)组。
1.2.2 实时定量PCR(RT-qPCR)检测GAS5和miR-136表达水平:首先以TRIzol试剂提取HK-2细胞中总RNA,利用PrimeScript逆转录Master Mix合成互补DNA,再用Power SYBR Green PCR Master Mix进行RT-qPCR检测。2-ΔΔCt法分析GAS5和miR-136表达水平。GAS5上游引物5’-CCTGTGAGGTATGGTGCTGG-3’,下游引物5’-CTGTGTGCC AATGGCTTGAG-3’;内参GAPDH上游引物5’-TGTGGGCATCAATGGATTTGG-3’,下游引物5’-ACACCATGTATTCCGGGTCAAT-3’;miR-136上游引物5’-ACUCCAUUUGUUUUGAU GAUGGA-3’,下游引物5’-UCCAUCAUCAAAACAAAUGGAGU-3’;内参U6上游引物5’-AAAGCAAATCATCGGACGACC-3’,下游引物5’-GTACAACACATTGTTTCCTCG GA-3’。
1.2.3 细胞转染和实验分组:将对数期HK-2细胞铺96孔板,利用脂质体试剂分别将Si-NC、Si-GAS5、miR-NC、miR-136 mimics、Si-GAS5+anti-miR-NC、Si-GAS5+anti-miR-136转染50%融合的细胞,收获转染48 h细胞检测转染效果。用含5.5 mmol/L葡萄糖的培养液孵育HK-2细胞24 h记为正常对照(NC)组;HG组参照建模方法进行细胞处理;用含30 mmol/L葡萄糖的培养液孵育分别转染Si-NC、Si-GAS5、miR-NC、miR-136 mimics、Si-GAS5+anti-miR-NC、Si-GAS5+anti-miR-136的HK-2细胞24 h,依次记为Si-NC组、Si-GAS5组、miR-NC组、miR-136组、Si-GAS5+anti-miR-NC组、Si-GAS5+anti-miR-136组。
1.2.4 ELISA实验检测IL-6和TNF-α表达:胰酶消化各组细胞,3 000 r/min离心10 min收集细胞;用冷磷酸盐缓冲液(PBS)洗涤细胞3次,用一定功率的超声波处理细胞悬液;再将带破碎细胞在-20℃下冰冻,室温溶解,反复3次,使细胞溶胀破碎。将标本于4℃离心机1 500 r/min离心10 min,收集上清按照试剂盒说明书检测IL-6和TNF-α表达量。
1.2.5 免疫印迹法检测α-SMA和FN1蛋白表达:RIPA裂解法处理HK-2细胞获得总蛋白,蛋白定量后利用SDS-PAGE电泳分离将蛋白样品分离开。随后用湿转移法将凝胶上的蛋白条带转移到硝酸纤维素膜上。室温下用5%脱脂牛奶孵育2 h后加入一抗溶液(α-SMA为1∶300,FN1为1∶500)4℃孵育膜过夜。然后加入山羊抗兔IgG二抗(1∶1 000)室温下孵育膜2 h。最后加入显影剂显色后,Image J软件分析灰度值。目的蛋白表达量为目的条带灰度值和内参GAPDH灰度值比值。
1.2.6 双荧光素酶报告实验:收集HK-2细胞接种于24孔板,当细胞密度达到50%时进行转染。用Lipofectamine 2000试剂将miR-NC、miR-136 mimics分别与WT-GAS5或MUT-GAS5共转染。孵育48 h后收获转染细胞,磷酸盐缓冲液洗涤后,然后使用双荧光素酶报告基因检测系统测定荧光素酶活性。同时将pcDNA、pcDNA-GAS5、Si-NC、Si-GAS5分别转染HK-2细胞,按照上述RT-qPCR步骤检测转染48 h细胞中miR-136表达量。
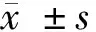
2 结果
2.1 GAS5和miR-136在高糖诱导的HK-2细胞中的表达 与NC组比较,HG组HK-2细胞中GAS5表达量显著升高,差异有统计学意义(P<0.05),而miR-204-5p表达量显著降低,差异有统计学意义(P<0.05)。见表1。

表1 GAS5和miR-136在高糖诱导的HK-2细胞中的表达
2.2 沉默GAS5对高糖诱导的HK-2细胞炎性与纤维化因子表达的影响 与NC组比较,HG组HK-2细胞GAS5表达量显著升高(P<0.05),IL-6和TNF-α表达显著升高(P<0.05),α-SMA和FN1蛋白表达量显著升高(P<0.05);与HG+Si-NC组比较,HG+Si-GAS5组HK-2细胞GAS5表达量显著降低(P<0.05),IL-6和TNF-α表达显著降低(P<0.05),α-SMA和FN1蛋白表达量显著降低,差异有统计学意义(P<0.05)。见表2。

表2 沉默GAS5对高糖诱导的HK-2细胞炎性与纤维化因子表达的影响
2.3 GAS5靶向调控miR-136的表达 Starbase在线分析显示,GAS5序列中含有miR-136特异性结合位点。双荧光素酶报告实验显示,与转染miR-NC比较,转染miR-136显著降低HK-2细胞WT-GAS5的相对荧光素酶活性,差异有统计学意义(P<0.05),而对MUT-GAS5的相对荧光素酶活性无显著影响。pcDNA-GAS5组HK-2细胞miR-136表达量显著低于pcDNA组(P<0.05);Si-GAS5组HK-2细胞miR-136表达量显著高于Si-NC,差异有统计学意义(P<0.05)。见图1,表3、4。

图1 GAS5中含有miR-136结合位点

表3 双荧光素酶报告实验

表4 lncRNA GAS5调控miR-136表达
2.4 过表达miR-136对高糖诱导的HK-2细胞炎性与纤维化因子表达的影响 与NC组比较,HG组HK-2细胞miR-136表达量显著降低(P<0.05),IL-6和TNF-α表达显著升高(P<0.05),α-SMA和FN1蛋白表达量显著升高(P<0.05);与HG+miR-NC组比较,HG+miR-136组HK-2细胞miR-136表达量显著升高(P<0.05),IL-6和TNF-α表达显著降低(P<0.05),α-SMA和FN1蛋白表达量显著降低(P<0.05)。见表5,图2。

图2 过表达miR-136对高糖诱导的纤维化因子的影响

表5 过表达miR-136对高糖诱导的HK-2细胞炎性与纤维化因子表达的影响
2.5 干扰miR-136表达逆转沉默GAS5对高糖诱导的HK-2细胞炎性与纤维化因子表达的影响 与HG+Si-GAS5+anti-miR-NC组比较,HG+Si-GAS5+anti-miR-136组HK-2细胞miR-136表达量显著降低,IL-6和TNF-α表达显著升高(P<0.05),α-SMA和FN1蛋白表达量显著升高(P<0.05)。见图3,表6。

图3 干扰miR136表达对高糖诱导的HK-2细胞纤维化因子表达的影响

表6 干扰miR136表达对高糖诱导的HK-2细胞炎性与纤维化因子表达的影响
3 讨论
GAS5最初从小鼠NIH3T3细胞分离得到,其在细胞增殖、生长阻滞、凋亡和自噬等多个生物学过程中发挥重要作用。近年研究证实GAS5表达失调与多种纤维化进程有关[8]。心肌纤维化组织和活化的心肌成纤维细胞中GAS5表达降低,恢复GAS5表达水平显著抑制心肌成纤维细胞增殖,降低MMP-2、a-SMA和Ⅰ型胶原蛋白表达,从而减轻心脏纤维化,改善心脏功能[8,9]。GAS5通过下调miR-23a表达调控信号通路抑制四氯化碳诱导的肝纤维化[10]。本研究发现高糖诱导后HK-2细胞中肌成纤维细胞标记物α-SMA、纤维化标志蛋白FN1表达水平显著增加,GAS5表达显著增加,提示GAS5表达改变可能与高糖诱导的RIF相关。转染Si-GAS5分析GAS5功能发现,沉默GAS5显著降低α-SMA和FN1蛋白表达水平,提示沉默GAS5可逆转高糖诱导的RIF。
TGF-β1是一种极强的促纤维化因子,Wang等[11]指出在TGF-β1诱导的HK-2细胞、链脲佐菌素诱导的DN小鼠肾组织中GAS5表达升高,沉默GAS5表达抑制转化生长因β1诱导的HK-2细胞纤维化,这与本研究发现的GAS5促纤维化作用一致。在DN中受损的肾小管上皮细胞、浸润的淋巴细胞可产生炎性因子加剧肾脏炎性反应,介导肾脏纤维化[12]。本研究发现沉默GAS5表达显著降低高糖诱导的HK-2细胞IL-6和TNF-α表达水平,说明沉默GAS5可抑制高糖诱导的HK-2细胞炎性反应。
lncRNA通过与miRNA相互作用影响miRNA活性进而调控多种生物学过程[13]。为探讨GAS5在高糖诱导的HK-2细胞炎症和纤维化中的可能机制,本研究通过Starbase数据库在线分析发现miR-136与GAS5序列存在结合位点,并通过双荧光素酶报告实验、RT-qPCR进一步证实GAS5对miR-136的靶向负调控作用。目前对miR-136研究多集中在肿瘤方面,研究显示口腔鳞状细胞癌、胃癌、黑色素瘤、乳腺癌中miR-136表达降低,miR-136低表达促进癌细胞EMT进程[14-17]。
本研究发现高糖刺激显著降低HK-2细胞中miR-136表达水平,提示miR-136低表达可能与高糖诱导的RIF和炎性反应相关。转染miR-136 mimics进行功能验证显示,恢复miR-136表达显著削弱高糖刺激对HK-2细胞α-SMA、FN1、IL-6和TNF-α表达的影响,说明miR-136可抑制高糖诱导的HK-2纤维化因子表达和炎性反应,这与Liu等[18]报道的miR-136的抗纤维化作用基本吻合。深入研究发现,抑制miR-136表达还可逆转沉默GAS5对高糖诱导的HK-2细胞炎性与纤维化因子表达的影响,这进一步说明GAS5靶向miR-136在高糖诱导HK-2细胞炎性与纤维化因子表达中的的作用。
综上所述,本研究表明沉默GAS5可抑制高糖诱导的人肾小管上皮细胞炎性和纤维化因子表达,其机制与上调miR-136表达有关。因此,GAS5/miR-136途径是改善改善RIF、延缓DN进展的潜在靶点。

