非洲猪瘟基因缺失株和非缺失株荧光定量PCR 检测方法的建立
雷宇平 图门巴雅尔 张仲萍 孙杰 宁艳 王锦 张昱 胡明明 王治维 赵凯 王仲兵
(山西省动物疫病预防控制中心 030027)
非洲猪瘟(African Swine Fever,ASF)是一种烈性病毒感染性疾病,在野猪和家猪中均可发病,其病原为非洲猪瘟病毒(African Swine Fever Virus,ASFV)。早在18 世纪20 年代,Kenya 首次报道了该病毒引起的疫病[1]。目前,世界动物卫生组织(Office International Des Epizooties,OIE)将ASF 列为法定上报疫病,我国将其列为一类动物疫病[2]。非洲猪瘟疫情的流行不仅给养猪产业造成巨大的经济损失,而且对公共卫生安全也造成风险和威胁[3]。因此,了解非洲猪瘟的流行病学情况可为防控疫情、减少经济损失和保护畜牧业健康发展提供有力的科学依据。
ASFV 是一种双链DNA 病毒,是非洲猪瘟病毒科的唯一成员,也是唯一通过节肢动物非洲钝缘蜱传播的DNA 病毒[1]。ASFV 的分子结构十分复杂,是有外壳的二十面体,平均直径约200nm。病毒基因组含有一个线性、共价键结合的双链DNA,长度约170~190Kbp,编码约151~167 个开放阅读框,包括一个保守中心和两段可变区,该可变区可编码5 种多基因家族,与病毒可变性密切相关[2,4]。
ASF 的自然窗口期通常为4~19d,急性期为3~4d。通常来说,ASF 的临床表现诊断可分为4 种病程形式,即超急性、急性、亚急性和慢性。其中超急性和急性非洲猪瘟热是由高致病力的毒株引起,亚急性和慢性非洲猪瘟热是由中至轻度致病力的毒株引起。超急性感染常发生猝死,临床表现较少;急性感染常表现为高热(达40.5~42℃),早期白细胞和血小板减少,心率和呼吸频率增快,耳朵、尾巴、四肢远端、胸部和腹部的皮肤发红,死亡前24~48h 出现贫血、发绀等症状,家猪病死率常达100%[5]。亚急性和慢性病程表现较为缓和,发热程度较轻,可出现皮肤坏死、溃疡和关节炎,亚急性自然病程在15~45d 死亡,慢性则在2~15 个月死亡[2]。根据ASFV 毒株致病力的不同,ASF 的临床表现和病程呈较大的个体差异,可表现为长期持续感染,也可表现为致死率100%的超急性和急性病程[6]。我国于2018 年爆发非洲猪瘟疫情,对我国养猪产业造成巨大影响,个别省份猪肉大规模减产。因此,建立一种灵敏、准确且快速检测不同ASFV 的毒株方法对收集非洲猪瘟疫情流行病学数据、对疫情形势做出正确判断至关重要。
1 材料与方法
1.1 核酸和样品
国家标准品非洲猪瘟病毒B646L 基因质粒(GBW (E)091034)作为阳性对照,无菌无核酶水作为阴性对照。参考品非洲猪瘟病毒P27 基因质粒、非洲猪瘟CD2v 基因缺失质粒和非洲猪瘟MGF360-505R 基因缺失质粒均购自广州艾基。
1.2 试剂和仪器
ddH2O(上海生工)、dNTPS(上海生工)、Hot-start Taq聚合酶(菲鹏生物)、5×buffer(菲鹏生物)、非洲猪瘟引物F1(上海生工)、非洲猪瘟引物R1(上海生工)、非洲猪瘟Taqman 探针P1(上海生工)、非洲猪瘟CD2v 基因缺失引物F2(上海生工)、非洲猪瘟CD2v 基因缺失引物R2(上海生工)、非洲猪瘟CD2v 基因缺失Taqman 探针P2(上海生工)、非洲猪瘟MGF360-505R 基因缺失引物F3(上海生工)、非洲猪瘟MGF360-505R 基因缺失引物R3(上海生工)、非洲猪瘟MGF360-505R 基因缺失Taqman 探针P3(上海生工)。NanoDrop 微量分光光度计(赛默飞)、速低温离心机(珠海黑马)、LightCycler480 荧光PCR 仪(瑞士罗氏)、小型瞬时离心机(美国精骐)、涡旋振荡器。
1.3 引物和探针设计
对比Genbank 上下载序列,各设计一对非洲猪瘟、非洲猪瘟CD2v 基因缺失和非洲猪瘟MGF360-505R 基因缺失的特异性引物和Taqman 探针,用于非洲猪瘟、非洲猪瘟CD2v 的鉴别检测,引物和探针由生工生物工程(上海)股份有限公司合成,参见表1。

表1 引物和探针
1.4 荧光PCR
病毒总DNA 按照核酸提取试剂(广州维伯鑫)说明书要求提取,再使用NanoDrop 微量分光光度计(赛默飞)通过检测样本在260nm 波长的吸光度来确定所提取的DNA 浓度。将提取的病毒DNA 逆转录为cDNA,使用LightCycler480 荧光PCR 仪(瑞士罗氏)加入设计好的引物R1、R2、R3 和各自的探针以cDNA 为模板分别进行扩增。反应体系如表2 所示。反应程序为42℃,20min;95℃,10min;94℃,15s,55℃,30s(收集荧光),共40 个循环。

表2 荧光PCR 反应体系
1.5 敏感性(最低检测限)检测
参考品加入0.5ml 无DNA 酶的去离子水复溶,待液体完全澄清后作为待测样品使用。参考品复溶后浓度为1.3×106copies/ml,分别用无DNA 酶的去离子水进行1:10(浓度为1.3×105copies/mL)、1:102(浓度为1.3×104copies/ml)、1:103(浓度为1.3×103copies/ml)、1:104(浓度为1.3×102copies/ml)及1:105(浓度为1.3×101copies/ml)5 个浓度梯度的稀释,作为待测样品用荧光PCR 方法对最低检出限进行检测。
1.6 精密性检测
使用参考品加入无DNA 酶的去离子水稀释100 倍后利用构建的荧光PCR 反应体系重复检测10 次,计算其CV 值。
1.7 特异性检测
采用非洲猪瘟国家参考品作为阳性对照,参考品恢复至室温,阳性、阴性参考品加入2.5 ml 无DNA 酶的去离子水复溶,待液体完全澄清后作为待测样品使用。
1.8 统计学分析
采用IBM SPSS Statistics 26 对重复性检测试验中的变异系数(Coefficient of Variance,CV)进行计算,CV≤5%表示差异具有统计学意义。
2 结果
2.1 敏感性结果
将参考品病毒核酸按1:10、1:102、1:103、1:104 及1:105倍数进行稀释后使用荧光PCR 方法检测。结果显示,该技术能在浓度为1.3×103copies/ml 及以上时检出非洲猪瘟病毒(图1)、非洲猪瘟CD2v 基因缺失病毒(图2)和非洲猪瘟MGF360-505R 基因缺失病毒(图3)及猪源性内参(图4)。

图1 荧光PCR 体系最低检测限结果(非洲猪瘟病毒参考品)
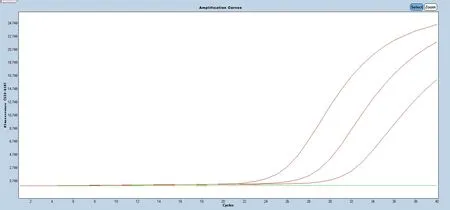
图2 荧光PCR 体系最低检测限结果(非洲猪瘟CD2v 基因缺失病毒参考品)
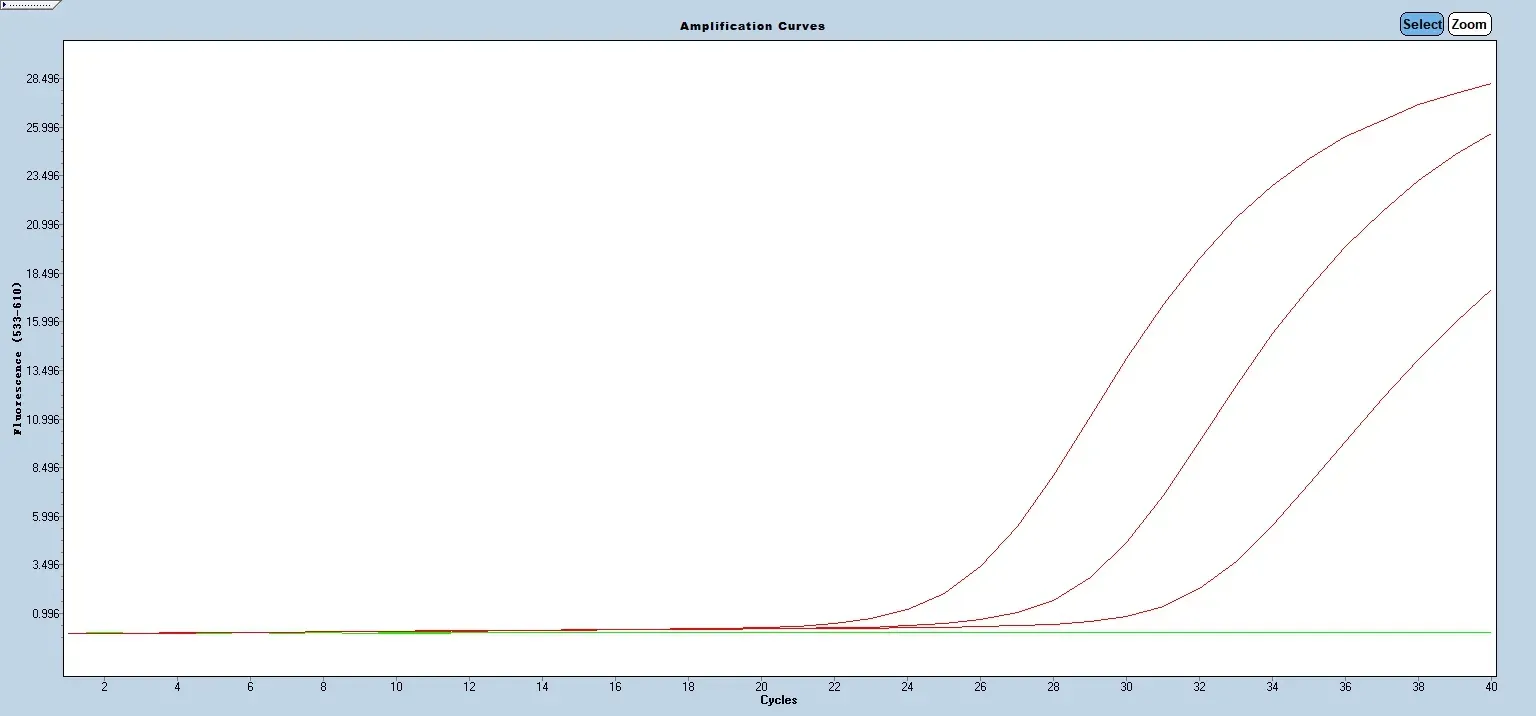
图3 荧光PCR 体系最低检测限结果(非洲猪瘟MGF360-505R 基因缺失病毒参考品)

图4 荧光PCR 体系最低检测限内参结果(绿色线)
2.2 精密性结果
为检测本研究所构建的荧光RT-PCR 体系能否稳定的检测出不同病毒毒株,使用该技术分别重复检测非洲猪瘟病毒(表3 和图5)、非洲猪瘟CD2v 基因缺失病毒(表3 和图6)和非洲猪瘟MGF360-505R 基因缺失病毒(表3 和图7)的参考品各10 次,并计算其CV 值。经计算得出非洲猪瘟病毒的CV%为0.55%,非洲猪瘟CD2v 基因缺失病毒的CV%为0.36%,而非洲猪瘟MGF360-505R 基因缺失病毒的CV%为0.21%,三者的CV%均<1%,提示该方法能重复稳定检测不同病毒毒株。

表3 精密度检测结果
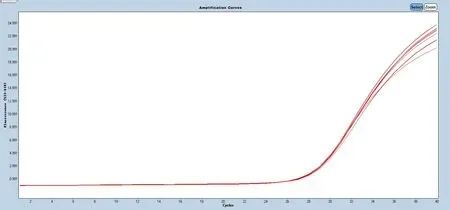
图5 非洲猪瘟病毒精密性检测结果

图6 非洲猪瘟CD2v 基因缺失病毒精密性检测结果
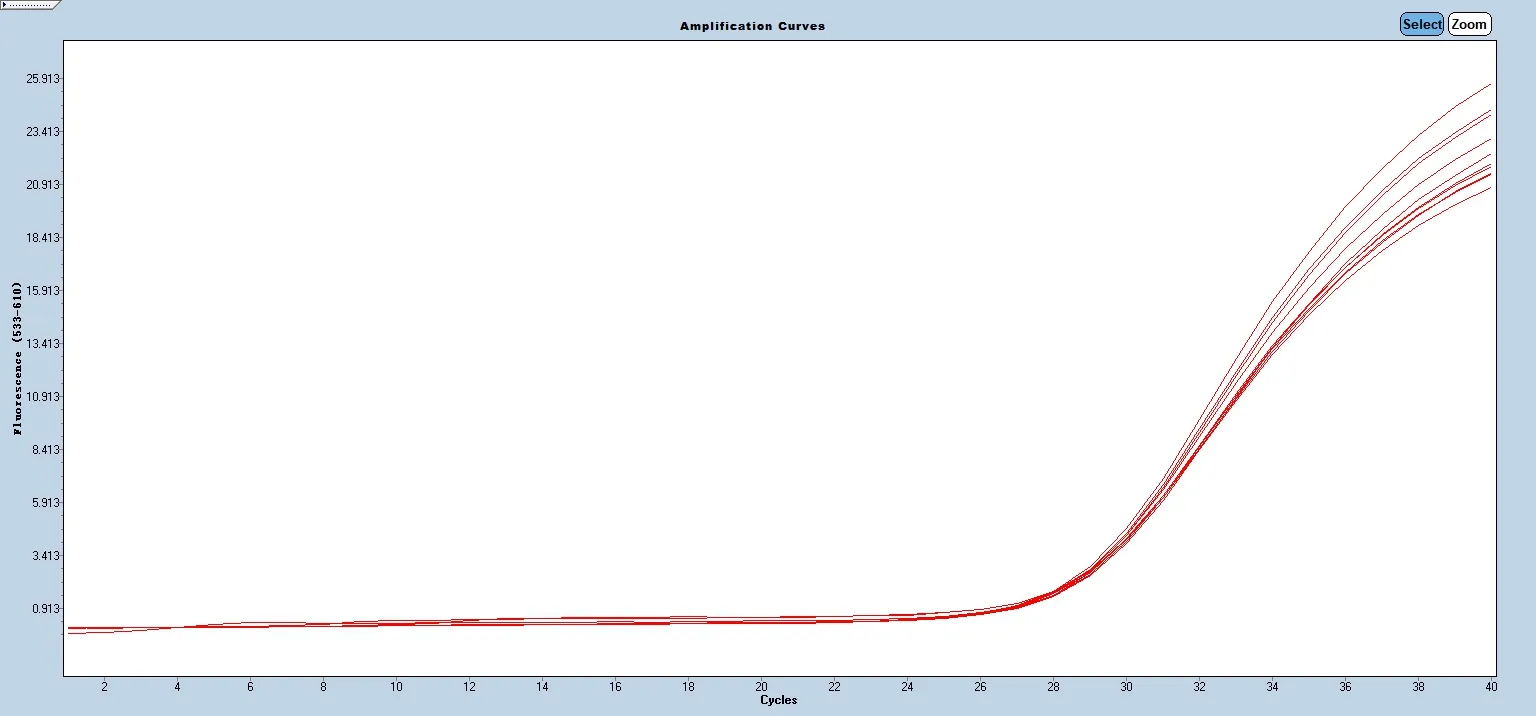
图7 非洲猪瘟MGF360-505R 基因缺失病毒精密性检测结果
2.3 特异性结果
明确该方法的精密度后,利用国家标准品ASFV B646L 基因质粒做阳性对照,检测区分不同病毒毒株的特异性(图8)。与阳性对照相比,该技术测得的10 个非洲猪瘟病毒参考品全部为阳性,灵敏度为100%(10/10)。

图8 使用国家标准品作为阳性对照测得的特异性结果
另外,我们利用阴性参考品检测该方法的特异度(图9)。与阴性对照相比,该技术测得的20 个阴性参考品样本全部为阴性,特异度为100%(20/20)。

图9 使用阴性参考品作为对照测得的特异性结果
3 讨论
非洲猪瘟是一种传染速度快、致死率高的严重疾病。本研究建立了一种荧光PCR 方法,能灵敏、准确且快速检测不同的ASFV 毒株,能协助收集流行病学数据,有利于降低ASFV感染造成的经济损失,同时保护公共卫生安全。
2018 年8 月,我国沈阳确诊第一例非洲猪瘟疫情,截至2021 年12 月,全国共发生195 起非洲猪瘟疫情,其中家猪疫情189 起,野猪疫情6 起。2021 年以来,全国累计报告发生14起非洲猪瘟疫情。目前,人们已尝试了多种方法制备ASFV 的疫苗均未获得成功,无法在动物体内建立有效的保护性免疫,同时也缺乏有效的治疗方法[3]。现今,主要采用扑杀感染动物、严格生物安全措施等成本高、效率低的手段,为阻止疫情在我国乃至全球的蔓延。为了更好地应对非洲猪瘟对我国畜牧经济的影响、减少带病猪肉流入食品加工领域,我国针对ASFV 的实验室诊断技术分别制定了一个国家标准《非洲猪瘟诊断技术》 GB/T 18648-2018[7]、一个商检行业标准《非洲猪瘟检疫技术规范》 SN/T 1559-2010[8]和一个团体标准《非洲猪瘟病毒实时荧光PCR 检测方法》 T/CVMA 5-2018[9]。但根据ASFV 毒株致病力的不同,ASF 的临床表现和病程呈现较大的个体差异。因此,早期诊断、快速检测不同ASFV 病毒毒株、不断更新迭代病毒检测方法对疾病源头防控具有重要的意义。
病原体本身采取的检测方法是诊断ASFV 初期感染的有效手段,有助于疾病早期确认ASFV 感染,尽早确诊并进行干预处理[10]。荧光PCR 是指在反应体系中加入荧光基团和荧光淬灭基团,随着PCR 反应的进行,扩增产物不断积累,荧光信号逐渐增强,从而能利用较少的样本检测出准确的量化结果,是对原有PCR 技术的一大变革[11]。在本研究所建立的方法中,通过敏感性检测测得对不同毒株的最低检测限都较低,提示本研究方法有较高的灵敏性,能检出较低浓度的病毒水平。同时,养猪场环境复杂,采样过程难以达到标准化。经过重复性检验,重复10 次检测后CV%均<1%,提示本研究建立的方法精密度佳,检测体系稳定可靠。另外,考虑到标本可能混入其他病毒样本或混合其他杂质,我们采用无菌无核酶水及国家标准品作为阴性和阳性对照,结果发现本方法可以准确地将不同ASFV 毒株检出,未出现假阳性或假阴性的情况,提示该检测方法特异性高,可在实践工作中避免各种干扰因素影响。总体而言,有效的诊断方法能尽早将不同病毒毒株检出,降低运输、屠宰、生产加工等下游各环节疫情传播风险,降低成本支出,提高经济受益。
综上所述,本研究建立的荧光PCR 技术能快速准确地鉴定ASFV 的不同毒株,为疫情防控提供流行病学依据。

