鸭源多重耐药鼠鼻罗氏菌的分离鉴定、耐药性及耐药基因检测
李旭妮,张宁宁,罗玉峰,冯 妍,朱良全,彭小兵,王 楠
(1.中国兽医药品监察所,北京 100081;2.中国动物疫病预防控制中心,北京 100125)
鼠鼻罗氏菌(Rothia nasimurium)为兼性厌氧的革兰氏阳性球菌,属于放线菌属微球菌科,为条件致病菌[1]。该菌在首次报道时分离自鼠的鼻腔[2],并因此得名。近年来,研究人员相继在狗[3]和鹅[4]的临床病料中分离到鼠鼻罗氏菌。2021 年,Wang 等[5]也报道了山东省某地患病鸭感染该菌。目前关于鼠鼻罗氏菌的致病力以及耐药分析研究很少,但该菌常常表现出多种常用抗生素高水平耐药现象[4],这恰恰是值得研究者关注的问题。
本课题组于2020 年在东北地区某农场的病鸭鼻拭子中分离得到一株细菌,将其命名为DB1 株,通过鉴定确定为鼠鼻罗氏菌。随后,对分离得到的鼠鼻罗氏菌进行耐药性分析,并对相关耐药基因进行检测,以期对由该菌引起感染的治疗和预防起到一定指导作用。
1 材料与方法
1.1 材料
1.1.1 病料来源及背景 2020 年东北地区某农场送检发病鸭多只。病鸭主要表现为散发性呼吸系统症状(流黏性鼻液、咳嗽、呼吸急促),进食量减少,精神低沉。通过问询畜主,得知该农场饲养环境较差,且时处冬末春初,为保持圈舍环境温度,常关闭门窗,舍内通风差。发病后,畜主投喂了青霉素和板蓝根,但治疗效果不佳。本课题组研究人员到场后,无菌采集发病鸭鼻拭子进行细菌分离培养。
1.1.2 试剂及药品 10×Buffer、ExTaq酶、dNTP、切胶回收试剂盒、大肠杆菌DH5α 感受态细胞,均购自宝生物工程(大连)有限公司;TSB液体培养基、TSA 培养基、细菌生化微量鉴定管,均购自杭州微生物试剂有限公司;DNA 提取试剂盒,购自上海生工生物工程技术服务有限公司;卡那霉素、庆大霉素、链霉素、红霉素、氟苯尼考、多西环素、头孢氨苄、恩诺沙星8 种抗菌药物,均购自北京海洋医药化工生物科技有限公司。
1.1.3 试验动物 20 日龄试验级法国番鸭12 只,雌雄各半,体质量(1.5±0.2)kg,购自东北大学实验动物中心。
1.2 细菌分离培养
将采集的鼻拭子放置于1 mL 无菌水中,浸泡0.5~2 h,离心收集沉淀;将收集样品无菌接种TSA 固体培养基,置于37 ℃恒温培养箱中连续培养24 h;挑取单个菌落接种在TSB 液体培养基中,继续培养留用。
1.3 涂片镜检
用接种环挑取上述培养基中的单个菌落,进行革兰氏染色,在油镜下观察细菌菌落形态特点。
1.4 生化鉴定
将纯化后的细菌培养物分别进行葡萄糖、麦芽糖、阿拉伯糖、甲基β-D-吡喃葡萄糖苷、蔗糖、糖原、乳糖、蜜二糖、半乳糖醛酸苷酶、精氨酸二氢酶、碱性磷酸酶等一系列生化试验,37 ℃培养24 h,观察结果并记录。试验结果参照《伯杰氏细菌鉴定手册》进行比对。
1.5 动物回归试验
将12 只法国番鸭随机分为2 组,每组6 只。一组为试验组,将菌液在37 ℃条件下培养18~24 h,取5 mL 菌液12 000 r/min 离心10 min,弃上清,在所得沉淀中加入生理盐水稀释至原菌液浓度;将所得样品注射试验番鸭(3 mL/只),每隔6 h 观察番鸭的临床表现,隔离观察7 d。另一组为对照组,注射无菌生理盐水(3 mL/只)。
1.6 分离菌株16S rDNA 基因序列测定
用DNA 提取试剂盒提取菌液DNA。使用Primer 6.0 软件设计16S rDNA 引物(上游引物序列:5'-ATCCGCTATTTACCCAGTGG-3';下游引物序列:5'-GCTGTAAACGAACTCGCCAC-3'),进行PCR 扩增。反应体系:DNA 模板0.5 μL,10×Buffer 2.5 μL,dNTP 2.0 μL,ExTaq酶 0.2 μL,上游引物1.0 μL,下游引物1.0 μL,最后用dd H2O补充至25.0 μL。反应条件:94 ℃ 5 min;94 ℃1 min,50 ℃ 45 s,72 ℃ 1 min,30 个循环;72 ℃延伸10 min。取PCR 扩增产物进行核酸电泳检测,随后将得到的PCR 产物切胶回收,连接,转化,提取质粒,并将纯化质粒送往深圳华大基因股份有限公司进行核苷酸序列测定。
1.7 序列比对及系统进化树构建
为证实亲缘关系,将16S rDNA 测序结果与从Amazona aestiva中分离的菌株核酸序列(GenBank登录号KR059855.1)进行Blast 分析比对,并从NCBI 网站中选取4 株全基因组序列作为分析对象,采用MEGA 5.05 软件构建系统进化树。
1.8 药敏试验
选用兽医临床上较为常见的8 种兽用抗菌药物,分别为卡那霉素、庆大霉素、链霉素、红霉素、氟苯尼考、多西环素、头孢氨苄、恩诺沙星。采用微量稀释法进行最小抑菌浓度(MIC 值)测定,结果参照美国临床和实验室标准协会(CLSI)公布的标准《动物源性细菌抗菌药物敏感性试验纸片法与稀释法执行标准(第四版)VET01-A4》[6],判定其耐药情况。
采用常规PCR 检测两种耐药基因(TME和OXA-23),耐药基因引物及参考文献见表1。PCR反应体系:DNA 模板4.0 μL,10×Buffer 2.5 μL,dNTP 2.0 μL,ExTaq酶 0.3 μL,上游引物1.0 μL,下游引物1.0 μL,最后以ddH2O 补充至25.0 μL。反应条件:94 ℃ 5 min;94 ℃ 1 min,50 ℃ 45 s,72 ℃ 1 min,30 个循环;72 ℃延伸10 min。PCR扩增完成后,扩增产物经琼脂糖凝胶电泳检测。

表1 耐药基因PCR 引物序列及终产物长度
2 结果
2.1 细菌分离培养
如图1 显示,细菌在TSA 培养基上生长缓慢,24 h 后,在TSA 固体培养基上生长出淡灰色、圆形、光滑、隆起且边缘整齐的菌落。挑取单个菌落进行革兰氏染色,置于油镜下观察,可以发现分离株为革兰氏阳性球菌,单个或两两相连(图2),将其命名为DB1 株。
2.2 生化鉴定
生化试验结果(表2)显示,分离菌株生化特性与鼠鼻罗氏菌基本一致,初步确定该菌为鼠鼻罗氏菌。

表2 菌株DB1 生化特性
2.3 动物回归试验
12 只健康番鸭在隔离观察7 d 无任何异常后,进行动物回归试验。结果显示:试验组番鸭在注射菌液4 d 后出现明显症状,主要表现为采食量下降,精神萎靡,鼻腔有黏性分泌物流出,所有试验鸭均无死亡现象;对照组番鸭无任何异常现象。采集发病鸭鼻腔黏性分泌物,进行实验室分离培养、生化试验及16S rDNA 基因测序,结果从发病鸭鼻腔黏性分泌物中能够再次分离到鼠鼻罗氏菌。
2.4 16S rDNA 基因扩增
以提取的DNA 为模板,进行16S rDNA 基因PCR 扩增,扩增产物通过10 g/L 琼脂糖凝胶电泳检测。结果(图3)显示,扩增产物核苷酸序列大小约为1 500 bp。在GenBank 数据库中经Blast比对分析,结果显示该菌株与鼠鼻罗氏菌相似度为99%。
2.5 系统进化树构建
使用MEGA 5.05 软件,将分离菌株DB1 与GenBank 数据库中鼠鼻罗氏菌其他代表性菌株构建进化树。结果(图4)显示,分离菌株DB1 与鼠鼻罗氏菌NR025310.1 同在一个分支,表明该分离菌株为鼠鼻罗氏菌。
2.6 药敏试验
根据各种药物的浓度测试范围结果,分析MIC 结果,参照CLSI 临床标准,得出以下结果(表3):本试验分离的鼠鼻罗氏菌DB1 株对卡那霉素、庆大霉素、链霉素、红霉素、氟苯尼考、恩诺沙星、头孢氨苄均耐药,仅对多西环素敏感。
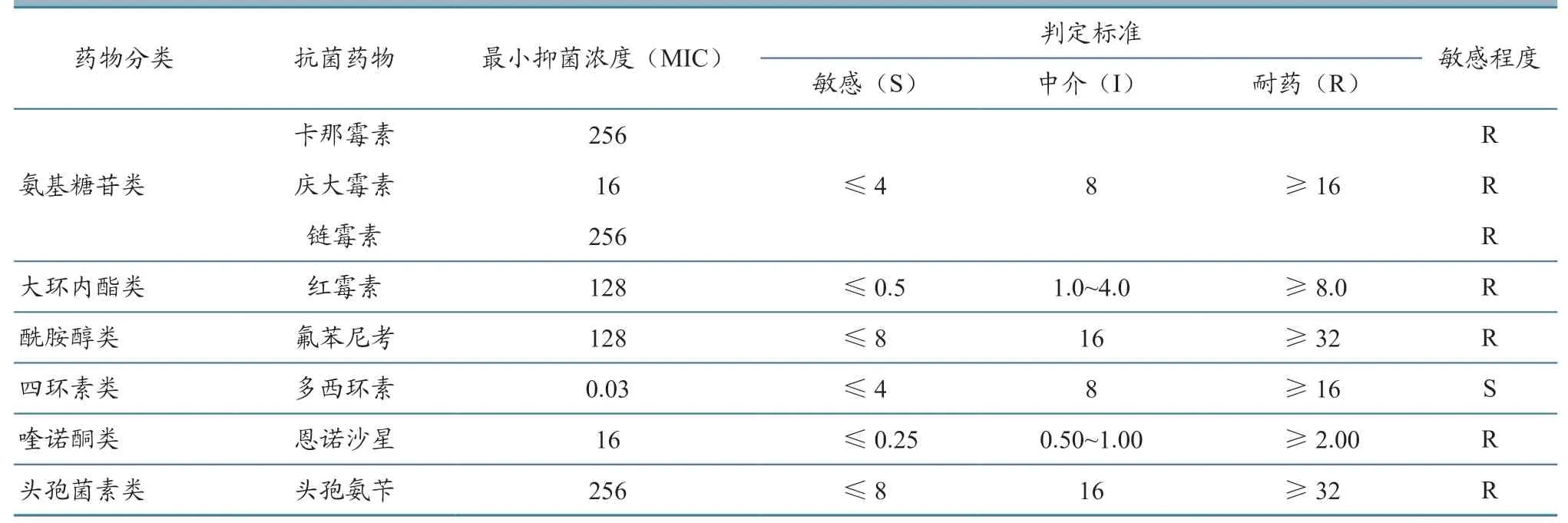
表3 鼠鼻罗氏菌DB1 株肉汤稀释法药敏试验结果 单位:µg/mL
2.7 耐药基因检测
对分离菌株DB1 进行β-内酰胺类抗生素耐药基因(TME和OXA-23)PCR 检测,TME和OXA-23基因预期扩增片段长度分别为535 和1 067 bp。结果(图5)显示,两种耐药基因扩增均呈阴性。
3 讨论
鼠鼻罗氏菌属于罗氏菌属,为兼性厌氧的革兰氏阳性菌,不形成孢子,无动力,最早被归类为放线菌科。2000 年由Collins 等[2]首次发现于鼠的鼻腔,并因此得名。2011 年李楠等[7]在空气中分离到一株鼠鼻罗氏菌,并确定其为具有高水平多重耐药表型的分离株。2014 年David 等[3]报道在狗感染部位分离到鼠鼻罗氏菌,表明其作为共生体或者机会性病原体在与葡萄球菌混合感染中产生致病性。2021 年赵巧雅等[8]在患病仔兔的肺脏中分离出一株鼠鼻罗氏菌。迄今为止,在我国东北地区几乎没有关于该菌株在禽类中的报道。
从本研究药敏试验结果可知,分离菌株DB1对多种药物耐药,仅对多西环素敏感。β-内酰胺类抗生素耐药基因检测结果为阴性,但分离菌株对该类药物表现为耐药,说明该菌产生耐药性的原因并非耐药基因,分析原因可能为日常饲养中该类药物使用较为频繁,从而导致耐药性产生。近年来,抗生素滥用现象十分严重,细菌耐药性已经成为科学研究的热点。多重耐药菌株的产生,也使人们面临着严峻考验[9]。到目前为止,世界上发现的高水平耐药细菌数量呈现增长趋势,如金黄色葡萄球菌[10]、铜绿假单胞菌[11]、鲍曼不动杆菌[12]等,这些都是临床上常见的病原菌,而有关高水平耐药鼠鼻罗氏菌却报道较少[13-14]。养殖人员在动物患病时,特别是疑似或确诊为细菌性感染时,应及时开展药物敏感性试验,使用敏感性高的药物进行针对性治疗,做到合理使用,避免抗生素滥用。
本研究从某农场患病鸭的鼻拭子中分离到一株优势菌,通过分子生物学方法鉴定该菌为鼠鼻罗氏菌。从鸭鼻拭子中分离到鼠鼻罗氏菌在我国东北地区尚属首次报道。致病性试验结果显示,分离菌株对番鸭具有一定致病性。因此,养殖场在防控细菌性疾病时,一方面要加强日常饲养管理,提高动物机体免疫机能,保护易感动物。另一方面,要落实落细清洗、消毒等生物安全防控措施,确保养殖场、圈舍内清洁卫生,切断细菌性疾病的传播途径。此外,在高水平耐药菌株跨物种传播趋势增强的大背景下,需高度重视病原微生物高水平耐药给养殖业带来的潜在威胁,贮备和建立有效的监测及防控机制,从而保障畜牧业生产安全和公共卫生安全。

