IRF5对低分化胃癌细胞迁移和侵袭能力的影响及机制研究
吴佳琪 李为民 王怡栋 潘文胜
胃癌是世界范围内最常见的恶性肿瘤之一,每年新发病例约103万,死亡78万[1]。我国是胃癌高发大国,国内胃癌发病率仅次于肺癌[2]。由于胃癌早期症状的非特异性,患者确诊时往往已是晚期,严重威胁人类的生命健康。胃癌组织的分化程度与胃癌预后关系紧密,低分化胃癌较中高分化胃癌更易出现转移,同时伴随预后不良[3]。而死于肿瘤的病例中,90%与肿瘤侵袭、转移有关[4]。因此,寻找抑制低分化胃癌细胞侵袭能力的分子标志物,对于提高患者的生存率具有重要的意义。
干扰素调节因子5(interferon regulatory factor 5,IRF5)是干扰素调节因子家族的重要一员,过去研究表明IRF5不仅对病原体的防御与免疫细胞的分化方面起重要作用,同时也参与肿瘤形成及肿瘤细胞凋亡[5-6]。同时,研究表明IRF5在不同肿瘤细胞中可发挥抑制肿瘤或者促进肿瘤的作用,提示IRF5功能的多样性[7-8]。目前,IRF5在低分化胃癌细胞中的生物学功能及其机制尚未完全阐明。过去研究发现在胃癌细胞系中IRF5基因DNA区域高度甲基化,然而具体作用依然不清[9-10]。因此本研究探讨IRF5对低分化胃癌细胞的迁移和侵袭能力的影响及其作用机制,为寻找低分化胃癌的治疗靶点提供新的方向。
1 材料和方法
1.1 实验标本 选取2019年12月至2020年7月杭州师范大学附属医院行胃镜活检及手术且经病理学检查最终证实为低分化胃癌石蜡标本5例以及正常胃黏膜组织石蜡标本5例。本研究经杭州师范大学附属医院科研伦理委员会批准,批准文号:2019(伦02)-HS-27。
1.2 细胞及主要试剂 人低分化胃癌细胞株BGC-823和人正常胃黏膜上皮细胞株GES-1由本课题组保存。兔源IRF5抗体、兔源基质金属蛋白酶-9(MMP-9)抗体均购自美国abcam公司,辣根过氧化物酶标记GAPDH抗体购自美国CST公司;辣根过氧化物酶标记山羊抗兔IgG(H+L)抗体、嘌呤霉素、RIPA裂解液均购自上海碧云天公司;BCA定量法试剂盒、脂质体3000均购自美国ThermoFisher公司;双荧光素酶报告基因试剂盒Dual-Luciferase Reporter Assay System购自美国Promega公司;RPMI1640购自美国Gibco公司;逆转录及荧光定量PCR试剂盒均购自日本TAKARA公司;Matrigel基质胶、Transwell小室均购自美国Corning公司;慢病毒为载体的IRF5 shRNA、MMP-9过表达慢病毒液及空载病毒、IRF5空载质粒及IRF5过表达质粒、pGL3-basic质粒及pGL3-MMP-9质粒均由广州锐博生物技术有限公司合成。
1.3 细胞培养和转染 细胞培养于5%FBS的RPMI1640培养基中,于37℃含5% CO2培养箱中培养,隔天换液。取处对数生长期的BGC-823细胞,分别加入稀释后的IRF5 shRNA慢病毒液及空载病毒液,转染24 h后弃含病毒液的旧培养基,加入新鲜培养基。培养48~96 h后,采用2 μg/ml嘌呤霉素筛选,得到IRF5敲低的BGC-IRF5组及作为对照的BGC-NC组。BGC-IRF5组细胞加入MMP-9过表达慢病毒液,经过转染筛选得到MMP-9高表达的BGC-MMP-9 Over组细胞。
1.4 胃组织中IRF5和MMP-9相对表达水平检测 采用免疫组化法。低分化胃癌组织和正常胃黏膜组织标本脱蜡后放入盛有柠檬酸的溶液中,随后进行高温抗原修复。3%过氧化氢进行室温避光孵育10 min,PBS洗3次后正常山羊血清封闭1 h。除去血清后,每张玻片加IRF5或MMP-9一抗,4℃孵育过夜。PBS洗3次后加羊抗兔二抗,室温孵育1 h。新鲜配制的DAB溶液显色5 min,自来水水洗4 min终止显色。苏木素复染细胞核3~5 min,梯度乙醇脱水,二甲苯透明后中性树脂封片。各个样本在高倍显微镜(400倍)下随机拍摄3张,使用Image-Pro Plus 6.0分析平均光密度,以正常组织为对照计算相对表达水平。
1.5 IRF5和MMP-9 mRNA相对表达水平检测 采用RT-PCR法。采用Trizol提取各组细胞总RNA,按照试剂盒说明书将细胞总RNA逆转录成cDNA,进行荧光定量PCR。反应条件为:95℃预变性10 min,PCR:95℃ 15 s、60℃ 60 s,共40个循环,溶解曲线:95℃ 15 s、60℃ 60 s、95℃ 30 s,扩增结果以 Ct值显示。用2-ΔΔCt表示各组基因表达水平的倍比关系。每次实验至少重复3次。
1.6 IRF5和MMP-9蛋白相对表达水平检测 采用Western blot法。采用RIPA裂解液提取各组细胞内的蛋白,对细胞进行重复裂解后离心,BCA法测定蛋白浓度。每孔加入20 μg蛋白样品上样以后,进行SDSPAGE电泳。蛋白转移至PVDF膜上后,用5%脱脂奶粉 PBST常温封闭 1 h,IRF5或 MMP-9一抗(1∶1 000稀释),4℃孵育过夜。加入二抗,室温孵育1 h后,随后在化学发光成像系统获取条带。以GAPDH为内参,用目的蛋白/GAPDH代表目的蛋白的相对表达水平,每次实验至少重复3次。
1.7 细胞迁移能力检测 在6孔板中接种BGCIRF5组和BGC-NC组5×105个细胞,接种的细胞在培养板里分布均匀。接种原则为过夜后融合率达到90%。用灭菌的100 μl枪头在孔正中间画1条直线,吸除培养基,并用PBS将悬浮的细胞除去。加入无血清培养基,放入37℃含5% CO2培养箱培养。在0 h和24 h拍照记录划痕愈合程度,用Image J软件分析,计算相对迁移水平。每次实验至少重复3次。
1.8 细胞侵袭能力检测 Matrigel基质胶包被在Transwell小室底部膜的上室面,铺制均匀平整,置于37℃孵箱使胶凝固。BGC-MMP-9 Over组、BGC-IRF5组和BGC-NC组细胞血清饥饿24 h后,消化重悬,细胞浓度调整为1×106/ml。将200 μl悬液加入上室,在下室中加入约500 μl含10% FBS的培养基。37℃、5% CO2培养箱继续培养24 h。取出小室,吸弃上室液体,用PBS轻柔漂洗2次,4%多聚甲醛固定10 min,用棉签仔细擦净膜上未迁移的细胞。下室加入浓度为5 μg/ml的DAPI溶液,避光染色 15~20 min,吸去DAPI溶液,加入PBS溶液,荧光显微镜下观察计数,即为穿基底膜细胞数量。每次实验至少重复3次。
1.9 IRF5对MMP-9相对表达水平的调控 采用双荧光素酶报告基因实验检测。在24孔板中接种5×105个293T细胞,在含10% FBS的培养基中培养。使用脂质体3000分别共转染:IRF5空载质粒+pGL3-空载质粒,IRF5空载质粒+pGL3-MMP-9质粒,IRF5过表达质粒+pGL3-空载质粒,IRF5过表达质粒+pGL3-MMP-9质粒。48 h后获取细胞,相对荧光素酶活性检测使用Dual-Luciferase Reporter Assay System,操作按说明书使用。20 μl细胞裂解液加入至100 μl LARⅡ,检测发光读数,随后加入100 μl终止液体,再次读数。每次实验至少重复3次。
1.10 统计学处理 采用GraphPad Prism 8.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用Bonferroni t检验;两组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 低分化胃癌组织及正常胃黏膜组织IRF5与MMP-9相对表达水平比较 低分化胃癌组织中IRF5与MMP-9相对表达水平均明显高于正常胃黏膜组织,差异均有统计学意义(均P<0.05),见图1(插页)和表1。

表1 低分化胃癌组织和正常胃黏膜组织IRF5与MMP-9相对表达水平比较

图1 低分化胃癌组织和正常胃黏膜组织IRF5与MMP-9免疫组化检测所见(×400)
2.2 BGC-IRF5组、BGC-NC组和 GES-1组 IRF5 mRNA及蛋白相对表达水平比较 BGC-NC组IRF5 mRNA及蛋白相对表达水平均明显高于BGC-IRF5组和GES-1组,差异均有统计学意义(均P<0.05),见图2和表2。

表2 3组细胞IRF5 mRNA及蛋白相对表达水平比较

图2 3组细胞IRF5蛋白表达的电泳图
2.3 BGC-IRF5组和BGC-NC组相对迁移水平比较 BGC-IRF5组及BGC-NC组相对迁移水平分别为0.59±0.12和1.08±0.14,两组比较差异有统计学意义(P<0.05),见图 3。

图3 两组细胞相对迁移水平划痕图
2.4 BGC-MMP-9 Over组、BGC-IRF5组和BGC-NC组MMP-9 mRNA及蛋白相对表达水平、穿基底膜细胞数量比较 BGC-IRF5组较BGC-MMP-9 Over组和BGC-NC组MMP-9 mRNA及蛋白相对表达水平均明显下降,穿基底膜细胞数量均明显减少,差异均有统计学意义(均P<0.05)。见图4,图5(插页)和表3。

表3 3组MMP-9 mRNA及蛋白相对表达水平、穿基底膜细胞数量比较

图4 3组细胞MMP-9蛋白表达的电泳图
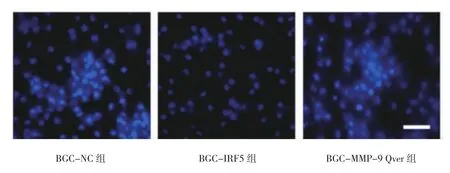
图5 3组细胞穿基底膜细胞数量比较(×400)
2.5 4种质粒相对荧光素酶活性比较 IRF5过表达质粒+pGL3-MMP-9质粒较IRF5空载质粒+pGL3-空载质粒、IRF5空载质粒+pGL3-MMP-9质粒和IRF5过表达质粒+pGL3-空载质粒相对荧光素酶活性均明显升高,差异均有统计学意义(均P<0.01),见表4。

表4 4种质粒相对荧光素酶活性比较
3 讨论
转移和侵袭是晚期胃癌最主要的特征,是导致患者胃癌复发和死亡的主要原因,其中低分化胃癌又是最容易发生转移的病理类型之一。肿瘤的侵袭和转移是一个多步骤、多阶段和多因素参与的复杂过程[11]。肿瘤细胞侵袭和迁移能力增强是引起肿瘤转移的重要作用机制,其中诸多分子相互协调,共同参与该过程[12]。因此从分子层面研究胃癌细胞侵袭、转移发生的过程,寻找相关分子,有助于寻找潜在药物干预靶点,改善胃癌患者预后。
研究表明IRF5在调节先天免疫和肿瘤细胞增殖、凋亡与侵袭方面起到至关重要的作用[5-6]。通过依赖或者非依赖p53途径,IRF5可以抑制肿瘤细胞的增殖,同时可促进肿瘤细胞凋亡[7,13]。此外,还有研究指出IRF5参与TNF相关凋亡诱导配体所诱导的肿瘤细胞凋亡[7,13]。在病毒相关的肿瘤发生中,IRF5可以抑制病毒复制,减少肿瘤发生[8,15]。然而,Massimino 等[16]发现IRF5在甲状腺癌细胞中表达水平显著增高,且IRF5异常增高可以增加甲状腺癌细胞的增殖能力,提示IRF5可能参与促进肿瘤的作用。上述研究结果提示IRF5在不同肿瘤细胞中可能发挥不同的作用。还有研究指出与正常乳腺组织及乳腺细胞相比,人乳腺肿瘤组织及肿瘤细胞中IRF5表达水平降低明显,当乳腺肿瘤细胞过表达IRF5后,其增殖及迁移能力会受到部分抑制,该机制研究表明此效应可能跟调控CXCR4表达水平相关[17]。本研究首次探讨了IRF5在低分化胃癌中的作用,结果表明在低分化胃癌细胞BGC-823中,敲低IRF5可降低胃癌细胞的侵袭能力,提示IRF5可能促进低分化胃癌细胞的侵袭、转移。由此可见,IRF5在低分化胃癌的转移中发挥重要作用,与低分化胃癌的发展关系密切。
IRF5影响低分化胃癌细胞侵袭、转移的具体分子机制目前仍不清楚。肿瘤细胞转移过程中,肿瘤细胞外基质的降解和基底膜破坏是首要条件,而MMP家族在该过程中扮演重要的角色[12]。研究表明MMP-9在胃癌发生、发展中发挥重要的作用,人胃癌组织中MMP-9相对表达水平显著高于周围相邻健康组织,且低分化胃癌中MMP-9相对表达水平高于高分化组织[18]。同时,MMP-9相对表达水平与胃癌细胞的侵袭和转移程度呈正相关[18-19]。MMP-9还参与HER2、HOXC6等上游分子调节胃癌细胞的侵袭和迁移过程[20-21]。本研究结果提示,下调IRF5可以降低低分化胃癌细胞的MMP-9相对表达水平,由此推测,IRF5可能通过调控MMP-9相对表达水平,破坏胃癌的基底膜,促进低分化胃癌的转移和侵袭。IRF5与MMP的调控机制目前尚未详细阐明。在急性心肌梗死组织中,下调IRF5可显著降低组织中MMP-9相对表达水平[22]。该结论与本研究团队在BGC-823细胞中得到的结论一致。此外,有研究指出在人原代软骨细胞中IRF5可以调控MMP-3相对表达水平,具体分子机制可能是IRF5直接结合MMP-3启动子区域和与NF-κB分子协同调节MMP-3相关[23]。上述研究结果均提示IRF5可能通过多种机制调节MMP-9相对表达水平。本研究结果提示IRF5可通过直接结合MMP-9启动子区域,发挥对MMP-9启动子区域的调节,继而影响MMP-9相对表达水平。
综上所述,IRF5可以促进低分化胃癌的侵袭和迁移,该效应可能通过调控MMP-9来完成。本研究为降低低分化胃癌侵袭能力提供了新的治疗靶点。在未来的研究中,本团队将在动物水平进一步论证,充分探讨IRF5在低分化胃癌迁移和侵袭中的功能及机制。

