萝卜硫素对急性低温暴露鼠骨骼肌Nrf2介导的抗氧化能力的影响
徐 磊,贾 杰,江秉泽,张 缨*
1北京体育大学运动与体质健康教育部重点实验室;2北京体育大学运动人体科学学院,北京 100084
骨骼肌是低温环境下机体产热的重要器官。低温环境下骨骼肌以战栗性与非战栗性产热来维持体温稳态[1],此过程需要水解大量的ATP,将其化学能转变为机体所需的热能[2]。骨骼肌在低温环境下主要以提高脂肪酸氧化分解速率满足产热需求[3],而线粒体脂肪酸氧化速率的增加伴随着活性氧(reactive oxygen species,ROS)的加速产生[4]。已有研究表明,急性或长期低温暴露使老鼠的静息代谢速率和骨骼肌ROS水平增加[5,6]。而ROS水平的增加会引起骨骼肌蛋白质、核酸和脂质的氧化损伤,进而影响骨骼肌的运动表现与恢复[7]。因此,及时清除低温环境下骨骼肌产生的大量ROS,提高骨骼肌的抗氧化能力,对维持其正常生理功能至关重要。
核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)介导的抗氧化防御系统,在维持细胞氧化还原稳态中起着非常重要的作用[8]。当细胞处于氧化应激时,胞质中的Nrf2则不会被其负性调节蛋白——Kelch样环氧氯丙烷相关蛋白-1(epoxy chloropropane Kelch sample related protein-1,Keap1)泛素化降解,进而入核与众多基因启动子上的抗氧化反应元件(antioxidant response element,ARE)结合,上调大多数的抗氧化酶和II期解毒酶的表达,对机体的氧化应激刺激起保护作用[9]。然而,研究发现,急性或长期低温暴露使鼠心脏、肝脏及肺组织器官中Nrf2mRNA及其蛋白表达显著降低[10-12],表明在低温环境下可能抑制组织器官Nrf2的表达。但急性低温暴露是否也同样抑制骨骼肌Nrf2表达及其抗氧化能力?国内外未见报道。
萝卜硫素(sulforaphane,SFN)在十字花科植物中含量丰富,被公认为是Nrf2的特异激活剂[13]。因此,本研究试图首先观察1和3 h不同时长的急性低温暴露,对小鼠骨骼肌Nrf2和抗氧化酶表达及抗氧化能力的影响;进而在此基础上,进一步探讨在低温暴露前给予SFN,对骨骼肌Nrf2介导的抗氧化酶系统和谷胱甘肽氧化还原稳态的作用。本研究将为探究SFN作为低温环境下运动营养补充品的可能性提供前期实验依据。
1 材料与方法
1.1 实验动物
70只8周龄健康雄性C57BL/6N小鼠分两批购于北京维通利华实验动物技术有限公司,许可证编号为:SCXK(京)2016-0006。动物购进后适应性饲养3天,饲养条件:每笼饲养3~4只,饲养温度和湿度分别维持在25 ℃左右和65%左右,12 h明暗循环,整个饲养过程中动物自由进食和饮水。该动物实验经过了北京体育大学运动科学实验伦理委员会的批准(批准号:2021042A),实验严格遵循3R原则,给予人道关怀。
1.2 实验药物与试剂
萝卜硫素(中国深圳市福山生物科技有限公司);活体组织氧化应激ROS高质荧光测定试剂盒(上海杰美基因医药科技有限公司,货号:GMS10016.3 v.A);总抗氧化能力检测试剂盒、还原型谷胱甘肽和氧化型谷胱甘肽含量检测试剂盒(北京索莱宝科技有限公司,货号:BC1315、BC1175、BC1185);RT-PCR试剂盒和SYBR Green Realtime PCR Master Mix(TOYOBO公司,货号:FSQ-101、QPK-201);RT-qPCR引物:谷胱甘肽过氧化酶1(Gpx1)、血红素加氧酶(Hmox1)、过氧化氢酶(Cat)、超氧化物歧化酶1(Sod1)、醌氧化还原酶1(Nqo1)、谷氨酸半胱氨酸连接酶催化亚基(Gclc)、谷胱甘肽还原酶(Gsr)、18s(Qiagen公司,货号:QT01195936、QT00159915、QT01058106、QT001650 39、QT00094367、QT00130543、QT01758232、QT02448075),Nrf2、谷氨酰半胱氨酸连接酶调节亚基(Gclm)和谷胱甘肽合成酶(Gss)的引物在Invitrogen公司合成,具体引物序列见表1;RIPA裂解液(碧云天公司,货号:P0013B);Pierce蛋白酶和磷酸酶抑制剂微型片剂、BCA试剂盒、Bolt 4%-12% Bis-Tris Plu凝胶(ThermoFisher Scientific公司,货号:A32961、23225、NW04125BOX);一抗:Nrf2、GPX1、SOD1、NQO1、β-actin(Santa Cruz Biotechnology公司,货号:sc-365949、sc-22145、sc-11407、sc-32793、sc-47778);HMOX1(Abcam公司,货号:ab13248);CAT(Proteintech公司,货号:66765-1-Ig)。

表1 Nrf2、Gclm和Gss的引物序列Table 1 The primer sequence of Nrf2,Gclm and Gss
1.3 仪器
快速组织破碎仪(美国NEXT ADVANCE公司,型号:BBY24M);iBlot2转膜仪(ThermoFisher Scientific公司,型号:IB23001);摇床(海门其林贝尔公司,型号:TS-100);低温离心机(德国Epperndorf公司,型号:Centrifuge 5424R);荧光定量PCR仪(ThermoFisher Scientific公司,型号:ABI7500);多功能微孔板检测仪(美国Bio-Tek公司,型号:Bio-Tek SynergyTMH1);Bio-Rad凝胶成像分析仪(美国伯乐公司,型号:BIO-RADXR)。
1.4 动物分组及干预
首先,30只8周龄健康雄性C57BL/6N小鼠随机分为3组,每组10只:常温对照组(0 h组)、低温暴露1 h组(1 h组)和低温暴露3 h组(3 h组)。常温对照组置于25 ± 1 ℃的室温环境,低温暴露组则分别置于4 ± 1 ℃冷库1、3 h,在此期间各组均能自由饮水和进食。
其次,40只8周龄健康雄性C57BL/6N小鼠随机分为4组,每组10只:磷酸缓冲盐溶液(phosphate buffer saline,PBS)常温对照组(PBS+Con)、PBS低温暴露3 h组(PBS+Cold)、SFN常温对照组(SFN+Con)和SFN低温暴露3 h组(SFN+Cold)。小鼠在进行急性温度干预前72、48、24和3 h这4个时间点通过腹腔注射SFN或等体积PBS[14]。SFN溶解于PBS中,每只小鼠每次的注射剂量为25 mg/kg和0.2 mL。常温对照组置于25 ± 1 ℃的室温环境,低温暴露组则置于4 ± 1 ℃冷库3 h,在此期间各组均能自由饮水和进食。
1.5 取材
急性低温暴露结束后即刻将小鼠颈椎脱臼处死,迅速取小鼠腿部的腓肠肌和股四头肌,称重,编号,投入液氮,随后转入-80 ℃冰箱保存待用。
1.6 骨骼肌ROS水平测定
骨骼肌ROS水平采用活体组织氧化应激ROS高质荧光测定试剂盒测定。取各组50 mg腓肠肌置于提前加入GENMED清洗液的匀浆管并清洗,弃去清理液,用滤纸吸干。然后加入GENMED稀释液,用剪刀将组织剪碎,匀浆,并用BCA法测蛋白浓度。根据蛋白浓度规定上样量为10 μL和50 μg蛋白,随后在避光酶标板相应孔内加入190 μL的GENMED染色工作液,37 ℃避光孵育20 min,激发波长490 nm,散发波长520 nm检测荧光强度值。计算与空白荧光强度差值,以表示该孔ROS水平。
1.7 骨骼肌总抗氧化能力测定
骨骼肌总抗氧化能力(total antioxidant capacity,T-AOC)采用T-AOC检测试剂盒测定。先按照说明书绘制标准曲线。再取50 mg股四头肌组织放入提前加入预冷提取液的匀浆管内匀浆,后离心5 min(4 ℃,10 000 rpm),取上清用BCA法测蛋白浓度。同时按照说明书,用96孔板测定空白管和测定管在593 nm处的吸光值,计算差值并代入标准曲线中得到各组中Fe2+的浓度,最后按照说明书提供的按蛋白浓度计算的公式得到各组的T-AOC。
1.8 骨骼肌还原型谷胱甘肽、氧化型谷胱甘肽含量及两者比值
骨骼肌还原型谷胱甘肽(reduced glutathione,GSH)和氧化型谷胱甘肽(oxidized glutathione,GSSG)含量分别采用还原型谷胱甘肽和氧化型谷胱甘肽含量检测试剂盒测定。取各组股四头肌称重并记录,再按照说明书绘制标准曲线。再将称好的股四头肌放入提前加入预冷试剂一的匀浆管内匀浆,后离心10 min(4 ℃,8 000 rpm),转移上清置于4 ℃待测。按照说明书,用96孔石英板测定空白管和样本管在412 nm处的吸光值,计算差值代入标准曲线并按照说明书提供的按样本质量计算的公式得到各组的GSH含量。再按照说明书,用96孔石英板分别测定空白管和样本管在412 nm处30 s与150 s的吸光值,再将样本管两个时间点吸光度差值减去空白管两个时间点吸光度差值,最后将这个差值代入标准曲线并按照说明书提供的按样本质量计算的公式得到各组的GSSG含量。
1.9 实时荧光定量PCR
取50 mg腓肠肌加入0.8 mL预冷Trizol中,剪碎,匀浆后,依次采用氯仿、异丙醇、75%酒精进行分离提纯总RNA,用紫外分光光度计测定总RNA的纯度和浓度,采用RT-PCR试剂盒将RNA逆转录为cDNA,然后用PCR扩增仪扩增。随后采用ABI7500荧光定量PCR仪,以由SYBR Green Realtime PCR Master Mix、引物、cDNA模板和dd H2O构成的20 μL反应体系进行实时荧光定量PCR检测。使用ABI7500 PCR仪自带的软件对实时荧光定量CT值进行读取,用比较CT法对目的基因表达结果进行相对定量。具体计算公式为:目的基因=2-△△CT。
1.10 Western blot
按照0.05 g Pierce蛋白酶和磷酸酶抑制剂微型片剂溶于10 mL RIPA裂解液来配置蛋白提取液。取50 mg腓肠肌组织加入含有匀浆珠和1 mL蛋白提取液的匀浆管中,并充分匀浆,随后置于冰上静置30 min,再离心30 min(4 ℃,12 000 rpm),最后提取上清。利用BCA试剂盒测定组织总蛋白浓度,并根据蛋白浓度与上样蛋白量20 μg计算上样体积。电泳时采用Bolt 4%~12% Bis-Tris Plu凝胶分离目的蛋白,随后采用iBlot2转膜仪进行转膜。5% BSA封闭1 h,而后加入一抗并置于4 ℃摇床过夜。4 ℃孵育过夜后,用1×TBST洗膜3次,每次10 min。加入相应二抗,置于摇床室温孵育1 h。再用1×TBST洗膜3次,每次10 min。最后用Bio-Rad凝胶成像分析仪和Image Lab软件进行条带检测和灰度值分析。
1.11 统计学分析
用SPSS 22.0软件对数据进行统计学分析,结果表示为平均数±标准误。采用单因素方差分析和双因素方差分析对数据进行分析,P<0.05和P<0.01分别代表具有显著性和非常显著性差异。
2 结果
2.1 不同时长急性低温暴露对小鼠骨骼肌Nrf2介导的抗氧化酶mRNA转录水平和ROS水平的影响
由图1可知,与0 h组相比,3 h组小鼠骨骼肌Nrf2mRNA转录水平呈下降趋势,Gpx1、Hmox1、Cat和Nqo1mRNA转录水平显著降低(P<0.05),且ROS水平显著增加(P<0.05),而1 h组并无变化。与1 h组相比,3 h组小鼠骨骼肌Nrf2、Gpx1、Cat、Sod1和Nqo1mRNA转录水平显著降低(P<0.05),且ROS水平显著增加(P<0.01)。

图1 不同时长急性低温暴露对小鼠骨骼肌Nrf2介导的抗氧化酶mRNA转录水平和ROS水平的影响Fig.1 Effects of different time acute cold exposure on the mRNA transcription of antioxidant enzymes mediated by Nrf2 and ROS level in mice skeletal muscle注:与0 h组相比,*P <0.05,**P <0.01;与1 h组相比,#P <0.05,##P <0.01。Note:Compared with 0 h group,*P <0.05,**P <0.01;Compared with 1 h group,#P <0.05,##P <0.01.
2.2 SFN对急性低温暴露小鼠骨骼肌Nrf2表达、ROS水平和T-AOC的影响
由图2可知,与PBS+Con组相比,PBS+Cold组小鼠骨骼肌Nrf2蛋白表达呈降低趋势,且T-AOC水平显著降低(P<0.01),而ROS水平呈增加趋势。与PBS+Cold组相比,SFN+Cold组小鼠骨骼肌Nrf2mRNA及其蛋白表达和T-AOC显著增加(P<0.05),而ROS水平显著降低(P<0.05)
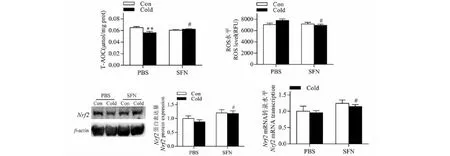
图2 SFN对急性低温暴露小鼠骨骼肌T-AOC、ROS水平和Nrf2表达的影响Fig.2 Effects of SFN on T-AOC,ROS level and Nrf2 expression in skeletal muscle of mice exposed to acute cold注:与PBS+Con组相比,**P <0.01;与PBS+Cold组相比,#P <0.05。Note:Compared with PBS+Con group,**P <0.01;Compared with PBS+Cold group,#P <0.05.
2.3 SFN对急性低温暴露小鼠骨骼肌谷胱甘肽抗氧化系统的影响
由图3可知,与PBS+Con组相比,PBS+Cold组小鼠骨骼肌GSSG含量和GSH/GSSG分别显著增加和降低(P<0.05);而SFN+Con组小鼠骨骼肌GssmRNA转录水平显著增加(P<0.05),且GSH含量显著降低(P<0.01)。与PBS+Cold组相比,SFN+Cold组小鼠骨骼肌Gclm和GssmRNA转录水平显著增加(P<0.05),且GSH含量显著降低(P<0.01),GSSG含量和GSH/GSSG分别显著降低和增加(P<0.01)。

图3 SFN对急性低温暴露小鼠骨骼肌谷胱甘肽抗氧化系统的影响Fig.3 Effect of SFN on glutathione antioxidant system in skeletal muscle of mice exposed to acute cold注:与PBS+Con组相比,*P <0.05,**P <0.01;与PBS+Con或PBS+Cold组相比,#P <0.05,##P <0.01。Note:Compared with PBS+Con group,*P <0.05,**P <0.01;Compared with PBS+Con or PBS+Cold group,#P <0.05,##P <0.01.
2.4 SFN对急性低温暴露小鼠骨骼肌Nrf2介导的抗氧化酶mRNA转录水平的影响
由图4可知,与PBS+Con组相比,PBS+Cold组小鼠骨骼肌Gpx1、Hmox1、Cat、Sod1和Nqo1mRNA转录水平均呈降低趋势。与PBS+Cold组相比,SFN+Cold组小鼠骨骼肌Gpx1、Hmox1、Cat、Sod1和Nqo1mRNA转录水平均显著增加(P<0.01)。

图4 SFN对急性低温暴露小鼠骨骼肌Nrf2介导的抗氧化酶mRNA转录水平的影响Fig.4 Effect of SFN on the mRNA transcription of antioxidant enzymes mediated by Nrf2 in skeletal muscle of mice exposed to acute cold注:与PBS+Cold组相比,##P <0.01。Note:Compared with PBS+Cold group,##P <0.01.
2.5 SFN对急性低温暴露小鼠骨骼肌Nrf2介导的抗氧化酶蛋白表达的影响
由图5可知,与PBS+Con组相比,PBS+Cold组小鼠骨骼肌HMOX1和CAT蛋白表达显著降低(P<0.05)。与PBS+Cold组相比,SFN+Cold组小鼠骨骼肌HMOX1和SOD1蛋白表达显著增加(P<0.05)。

图5 SFN对急性低温暴露小鼠骨骼肌Nrf2介导的抗氧化酶蛋白表达的影响Fig.5 Effect of SFN on the protein expression of antioxidant enzymes mediated by Nrf2 in skeletal muscle of mice exposed to acute cold注:与PBS+Con组相比,*P <0.05;与PBS+Cold组相比,#P <0.05。Note:Compared with PBS+Con group,*P <0.05;Compared with PBS+Cold group,#P <0.05.
3 讨论与结论
Nrf2是维持骨骼肌氧化还原稳态的核心调控因子[15]。已有研究报道,低温暴露抑制心脏、肝脏及肺等组织器官Nrf2表达,可导致这些器官ROS大量产生而无法被清除[10-12]。然而,急性低温暴露对骨骼肌Nrf2表达及其抗氧化能力的影响,目前未见报道。因此,本研究首先探讨1和3 h低温暴露对骨骼肌Nrf2介导的抗氧化系统的影响,结果发现,3 h低温暴露小鼠骨骼肌Nrf2mRNA转录水平显著降低,而ROS水平显著升高。后续的实验结果同样显示,与PBS+Con组相比,PBS+Cold组小鼠骨骼肌Nrf2蛋白表达呈降低趋势,且T-AOC水平显著降低,而ROS水平呈增加趋势。由此推测,3 h低温暴露可能抑制了小鼠骨骼肌Nrf2的表达,降低其抗氧化能力。
3 h低温暴露使骨骼肌抗氧化能力降低,可能与Nrf2介导的抗氧化酶表达和谷胱甘肽氧化还原稳态受到抑制有关。已有研究报道,3 h急性低温暴露可使小鼠肾脏、肺组织以及棕色脂肪SOD1表达显著下降[16]。间歇性低温暴露(每天8 h,共3天)大鼠肺组织GPX1活性和HMOX1蛋白表达显著降低[12]。长期低温暴露(每天4 h,每周6天,共2周)小鼠脑组织SOD1活性及CAT蛋白表达显著下降[17]。本研究发现,与0和1 h组相比,3 h组小鼠骨骼肌抗氧化酶基因(Gpx1、Hmox1、Cat、Sod1、Nqo1)mRNA转录水平显著降低。后续的实验结果同样显示,与PBS+Con组相比,PBS+Cold组小鼠骨骼肌抗氧化酶基因(Gpx1、Hmox1、Cat、Sod1、Nqo1)mRNA转录水平呈降低趋势,且HMOX1和CAT蛋白表达显著降低。由此可知,3 h低温暴露可能抑制了Nrf2介导的抗氧化酶的转录、翻译,从而影响骨骼肌的抗氧化能力。另外有研究表明,急性低温暴露可使人红细胞中的GSSG含量和GSH/GSSG的比率降低[18]以及大鼠肝脏和胃组织的GSH含量减少[19]。本研究结果显示,与PBS+Con组相比,PBS+Cold组小鼠骨骼肌GSSG含量和GSH/GSSG比值分别显著增加和降低,而GSH含量变化不大。表明GSSG的堆积可能是GSH/GSSG比值降低的主要原因。
SFN对Nrf2的特异性激活效应已得到了广泛的证实。研究发现,12周的SFN饮食干预激活了老年小鼠趾长伸肌Nrf2调控的抗氧化酶系统,提高老年小鼠肌肉力量和运动耐力[20]。此外,大鼠在力竭运动前3天腹腔注射SFN,其血浆乳酸脱氢酶和肌酸磷酸激酶活性降低,并且股外侧肌Nrf2及抗氧化酶(NQO1、GST、GSR)蛋白表达及活性提高,且运动至力竭的时间和距离增加[21]。以上研究结果表明,SFN激活Nrf2对其介导的抗氧化能力和运动耐力的提高有着重要作用。因此,为改善3 h低温暴露过程中骨骼肌抗氧化能力的降低,我们在小鼠3 h低温暴露前给予SFN补充。实验结果显示,SFN+Cold组与PBS+Cold组小鼠相比,其骨骼肌Nrf2mRNA及其蛋白表达和T-AOC显著增加,且ROS水平显著降低。提示,SFN激活Nrf2可提高3 h低温暴露骨骼肌的T-AOC,消除过量的ROS,对维持骨骼肌的氧化还原稳态有着积极的作用。
补充SFN提高低温暴露小鼠骨骼肌抗氧化能力,与SFN激活Nrf2介导的抗氧化酶系统密切相关。Nrf2调控的内源性抗氧化酶是清除ROS的主要执行者。例如,SOD1催化超氧阴离子自由基歧化生成氧气和过氧化氢;CAT可将过氧化氢歧化为水和氧气;GPX1以GSH为底物催化过氧化氢或有机过氧化物生成水和相应的醇;NQO1催化醌发生双电子还原反应形成氢醌,并促进醌的排泄,防止醌通过单电子还原反应产生ROS;HMOX1催化有毒的游离血红素分解生成具有抗氧化损伤功能的胆绿素、CO和亚铁离子[22]。本研究结果显示,在3 h低温暴露前给予SFN,我们发现SFN+Cold组小鼠与PBS+Cold组相比,骨骼肌抗氧化酶基因(Gpx1、Hmox1、Cat、Sod1、Nqo1)mRNA转录水平和HMOX1、SOD1蛋白表达显著增加。以上结果表明,SFN激活Nrf2增强这些抗氧化酶基因的转录、翻译。
另外,补充SFN提高低温暴露小鼠骨骼肌抗氧化能力,除了抗氧化酶表达增强外,也与SFN激活Nrf2介导的谷胱甘肽氧化还原系统密切相关。谷胱苷肽是由谷氨酸、半胱氨酸和甘氨酸组成的三肽,是生物体抗氧化防御系统中重要的小分子活性寡肽[23]。细胞中谷胱甘肽主要以GSH的形式存在,其分子中半胱氨酸的活性巯基可提供电子给ROS,而后GSH转化生成稳定的二聚体GSSG,以阻止ROS持续地抢夺电子,使蛋白质、脂质和核酸免受氧化损伤,进而维持细胞的氧化还原稳态[24]。机体内GSH的生成主要通过合成和还原两种途径。首先,谷氨酸和半胱氨酸在GCLC与GCLM的催化下生成谷氨酰半胱氨酸,随后谷氨酰半胱氨酸与甘氨酸在GSS的催化下生成GSH;其次,GSSG在NADPH和GSR的作用下可被还原为GSH[25]。因此,Gclc、Gclm、Gss和Gsr是调控生成GSH的关键酶基因,并且是Nrf2下游靶基因[26]。我们发现,给予SFN补充后,SFN+Cold组小鼠与PBS+Cold组相比,骨骼肌谷胱甘肽合成酶基因Gclm、Gss、GsrmRNA转录水平显著增加,且GSH和GSSG含量显著降低。推测,这可能是急性低温应激,SFN补充可增强GSH的从头合成和还原途径,但GSH在急性低温暴露引起大量ROS产生的消除中发挥重要作用,最终造成了GSH的大量消耗。而从评估机体氧化还原平衡的关键指标GSH/GSSG比值上看,SFN+Cold组的GSH/GSSG显著提高。
综上,本研究表明3 h急性低温暴露抑制了Nrf2介导的抗氧化作用。而低温暴露前给予萝卜硫素,则激活了Nrf2介导的抗氧化酶和谷胱甘肽抗氧化系统,增强了骨骼肌抗氧化能力。

