黑果枸杞花青素结构差异对其稳定性及细胞抗氧化活性的影响
邓 楷,欧阳健,3,胡 娜,王洪伦*
1中国科学院藏药研究重点实验室,西宁 810008; 2中国科学院大学,北京 100049;3湖州中科高原生物创新中心,湖州 313000
黑果枸杞是生长于青藏高原上的一种多年生灌木植物,具有防止土壤盐碱化、改善生态环境等诸多生态功能[1]。药理学研究也表明黑果枸杞具有抗炎、抗氧化、降糖降脂、增强免疫力、抗疲劳、抗炎症等诸多活性[2],其价值逐渐被社会所重视并成为研究的热点。
花青素因其自身结构等原因在应用时容易不稳定,而稳定性制约着花青素的发展。如B环上取代基上的羟基或甲基会降低其稳定性,酰基化以及糖基的种类、数量、结合位点也影响着花青素的稳定性[3]。Chen[4]的研究也表明外界的金属离子、氧化剂、还原剂对黑果枸杞花青素的稳定性有一定影响。花青素的结构对其生物活性也有着重要的影响,Rahman[5]的结果表明4′-OH甲基化显著降低花青素的抗氧化活性,糖苷相较于花青素母核结构对抗氧化活性的影响较小。由此可见稳定性和抗氧化活性都与结构有着不可分割的关系,因此讨论结构对其二者的影响有助于加深我们对花青素的内在了解,并促进它的进一步开发与利用。
黑果枸杞中富含大量花青素,但目前研究普遍集中在其花青素的稳定性和药理活性的独立研究上。比如在稳定性上,Hu[6]对黑果枸杞花青素进行了pH稳定性评价,结果表明随着pH的增加花青素愈发容易降解,Luan[7]也证实多酚提取物对黑果枸杞花青素有一定的稳定作用。在药理活性上,黑果枸杞花青素具有对PC12细胞良好的细胞保护作用[8],以及缓解D-半乳糖诱导的记忆障碍[9]。然而,现阶段还未有研究讨论黑果枸杞花青素的结构变化对其稳定性以及细胞抗氧化活性的影响,这在一定程度上制约了黑果枸杞及花青素的研究及应用。本研究通过稳定性实验、计算化学以及氧化损伤细胞模型评价了花青素化合物,其结构相关性的讨论可为后续黑果枸杞花青素的稳定性以及活性研究提供有益的参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
黑果枸杞鲜果于2019年10月采摘自青海省都兰县(东经96.43°,北纬36.44°,海拔3 000 m),采摘后经中国科学院西北高原生物研究所高庆波研究员鉴定为黑果枸杞(LyciumruthenicumMurr.),标本存放于中国科学院西北高原生物研究所藏药研究重点实验室。将鲜果置于40 ℃烘箱内低温烘干4天后得到黑果枸杞干果,并于-20 ℃储存备用。
乙腈(色谱纯,上海展云化工有限公司);AB-8大孔树脂(河北宝恩生物科技有限公司);三氟乙酸(分析纯,天津大茂化学试剂厂);无水乙醇、氢氧化钠、冰醋酸、硼酸、磷酸(分析纯,浙江中星化工试剂有限公司);氘代甲醇、氘代三氟乙酸(色谱纯,阿拉丁试剂(上海)有限公司)。高糖培养基、胎牛血清、青霉素-链霉素(美国康宁公司);CCK-8试剂盒(武汉博士德生物工程有限公司);细胞裂解液,BCA蛋白检测试剂盒(北京索莱宝科技有限公司);乳酸脱氢酶试剂盒(南京建成生物工程研究所)。
1.1.2 仪器与设备
半制备型高效液相色谱仪(NP7000,江苏汉邦科技有限公司);高效液相色谱系统(Agilent 1100,美国惠普公司);核磁共振仪(DRX-400,德国布鲁克科技有限公司);酶标仪(Varioskan Flash,赛默飞世尔科技公司);生化培养箱(SPX-150B-Z,上海博迅医疗生物仪器股份有限公司);旋转蒸发仪(N-1300,东京理化器械株式会社);管式离心机(GF105,辽阳天圣达制药机械有限公司);恒温二氧化碳培养箱(ICP500,德国Memmert公司);双人单面净化工作台(SW-CJ-1C,上海沪净医疗器械有限公司);超低温冰箱(DW-86L578J,青岛海尔股份有限公司);电子分析天平(AB104-N,瑞士METTLER TOLEDO公司);恒温摇床(THZ-100,上海一恒科学仪器有限公司)。
1.2 方法
1.2.1 黑果枸杞花青素的分离及鉴定
1.2.1.1 黑果枸杞花青素的提取纯化
黑果枸杞干果以料液比(1∶20)的70%乙醇浸泡过夜,50 ℃超声波辅助提取60 min,管式离心机离心去除杂志后,旋转蒸发仪以50 ℃去除提取液中的醇,随后使用AB-8大孔树脂富集纯化,以5倍柱体积的纯水冲洗以便洗脱吸附在树脂上的蛋白质和糖类,随后使用3倍柱体积的95%乙醇溶液洗脱,旋转蒸发仪50 ℃浓缩洗脱液。得到的黑果枸杞花青素粉末,经pH示差法计算[10],花青素含量为363.19 ± 3.06 mg/g(锦葵色素计)。
1.2.1.2 黑果枸杞花青素的分离制备
将黑果枸杞花青素粉末溶解于0.1%盐酸-甲醇并使其终浓度为5.0 mg/mL,进样量为1.0 mL。色谱柱:XAqua C18柱(21.2 mm×250 mm,5 μm);流动相流速18.0 mL/min,流动相A为0.6%三氟乙酸/水,流动相B为乙腈,洗脱程序:0 min,10% B;0~20 min,10%→17% B;20~25min,17% B;25~55 min,17%→25% B;55~60 min,25%→90% B。双波长520 nm和280 nm进行检测,程序运行中所接的组分旋转蒸发去除溶剂后得到花青素化合物粉末,低温避光保存。
1.2.1.3 黑果枸杞花青素的结构鉴定
核磁共振(1H NMR 600 MHz)所用样品溶剂为氘代三氟乙酸/氘代甲醇(5∶95,V/V)。通过与已知文献中的氢谱数据和数据库进行比对,鉴定所分离的花青素化合物的结构。
1.2.2 黑果枸杞花青素的稳定性
通过测定化合物在不同pH溶液下储存前后在λmax处吸光度的变化来探究其稳定性的变化规律[11]。使用96孔酶标板,每孔加入提前与缓冲液反应的化合物溶液200 μL,并使每孔样品浓度为50 μM,反应平衡1 h后使用酶标仪测定λmax处吸光度,将酶标板置于25 ℃温度的暗培养箱中储存8 h并记录λmax处的吸光度。通过以下方程式计算花青素的降解率:
式中:D:花青素的降解率;A1:样品溶液平衡1 h的λmax吸光度;A2:样品溶液储存8 h的λmax吸光度。
1.2.3 黑果枸杞花青素的分子模拟
为了探究不同花青素结构可能会带来稳定性的影响,我们使用Hyperchem 8.0程序对花青素分子进行模拟,采用分子力学计算(MM+)和半经验量子力学计算(AM1)模拟花青素化合物的形态结构[12]。
1.2.4 黑果枸杞花青素的细胞活性
1.2.4.1 SH-SY5Y细胞培养及细胞损伤模型的构建
液氮中取出细胞冻存管,放于37 ℃水浴,尽快摇晃解冻,转移冻存液至离心管25 ℃、1 000 rpm离心5 min,弃上清,除去DMSO。用含有10%(V/V)胎牛血清、1%(V/V)青链霉素的DMEM培养基在37 ℃、5% CO2培养箱中复苏细胞,再用0.25%胰酶进行消化,细胞计数、传代。选择生长良好的3~4代细胞,待细胞长至80%~90%融合时,用于实验,更换无血清培养基使细胞饥饿6 h,同步细胞状态。舍弃旧培养基,加入含400 μM H2O2不含FBS的高糖培养基孵育4 h,建立细胞氧化损伤模型[13]。
1.2.4.2 细胞活力的测定
将正常培养的SH-SY5Y细胞以1×104个/孔的密度接种于96孔板中,在细胞培养箱中孵育12 h后,换成含有黑果枸杞花青素化合物1~4的DMEM高糖培养基(含10% FBS)继续培养4 h。培养至特定时间后,将原来的培养液弃掉,每孔加入100 μL含10% FBS的DMEM培养基。随后每孔加入10 μL CCK溶液,置于细胞培养箱中孵育2 h。最后在37 ℃水平摇床上继续孵育10 min,测定波长450 nm处的吸光度值。细胞活力计算公式如下:
式中:V:细胞活力;A3:含有细胞、药物和CCK溶液的孔的吸光度;A4:不含药物,含有细胞和CCK溶液的孔的吸光度;A0:不含细胞,含有培养基和CCK溶液的孔的吸光度。
1.2.4.3 细胞分组及药物处理
取对数生长期的SH-SY5Y细胞,以5×104个/mL的密度铺于6孔板,在含10% FBS的DMEM培养基中,每孔3 mL,培养48 h。加入400 μM的H2O2与化合物共孵育4 h。设置为对照组(DMEM+10% FBS),模型组(DMEM+400 μM H2O2),化合物给药组(DMEM+400 μM H2O2+化合物),模型给药组的化合物浓度根据细胞活力实验决定。
1.2.4.4 H2O2诱导氧化损伤SH-SY5Y细胞的乳酸脱氢酶(LDH)测定
共孵育4 h后,用1 mL PBS清洗1遍,加入300 μL胰蛋白酶消化,用PBS吹打细胞,于5 000 rpm、25 ℃离心5 min。加入PBS重悬细胞沉淀,超声破碎得到细胞悬液。LDH的测定按照试剂盒说明书操作。
2 结果与分析
2.1 黑果枸杞花青素的分离及鉴定
如图1所示,从黑果枸杞花青素提取物中分离得到了化合物1~4,通过核磁技术对花青素化合物的化学结构进行鉴定。
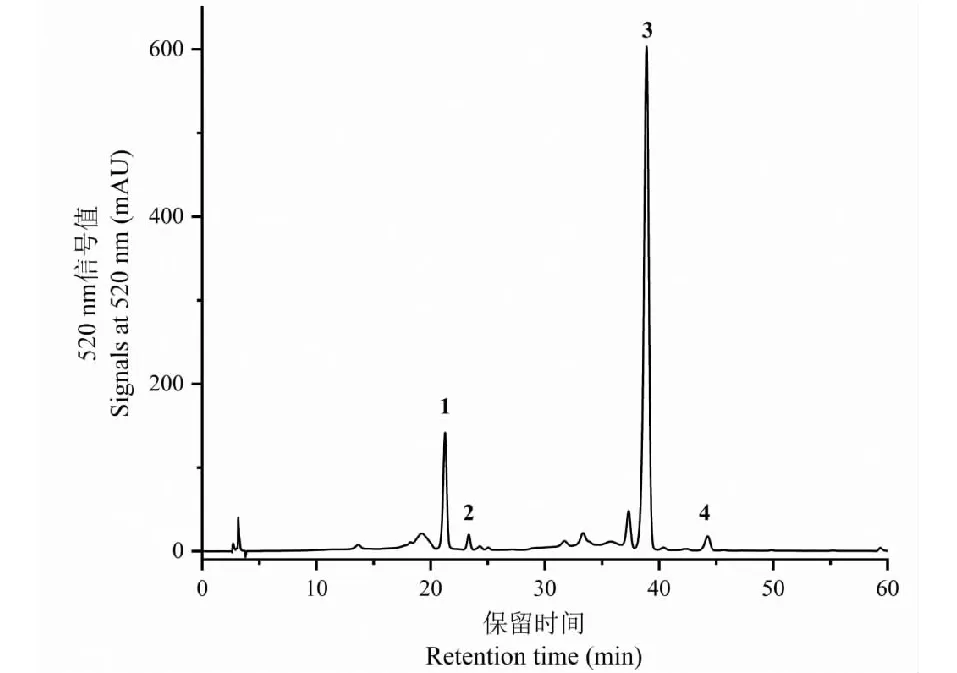
图1 黑果枸杞花青素半制备液相色谱图Fig.1 The semi-prepared HPLC chromatogram of anthocyanins from L.ruthenicum
经核磁共振波谱分析和数据库比对[14-16],1为petunidin-3-O-(glucosyl-trans-p-coumaroylrutinoside)-5-O-glucoside;2为petunidin-3-O-(glucosyl-cis-p-coumaroylrutinoside)-5-O-glucoside;3为petunidin-3-O-(trans-p-coumaroylrutinoside)-5-O-glucoside;4为malvidin-3-O-(trans-p-coumaroylrutinoside)-5-O-glucoside,化学结构如图2所示。
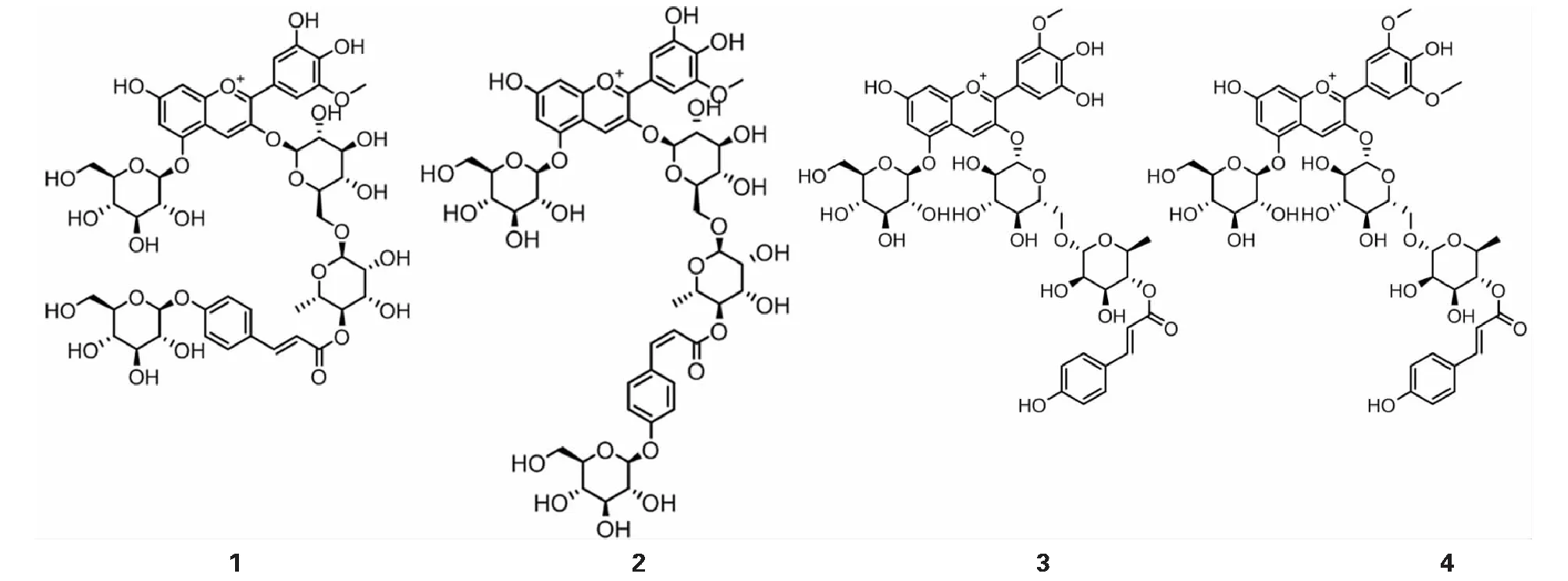
图2 黑果枸杞花青素化合物的化学结构Fig.2 The chemical structures of anthocyanin compounds from L.ruthenicum
2.2 黑果枸杞花青素的稳定性
2.2.1 黑果枸杞花青素不同pH下的稳定性
将黑果枸杞花青素化合物储存在25 ℃的暗培养箱中8 h以考察黑果枸杞花青素的稳定性。如图3所示,1与2是顺反异构,1在中性和弱碱性环境下有着更低的降解率,2在酸性条件下有着更低的降解率,结果说明反式结构在中性和弱碱性条件下有着更好的稳定性,而顺势结构在酸性条件下稳定性较好,这与文献所述一致[17]。现有研究表明花青素的稳定性随着B环上的甲氧基取代基的增加而增加,并随着羟基取代基的增多而减少[18],因此4与3相比,在各个pH条件下有着更低的降解率,说明B环上的甲氧基取代能明显提高花青素的稳定性。花青素的稳定性随着糖苷分子的数量增加而增加,文献表明接骨木果花青素中含有二糖苷的花青素比单糖类花青素更稳定[19],且二糖苷和三糖苷也被证实比单糖苷的花青素更稳定[20],所以1较于3,在弱酸性中性和弱碱性环境下降解率均有下降,表明糖基的增加可以增加一定的稳定性。
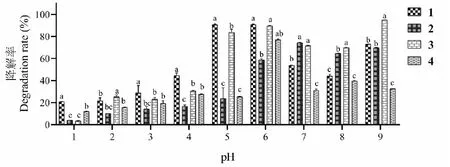
图3 黑果枸杞花青素化合物的在不同pH值下的降解率Fig.3 The degradation rates of anthocyanin compounds from L.ruthenicum at different pH注:不同字母代表组间差异显著,P<0.05;相同字母代表组间差异不显著,P>0.05。Note:Different letters indicated significant differences between groups,P<0.05;Same letters indicated no-significant differences between groups,P>0.05.
2.2.2 黑果枸杞花青素分子模拟模型
通过分子力学计算(MM+)和半经验量子力学计算(AM1)模拟花青素化合物在水中的形态结构,从而在一定程度上解释其稳定性与结构之间的关系,结果如图4所示。图注表示是香豆酰基与花青素母核的分子距离,花青素可以通过分子折叠保护母核免受亲水攻击,从而降低其降解率[12]。1有着4.23Å的分子间距且香豆酰基与花青素母核呈现平行的构象,而2的分子间距为8.00Å,其酰基与母核之间的构象呈现垂直,1与2互为顺反异构,结果表明反式结构能有效减少酰基和母核的分子距离从而达到保护母核免受亲水攻击。3的分子间距为6.08Å,糖基的缺少增加了分子间的距离,相对于1更易受到亲水攻击,4的分子间距为4.90Å,通过与3对比,B环上的甲氧基取代能有效减少分子间距,对花青素形成保护。细胞毒性,其结果如图5所示。在实验过程中我们发现花青素化合物需要加入少量的DMSO促溶,为
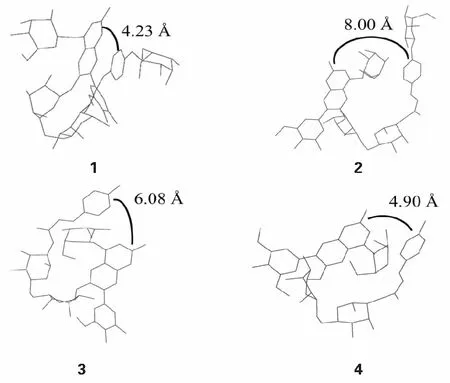
图4 黑果枸杞花青素化合物的分子结构模拟图Fig.4 The simulated molecular structures of anthocyanin compounds from L.ruthenicum
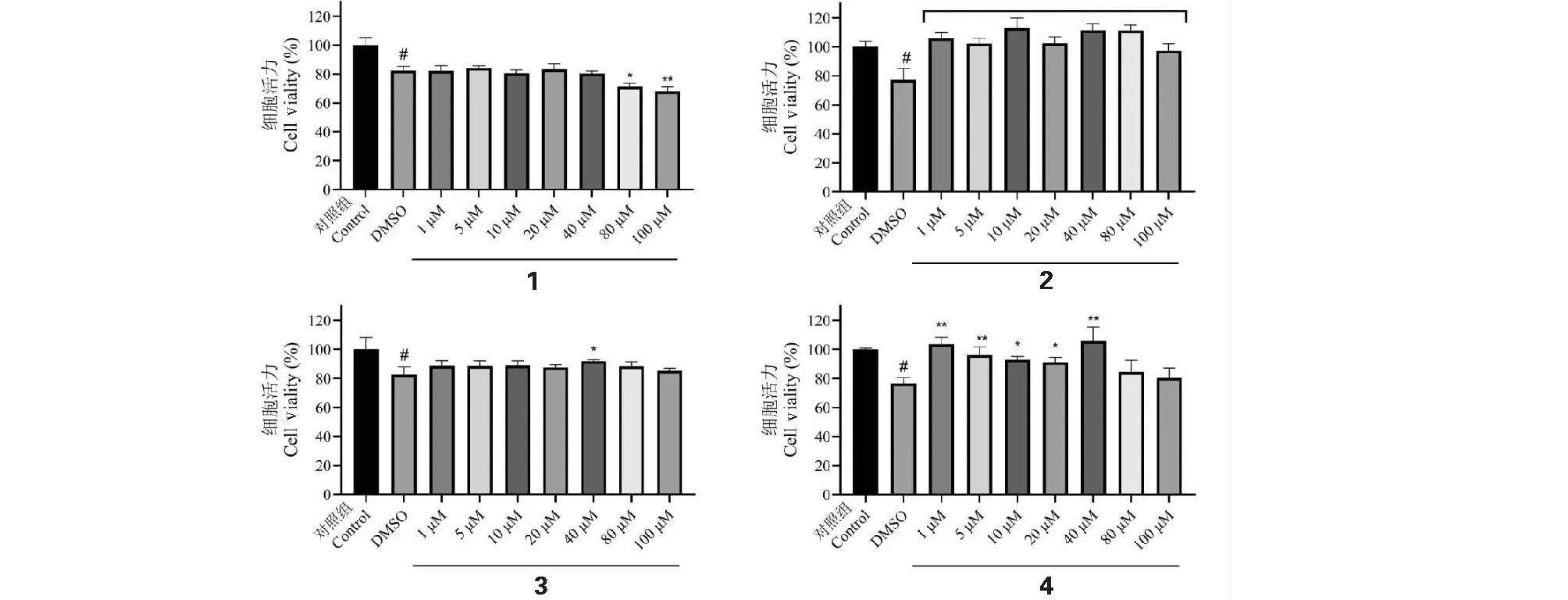
图5 黑果枸杞花青素化合物对SH-SY5Y的细胞毒性作用 Fig.5 The cytotoxicity of anthocyanin compounds from L.ruthenicum on SH-SY5Y 注:与对照组比较,#P<0.05;*与DMSO组比较,*P<0.05,**P<0.01。Note:Compared with control group,#P<0.05;*Compared with DMSO group,*P<0.05,**P<0.01.
2.3 黑果枸杞花青素的细胞活性
2.3.1 细胞活力的测定
利用CCK8法检测化合物1~4对SH-SY5Y的了排除DMSO对于细胞活力的负面影响,我们加设了DMSO组,并通过给药组与DMSO组为对比确定化合物对细胞活力的影响。细胞活力实验中DMSO组相比对照组,均出现了显著的下降,表明实验中所使用DMSO的含量对于细胞活力会出现一定的下降。在给药组的实验中,相比DMSO组,1在1~40 μM 的浓度范围里并未表现显著的细胞活力增长或降低,但在80~100 μM出现了明显的细胞活力下降;2在1~100 μM浓度均有极其显著的细胞活力升高的现象;3在40 μM浓度下细胞活力有着显著的提升;4在1~40 μM有着显著的细胞活力增殖效应,1、5以及40 μM浓度下极其显著。综合考虑细胞活力实验的结果,对于2和4化合物在40 μM的浓度下对SH-SY5Y细胞活力有着极其显著的增殖效果,因此出于统一浓度的考虑,后续选用40 μM作为花青素化合物作用浓度,进行后续实验。
2.3.2 LDH的测定
LDH是乳酸脱氢酶,当细胞发生氧化应激损伤时会出现LDH水平升高的现象,综合考虑细胞活力结果,选用40 μM作为化合物给药浓度,考察化合物对H2O2诱导的SH-SY5Y氧化损伤细胞模型的作用,其结果如图6所示。模型组与对照组相比,LDH含量发生了明显的升高,这表明氧化损伤造成了模型组细胞的LDH的显著增加[13],模型的建立是成功的。较模型组(0.082±0.00 U/gprot)相比,给药组中1(0.047±0.00 U/gprot)、2(0.066±0.00 U/gprot)以及3(0.073±0.00 U/gprot)均可以显著减少氧化损伤模型细胞中的乳酸脱氢酶含量,对损伤细胞具有一定的保护作用,而4对LDH水平有着显著的升高。对花青素的抗氧化活性研究表明,花青素B环上的甲氧基取代数量的增多会降低花青素的抗氧化活性,而羟基取代基的增多会提高花青素的抗氧化活性[21],4相较于3,它的甲氧基取代造成了抗氧化水平的下降,在LDH含量上未能体现阳性结果。Kähkönen[22]报道了单糖苷类的矮牵牛素抗氧化能力比矮牵牛素母核要更为优秀,因此对于矮牵牛素类化合物来说,糖基的增加能显著地提高其抗氧化能力,进而降低损伤细胞中的LDH水平。值得注意的是,根据文献报道黑果枸杞花青素的反式结构相较于顺势结构有更好的抗氧化活性[1],这和我们实验结果体现的反式结构较顺势结构有着更好的LDH活性相符合,我们推测可能与反式结构更为紧凑的空间构象有关。
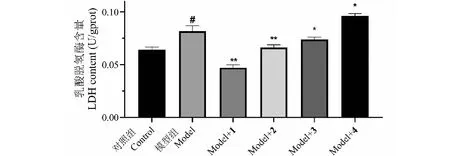
图6 花青素化合物对氧化损伤模型细胞的LDH影响 Fig.6 The effects of anthocyanin compounds on the LDH level of the oxidative injured cells注:与对照组比较,#P<0.05;*与模型组比较,*P<0.05,**P<0.01。Note:Compared with control group,#P<0.05;*Compared with model group,*P<0.05,**P<0.01.
3 结论
通过使用半制备型高效液相色谱得到了4种黑果枸杞花青素单体化合物,并对其稳定性、细胞抗氧化活性的结构相关性进行了初步评价。结果表明,反式结构在中性和弱碱性条件下有着相比顺式结构更好的稳定性,糖基的增加以及母核B环上的甲氧基取代可以增加花青素的稳定性。分子模拟结果表明,反式结构、糖基的增加和B环上的甲氧基取代均能通过缩短母核与糖链的分子距离从而达到提高稳定性。细胞活性实验的结果表明花青素化合物对细胞无毒性,且能在一定程度上改善由H2O2诱导的SH-SY5Y细胞的氧化损伤,具体表现在糖基的增加能显著地降低损伤细胞中的LDH水平,且反式结构较顺式结构更有活性优势,其中以1最明显。研究结果表明结构上的反式酰基化以及糖基数量的增加可以提高黑果枸杞花青素的pH稳定性及改善在H2O2诱导的SH-SY5Y细胞的氧化损伤的LDH水平。本研究对4种从黑果枸杞中分离得到的花青素化合物的稳定性和细胞抗氧化活性进行了初步的研究,希望可为后续黑果枸杞花青素的稳定性和活性的研发提供有益的参考。

