江西迷迭香精油的成分分析及抗氧化、抑菌活性研究
郭冬云,万 娜,3*,吴 意,林瑞华,唐 欣,曹 岚,伍振峰,2*,杨 明,2
1江西中医药大学 现代中药制剂教育部重点实验室;2江西中医药大学 创新药物与高效节能降耗制药设备国家重点实验室; 3江西中医药大学 药学院;4江西中医药大学 中药资源与民族药研究中心,南昌 330004
迷迭香(RosmarinusofficinalisL.)为唇形科迷迭香属亚灌木,原产于地中海地区,现在世界各地均有种植,含有丰富的芳香油成分[1]。迷迭香香气浓郁,常用于烹饪香料、食品工业的天然防腐剂,以及观赏和药用植物[2]。研究发现,在广泛的草药和香料中,迷迭香等具有较好的抗氧化活性[3]。
精油是植物新陈代谢过程中形成的次生产物,是一种具有高浓度芳香和挥发性的物质,存在于植物体内某些特殊器官,发挥各种生态功能[4,5]。由于精油具有多种生物活性,因而在食品工业、化妆品工业、植物疗法、医学等许多领域的应用不断增长[6]。虽然合成的抗氧化剂和防腐剂已在食品工业中等领域被广泛使用,但其长期使用会对人体健康造成一定危害。因此,近期许多研究都在寻找天然活性成分[7]。植物精油作为一种天然提取物,被提出作为合成抗氧化剂的潜在替代品。迷迭香精油是从其茎、叶、花等中经提取所得的是一种无色或淡黄色液体,具有植物特有的气味,主要含有α-蒎烯、1,8-桉叶素、莰烯、樟脑、龙脑、石竹烯等萜类成分[8]。迷迭香精油具有抗氧化、抑菌及防腐等作用,在医药、食品工业和芳香疗法等方面具有广泛的使用价值[9-11]。本研究用水蒸气蒸馏法提取江西产迷迭香叶精油,采用气相色谱-质谱联用法(GC-MS)对迷迭香精油成分进行分析,并对精油的抗氧化、抑菌活性进行研究,为综合开发利用迷迭香精油资源提供参考。
1 材料与方法
1.1 材料与仪器
迷迭香(RosmarinusofficinalisL.)新鲜叶植物材料于2020年6月采自江西迭香果农业发展有限公司,经江西中医药大学杨明教授鉴定为唇形科植物迷迭香RosmarinusofficinalisL.的新鲜叶。标本(20200615)现存于江西中医药大学现代中药制剂教育部重点实验室。
1,1-二苯基-2-苦肼基(DPPH)(上海源叶生物科技有限公司);铁粉、30%过氧化氢、硫酸亚铁、水杨酸、铁氰化钾、三氯乙酸、三氯化铁、无水乙醇、无水硫酸钠等均为分析纯;实验用水为蒸馏水(广州屈臣氏食品饮料有限公司);硫酸庆大霉素(美伦生物科技有限公司);刃天青(北京梦怡美生物科技有限公司)。
菌种:金黄色葡萄球菌(ATCC 25923)、大肠杆菌(ATCC 25922)、枯草芽孢杆菌(ATCC 6633)均购自美国典型微生物菌种保存中心(American Type Culture Collection,ATCC)。
岛津UV-2550紫外-可见光分光光度计(日本岛津公司);挥发油提取器(四川蜀牛玻璃仪器有限公司);BT25S型电子分析天平(北京赛多利斯仪器有限公司);H2050R型大容量高速台式冷冻离心机(湖南湘仪实验室开发有限公司);HH-S恒温水浴锅(江苏省金坛市医疗仪器厂);7890A/5975C型气相-色谱质谱联用仪(安捷伦科技有限公司);LDZM-80KCS立式蒸汽灭菌锅(上海申安医疗器械厂);SPX-150F型生化培养箱(上海龙跃仪器设备有限公司)。
1.2 试验方法
1.2.1 迷迭香精油的提取
采用水蒸气蒸馏法提取精油,准确称取100 g迷迭香鲜叶,置于5 000 mL圆底烧瓶中,加入2 000 mL双蒸水,振摇混合后,浸泡30 min,置于电热套中加热并保持微沸状态,加热回流提取2 h,静置分层后读取精油的体积并收集精油。100 g迷迭香样品提取得到精油的得率为1.12%。所得精油,加入无水硫酸钠干燥后置于棕色玻璃瓶中,于4 ℃冰箱密封保存备用。
1.2.2 GC-MS分析条件
采用气相色谱-质谱联用法对迷迭香精油进行定性定量分析。气相色谱条件:HP-5MS石英毛细管(30 m×320 μm×1.8 μm)色谱柱;采用程序升温:起始温度45 ℃,保持4 min,后运行70 ℃,再以4 ℃/min升温至150 ℃,保持1 min,再以6 ℃/min升温至250 ℃,于250 ℃保持4 min。载气为高纯氦气,流量1.0 mL/min;进样口温度280 ℃;分流比80∶1;溶剂延迟4 min;进样量为1.0 μL。
质谱条件:四极杆温度150 °C;电离源为标准EI源,离子源温度230 °C;电子倍增管电压2 447.06 V;质量扫描范围m/z为29~650。
采用峰面积归一化法确定组分的相对含量;通过检索NIST11化学工作站标准质谱图库,参阅有关文献,鉴定组分的化学结构。
1.3 迷迭香精油抗氧化活性的测定
1.3.1 DPPH自由基清除能力的测定
DPPH自由基清除能力的测定参考Liu等[12]的方法,并稍做修改。用无水乙醇配置1 mmol/L的DPPH溶液,避光保存。将精油样品稀释至不同浓度。取2 mL不同浓度的样品与4 mL的DPPH溶液置于试管中,充分混匀,室温暗处静置30 min后,在517 nm处测定不同浓度样品溶液的吸光度(A1),同时测定2 mL样品溶液与4 mL无水乙醇混合后的吸光度(A2),以及4 mL DPPH溶液与2 mL无水乙醇混合后的吸光度(A0)。实验平行测定3次,取平均值,DPPH自由基清除能力按公式(1)进行计算。
DPPH自由基清除能力=[1-(A1-A2)/A0]×100%
(1)
1.3.2 羟基自由基清除能力的测定
羟基自由基清除能力的测定采用水杨酸法。取1 mL不同浓度的样品,依次加入1 mL 10 mmol/L的水杨酸-乙醇溶液和1 mL 10 mmol/L的FeSO4,最后加入1 mL 8.8 mmol/L的H2O2启动反应,37 ℃下水浴30 min,用蒸馏水调零,于510 nm波长下测吸光度(A1)。以蒸馏水代替样品作为空白组测吸光度(A0);以蒸馏水代替H2O2作为对照组测吸光度(A2)。实验平行测定3次,取平均值,羟基自由基清除能力按公式(2)进行计算。
羟基自由基清除能力=[1-(A1-A2)/A0]×100%
(2)
1.3.3 还原能力的测定
还原能力的测定采用普鲁士蓝还原法。取1 mL不同浓度的样品,加pH 6.6的磷酸缓冲液2.5 mL和1%铁氰化钾溶液2.5 mL,混匀于50 ℃反应20 min,冷却至室温后加入10%三氯乙酸2.5 mL,混匀后以4 000 rpm的速度离心10 min,取上清液2.5 mL 与蒸馏水2.5 mL、0.1% 三氯化铁溶液0.5 mL混匀,静置室温下反应10 min,于700 nm波长下测定吸光度(A),实验重复3次,取平均值。
1.4 迷迭香精油抑菌试验
1.4.1 菌种的活化和菌悬液配制
将菌粉用自带的复溶培养基制备成混合液体,用接种环蘸取混合液体,在营养琼脂板上划线,37 ℃恒温培养箱培养24 h,待长出菌落,进行菌悬液制备。用接种环挑取单菌落于营养肉汤培养基中在37 ℃培养24 h,上述培养物用0.9%无菌氯化钠溶液制成1.5×108CFU/mL的菌悬液,4 ℃保存备用。
1.4.2 抑菌活性的测定
采用滤纸片法,通过测定抑菌圈直径的大小来判断迷迭香精油的抑菌效果。在超净工作台用移液枪吸取200 μL各种菌悬液,将其均匀地涂布于平板培养基表面,制成含菌平板。用无菌镊子夹取6 mm的圆形滤纸片,用移液枪吸取10 μL精油滴加到滤纸片上,滴入的一面朝下贴于平板,三片一个板,正置20 min,以无菌水作为阴性对照,庆大霉素药敏纸片(10 μg/片)作为阳性对照。将所有平板倒置于37 ℃的恒温培养箱内培养24 h。采用十字交叉法测定抑菌圈的直径,实验平行3次取平均值。
1.4.3 最低抑菌浓度(MIC)的测定
采用微量稀释法与刃天青显色法[13]测定迷迭香精油的最低抑菌浓度(MIC)。在96孔无菌平板中,用2%吐温-80的液体培养基将精油进行连续双倍稀释后,加入100 μL菌悬液混匀,最后加入20 μL 0.01%的刃天青溶液,置于37 ℃培养箱培养24 h,观察显色结果,颜色从蓝色变为粉色即预示细菌生长。以保持蓝色的最低浓度为MIC。第一行每孔加含2%吐温-80的无菌营养肉汤200 μL作为培养基对照;第二行每孔加2%吐温-80的无菌营养肉汤100 μL和菌悬液100 μL作为含菌阴性对照,每孔中菌数为5×104个;样品行中每孔加入含2%吐温-80的无菌营养肉汤100 μL,分别往第三行到第五行的1号孔加入100 μL的精油肉汤溶液(320 μL/mL),第六行的1号孔加入100 μL的硫酸庆大霉素母液(1 mg/mL),依次对第三行到第六行的1~12孔进行梯度稀释后,在每孔中加入100 μL的菌悬液,在1~12孔的精油样品最终浓度为160、80.0、40.0、20.0、10.0、5.00、2.50、1.25、0.625、0.312、0.156、0.078 0 μL/mL。
2 结果与分析
2.1 迷迭香精油的化学成分分析
按上述GC-MS条件对迷迭香精油的化学成分进行分析,得到迷迭香精油的总离子流色谱图(见图1)。
图1 迷迭香精油的总离子流图Fig.1 Total ion chromatogram of the essential oil from R.officinalis
经GC-MS计算机数据处理系统进行自动检索,通过与标准质谱图经NIST11质谱库检索及人工辅助分析,鉴定确认了40种化学成分,用面积归一化法计算出其相对含量。由表1可见,已鉴定成分的相对含量占精油总量的99.46%。其中含量较高的为α-蒎烯(39.05%)和1,8-桉叶素(16.86%),其次是莰烯(4.22%)、D-柠檬烯(3.87%)、龙脑(3.74%)、β-石竹烯(3.11%)、香叶醇(2.92%)、β-蒎烯(2.23%)、樟脑(2.16%)、乙酸龙脑酯(2.01%)、芳樟醇(1.81%)、γ-松油烯(1.74%)等,为迷迭香精油的主要成分,相对含量高于1%的成分占91.41%。根据ISO国际标准分类[14],迷迭香精油可分为突尼斯/摩洛哥型(Tunisian and Moroccan type)和西班牙型(Spanish type)两大类,其中α-蒎烯的含量超过国际标准规定的最高含量,β-蒎烯、1,8-桉叶素、D-柠檬烯、龙脑的含量均符合西班牙型标准,樟脑含量低于标准规定的最低含量,因此从GC-MS分析结果,江西迷迭香精油属于西班牙型。
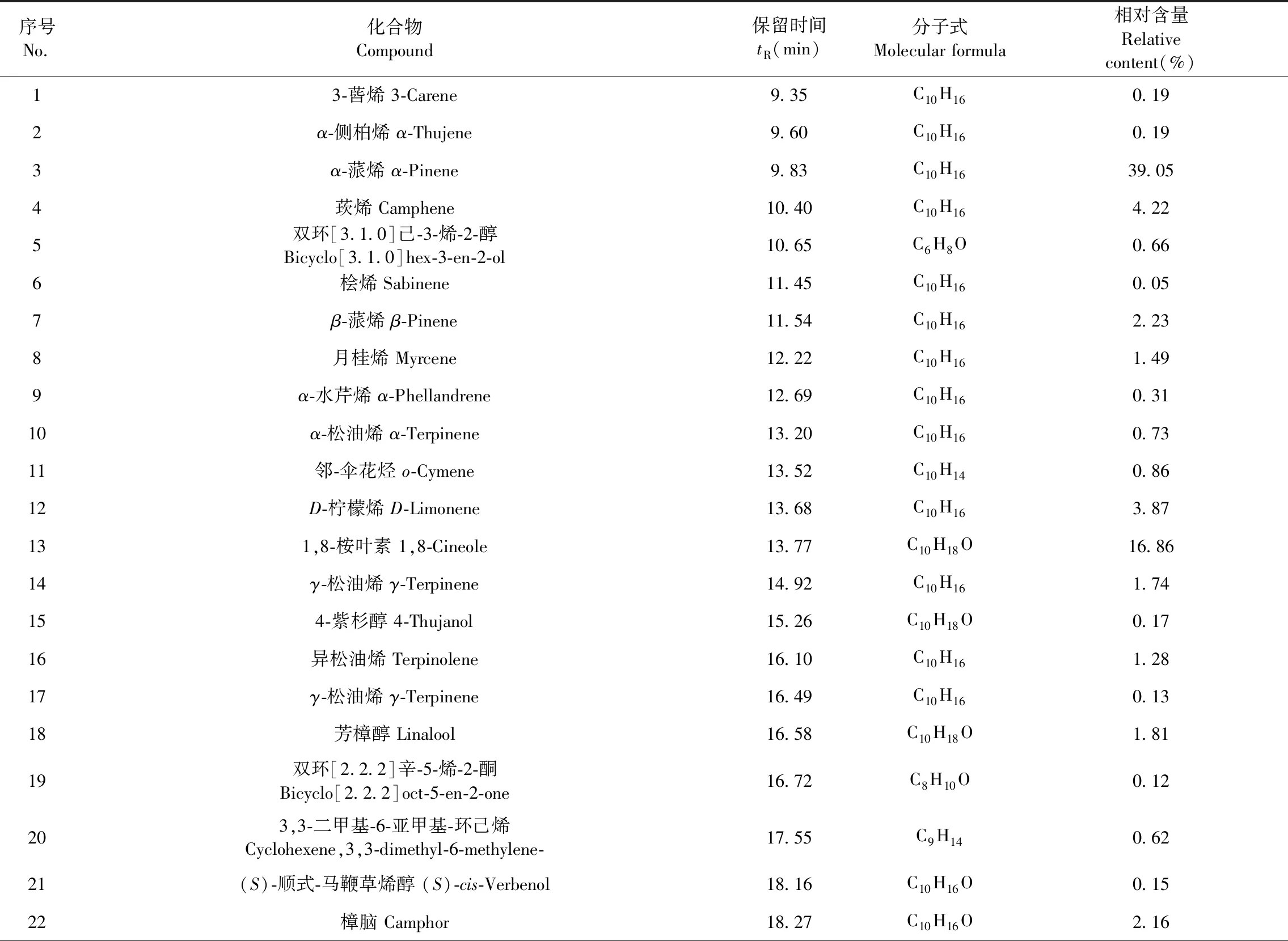
表1 迷迭香精油化学成分Table 1 The chemical composition of the essential oil from R.officinalis
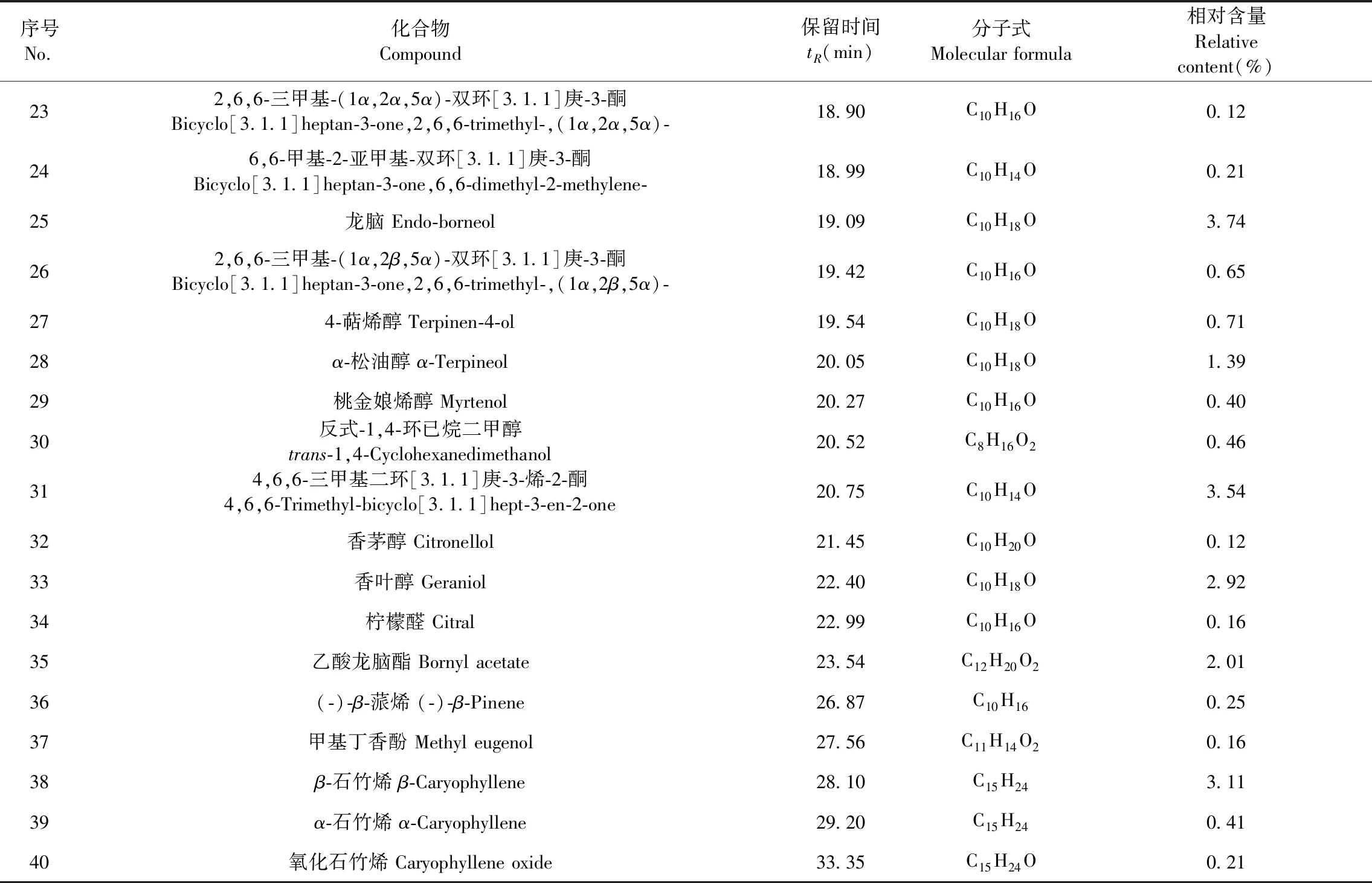
续表1(Continued Tab.1)
将江西迷迭香与国内其他产地迷迭香精油的化学成分进行比较[15-18],结果见表2。

表2 不同产地迷迭香精油主要成分相对含量的比较Table 2 Comparision of chemical composition of the essential oil from different regions of R.officinalis
从表2可以看出,不同产地的迷迭香精油的相对含量存在较大差异,江西、河南、贵州、山东、广西产地的迷迭香精油中均有α-蒎烯、莰烯、β-蒎烯、1,8-桉叶素、芳樟醇和樟脑等物质。其中江西产迷迭香精油中的α-蒎烯和芳樟醇的相对含量高于国内其他产地,1,8-桉叶素、β-蒎烯、乙酸龙脑酯和β-石竹烯的相对含量较高;河南产迷迭香精油中莰烯的相对含量最高,贵州产迷迭香精油中β-石竹烯含量最高,山东产迷迭香精油中1,8-桉叶素、樟脑、龙脑含量最高,广西产迷迭香精油中β-蒎烯、乙酸龙脑酯含量最高。Verma等[19]采用GC-FID和GC-MS技术分析印度北部亚热带地区不同生长阶段的迷迭香精油,发现不同生长阶段其主要成分相同,均为樟脑(23.9%~33.2%)、桉叶油素(20.4%~23.9%)、α-蒎烯(8.5%~14.4%),但其相对含量存在明显差异。研究表明,精油成分受植物生长地、土壤、提取方法、植物品种等诸多因素的影响[20]。
2.2 迷迭香精油抗氧化活性的测定结果
2.2.1 DPPH自由基清除能力的测定
DPPH自由基有个单电子,其乙醇溶液呈深紫色,在517 nm处有强吸收。抗氧化剂的存在可以使得DPPH溶液的颜色从深紫色变为淡黄色,从而具有清除DPPH自由基的能力[21];褪色越明显表明抗氧化能力越强。
如图2所示,不同浓度的迷迭香精油对DPPH自由基清除能力呈现明显的量效应关系,随着样品浓度的增大,对DPPH自由基的清除效果增强;迷迭香精油对DPPH自由基的IC50值为76.42 μL/mL,表明迷迭香精油对DPPH自由基有较好的清除活性。

图2 迷迭香精油的DPPH自由基清除能力Fig.2 DPPH radical scavenging rate of the essential oil from R.officinalis
2.2.2 羟基自由基清除能力的测定
Fe2+和H2O2混合后反应产生高活性的羟基自由基,然后由体系中的水杨酸-乙醇捕捉羟基自由基产生有色物质且在510 nm处有吸收。如果在反应体系中加入有清除羟自由基能力的物质,与水杨酸竞争羟自由基,会使有色物质生成量减少并降低吸光值。
如图3,不同浓度的迷迭香精油对羟基自由基清除能力呈现较好的量效应关系,随着样品浓度的增大,对羟基自由基的清除效果增强;迷迭香精油对羟基自由基的IC50值为51.40 μL/mL,表明对羟基自由基有较好的清除效果。
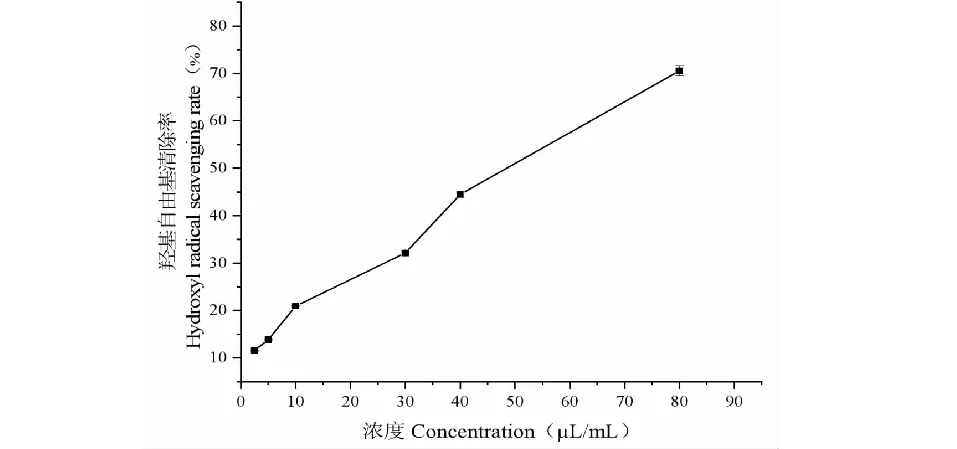
图3 迷迭香精油的羟基自由基清除能力Fig.3 Hydroxyl radical scavenging rate of the essential oil from R.officinalis
2.2.3 还原能力的测定
多数情况下,多数非酶类抗氧化剂的活性都是通过还原反应终止氧化链式反应的,化合物的还原能力是显示其是否具有抗氧化潜能的一个至关重要的因素。吸光值越大,物质的还原力越强,其抗氧化活性也越高。
如图4,还原力与质量浓度具有一定的量效关系,随着样品浓度的增大,还原力增强;迷迭香精油具有较强的还原力,IC50值为49.15 μL/mL。
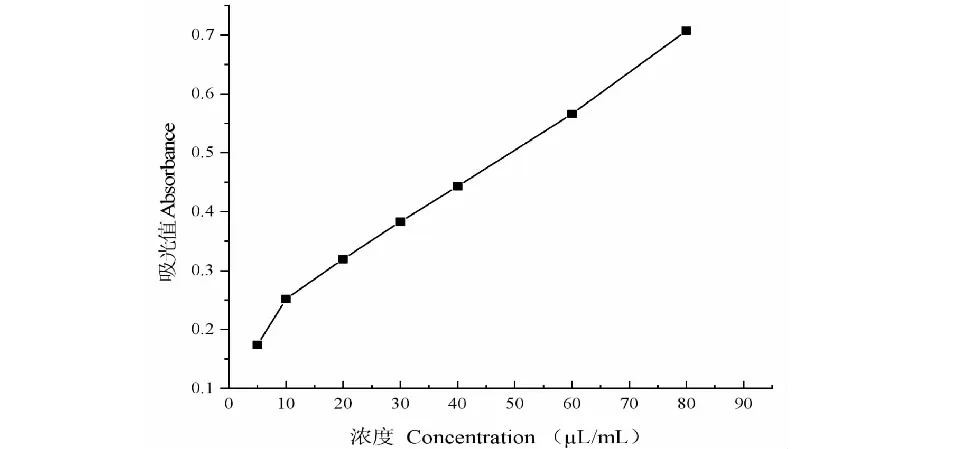
图4 迷迭香精油的还原力Fig.4 The reducing power of the essential oil from R.officinalis
2.3 迷迭香精油抑菌试验结果
2.3.1 抑菌活性的测定
采用滤纸片法测定了迷迭香精油的抑菌圈直径,结果如表3所示,迷迭香精油对枯草芽孢杆菌、金黄色葡萄球菌和大肠杆菌均具有良好的抑制作用,其中对枯草芽孢杆菌的抑菌圈直径为14.40±0.66 mm,抑制作用最强,对大肠杆菌的抑菌圈直径为11.70±0.27 mm,对金黄色葡萄球菌的抑菌圈直径为11.41±0.19 mm,抑菌作用稍弱。

表3 迷迭香精油抑菌圈直径Table 3 The antimicrobial diameter of the essential oil from
2.3.2 最低抑菌浓度(MIC)的测定
采用微量稀释法与刃天青显色法测定了迷迭香挥发油的MIC,MIC值是测定抗菌物质抗菌活性大小的一个指标。结果如表4所示,迷迭香精油对枯草芽孢杆菌、金黄色葡萄球菌、大肠杆菌的最低抑菌浓度(MIC)分别为2.50、10.00、10.00 μL/mL。从实验结果可知,迷迭香精油对枯草芽孢杆菌的抑制效果最强,明显优于金黄色葡萄球菌和大肠杆菌的抑菌效果。这一点与抑菌圈直径的实验结果一致。

表4 迷迭香精油的最低抑菌浓度Table 4 MIC of the essential oil from R.officinalis
3 讨论与结论
采用水蒸气蒸馏法结合气相色谱-质谱连用法(GC-MS)鉴定了迷迭香精油的化学成分,迷迭香精油中含量较高的成分为α-蒎烯(39.05%)和1,8-桉叶素(16.86%),其次是莰烯(4.22%)、D-柠檬烯(3.87%)、龙脑(3.74%)、β-石竹烯(3.11%)、香叶醇(2.92%)、β-蒎烯(2.23%)、樟脑(2.16%)等,根据ISO国际标准,江西迷迭香精油属于西班牙型。迷迭香是西餐中经常使用的香料,其特征是具有龙脑、龙脑酯、樟脑等成分的混合香气[22],同时具有清甜带松木香的气味和风味,香味浓郁[23]。推测这可能与迷迭香中的4种主要成分α-蒎烯、1,8-桉叶素、龙脑、樟脑有关,这4种成分的相对含量占总成分含量的61.80%。其中樟脑具有浓郁的辛香,1,8-桉叶素与莰烯具有类似樟脑香气,龙脑味辛苦,微寒;有樟脑和松木香气,α-蒎烯有松木、针叶及树脂样的气息,因此迷迭香呈现出浓郁的松木香气味。


