生姜中6个姜辣素类成分的抗菌活性研究
黎晓菊,庹呈杰,黄之镨,张晓梅,赵 庆
云南中医药大学中药学院,昆明 650500
抗生素的过度使用导致了越来越严重的病原微生物耐药性问题。细菌的耐药性一旦产生,不但可通过基因传递给子代,而且还可以通过细菌结合的方式将耐药性传递给其他细菌[1]。有专家担忧,耐药性可能成为全球性灾难,且没有缓解的迹象[2]。开发新型的抗菌药物是全世界所共同面临的紧迫任务,从植物药中寻找抗菌成分是抗菌药物研发的一个重要方向。姜科植物是抗菌成分的重要来源之一,近十余年来,已从姜科植物中发现多个具有优良抗菌活性的化学成分[3-6]。
生姜(ZingiberofficinaleRoscoe)是传统的食药同源植物,为姜科姜属植物[7]。生姜具有抗炎、抗菌、抗肿瘤、抗氧化、促进消化、改善血液循环、健胃止痛等药理作用[8-10]。姜辣素类是生姜中辣味成分,也是生姜中主要活性成分。姜辣素类成分因具有抗肿瘤[11-14]、抗菌[15-18]等生物活性而受到关注。[6]-姜酚和[6]-姜烯酚对外排型MRSA菌株SA1199B(NorA)、XU212(TetK)和RN4220(MSRA)具有良好的广谱抗菌活性,并且对R-质粒结合转移具有较强抑制作用[15]。Lee等[18]研究发现[6]-姜酚、[8]-姜酚和[6]-姜烯酚能抑制白色念珠菌生物膜的形成,但与他们结构相似的[10]-姜酚、[8]-姜烯酚和[10]-姜烯酚在浓度为100 μg/mL时未显示抑制活性。虽然有学者推测姜辣素类成分的链长缩短可能导致抗菌活性降低[15],但从Lee[18]的研究结果来看,姜酚与姜烯酚的碳链延长似乎导致抗白色念珠菌的活性降低。
本课题组发现生姜提取物对二十余种病原菌具有明显的抗菌活性,且提取物经光化学反应后抗菌活性明显增强[19]。本课题组在研究生姜抗菌活性成分的过程中分离得到了6个姜辣素类成分,为了进一步探究该类成分的抗菌活性与脂肪链长度的关系,我们开展了这6个姜辣素类成分对15个病原菌株的抗菌活性研究,以期寻找其中的规律。
1 材料与方法
1.1 药材与菌种
市售的云南罗平生姜经云南中医药大学马伟光教授鉴定。标本(标本编号:ZO-LP-202103)保存于云南中医药大学实用中药学重点学科中药水提工艺实验室。生姜洗净、切成薄片,晾干,粉碎后备用。
革兰氏阳性菌:金黄色葡萄球菌(StaphylococcusaureusATCC 29213)、枯草芽孢杆菌(BacillussubtilisATCC 6633)、肺炎链球菌(StreptococcuspneumoniaeATCC 49619)、粪肠球菌(EnterococcusfaecalisATCC 29212),耐甲氧西林金黄色葡萄球菌(MRSA):1505、2024、1957、1591、28299、I-20。革兰氏阴性菌:流感嗜血杆菌(HaemophilusinfluenzaeATCC 49247)、大肠杆菌(EscherichiacoliATCC 25922)、鲍曼不动杆菌(AcinetobacterbaumanniiATCC 19606)、克雷伯氏菌(KlebsiellapneumoniaeATCC 13883)、铜绿假单胞菌(PseudomonasAeruginosaPAO1)。以上供试菌株均由课题组前期研究保存。
培养基:病原细菌培养基LB:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,琼脂15 g,水定容至1 L,pH7.2~7.6。
1.2 仪器与试剂
仪器:打粉机、研钵、超声波清洗器(上海科导超声仪器有限公司);Precisa电子天平;OSB-2100旋转蒸发仪(上海爱朗仪器有限公司);ES-315高压蒸汽灭菌锅(TOMY公司);恒温培养箱、电热恒温鼓风干燥箱(上海一恒科学仪器有限公司);SW-CJ-2FD洁净工作台(AIRTECH公司);培养基配料等常用试剂、耗材均购自雅云生物科技有限公司。核磁共振氢谱、碳谱由Bruker AM-500超导核磁共振仪测定。柱色谱硅胶(300~400目,青岛海洋化工厂)。薄层色谱硅胶G板(青岛海洋化工厂),薄层显色的常规方法为:5%硫酸-乙醇溶液在150 ℃下烘烤至显色明显。
有机溶剂:丙酮、乙酸乙酯、石油醚等均为分析纯。
1.3 提取、分离及鉴定
取粉碎的生姜1.0 kg,按料液比1∶3加入甲醇∶丙酮(1∶1,V/V)浸泡7日,超声2 h,过滤。残渣再用甲醇∶丙酮(1∶1,V/V)超声提取2次。合并提取液,浓缩得浸膏90 g。
取15 g浸膏以500 mL氯仿溶解,用600 mL 2.5%氢氧化钠水溶液萃取。水层用氯仿萃取两次(每次250 mL)。水层滴加10%盐酸至中性,用700 mL乙酸乙酯萃取;水层再用200 mL乙酸乙酯萃取。合并乙酸乙酯萃取液,水洗至中性,减压浓缩得酸性浸膏1.183 g。上述酸性浸膏以硅胶柱色谱分离,石油醚-乙酸乙酯(10∶1、5∶1、2∶1、1∶2,V/V)梯度洗脱,得到8个馏分(Fr.1~8)。Fr.1经ODS柱色谱分离,甲醇-水(25%→85%)梯度洗脱,得到化合物1(44.1 mg)、2(45.5 mg)、3(21.7 mg)。
取75 g浸膏以硅胶柱分离,石油醚-乙酸乙酯(1∶0、20∶1、10∶1、5∶1、2∶1、0∶1,V/V)梯度洗脱,得到9个馏分(Fr.1~9)。Fr.7经硅胶柱色谱分离,石油醚-乙酸乙酯(3∶1、2∶1、1∶1,V/V)梯度洗脱,再经ODS柱色谱分离,甲醇-水(25%→90%)梯度洗脱,得到化合物4(549.6 mg)、5(72.6 mg)、6(110.0 mg)。
采用1H NMR、13C NMR、DEPT及ESI(+)-MS波谱法,并参照文献数据,对上述6个化合物进行鉴定。
1.4 生姜化合物抗菌活性测定
精密称定化合物1(9.000 0 mg),以相等的摩尔数精密称定化合物2(9.862 4 mg)、3(10.725 4 mg)、4(9.061 1 mg)、5(9.924 0 mg)、6(10.787 0 mg)。分别加入600 μL甲醇溶解至摩尔浓度为0.051 3 mol/L。
病原菌接种至LB液体培养基,37 ℃,200 rpm黑暗培养12 h。用液体培养基将各菌液分别稀释至1×106~1×107CFU/mL备用。采用抗菌纸片扩散法,对6个化合物进行抗菌活性测试。
将稀释后的指示菌菌液均匀涂布在固体培养基上,分别取溶解完全的6个化合物10 μL溶液于直径6 mm的圆形滤纸片上,直至滤纸片将提取液完全吸收后贴于接种好指示菌的固体培养基上,每个化合物做3组平行实验。以10 μL甲醇做空白对照,以抗生素做阳性对照(金黄色葡萄球菌、枯草芽孢杆菌、肺炎链球菌、粪肠球菌以苄基青霉素为阳性对照,MRSA以万古霉素为阳性对照,革兰氏阴性菌以卡那霉素为阳性对照,每个滤纸片上的抗生素质量为50 μg)。病原细菌于37 ℃培养,恒温培养12 h后测量抑菌圈直径。
2 结果与分析
2.1 化合物的鉴定
化合物1无色油状;分子式C17H24O4;ESI-MS:m/z315 [M+Na]+;1H NMR(500 MHz,CDCl3)δ:6.82(1H,m,H-5′),6.68(2H,m,H-2′,6′),5.51(1H,s,H-4),3.86(3H,m,OCH3),2.84(2H,m,H-1),2.56(2H,t,J=8.1 Hz,H-2),2.25(2H,t,J=7.8 Hz,H-6),1.57(2H,m,H-7),1.29(4H,m,H-8,9),0.88(3H,m,H-10);13C NMR(125 MHz,CDCl3)δ:194.4(C-5),193.5(C-3),146.4(C-3′),143.9(C-4),132.7(C-1′),120.8(C-6′),114.3(C-5′),111.0(C-2′),99.5(C-4),55.9(OCH3),40.6(C-2),38.3(C-6),31.4(C-8),31.4(C-1),25.5(C-7),22.4(C-9),14.0(C-10)。上述数据与文献[20]报道已知化合物一致,鉴定为5-hydroxy-1-(4-hydroxy-3-methoxyphenyl)-4-decen-3-one(结构见图1)。
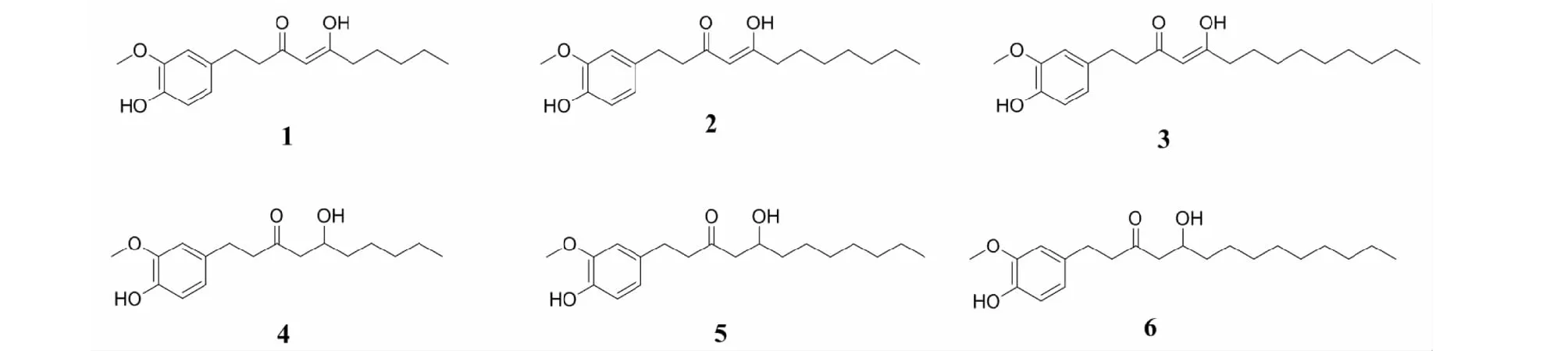
图1 化合物1~6的化学结构Fig.1 The chemical structures of compounds 1-6
化合物2无色油状;分子式C19H28O4;ESI-MS:m/z343 [M+Na]+;1H NMR(500 MHz,CDCl3)δ:6.82(1H,dd,J=8.1,4.9 Hz,H-5′),6.68(2H,m,H-2′,6′),5.50(1H,s,H-4),3.86(3H,m,OCH3),2.84(2H,m,H-1),2.56(2H,t,J=8.3 Hz,H-2),2.25(2H,t,J=7.6 Hz,H-6),1.57(2H,m,H-7),1.28(8H,m,H-8,9,10,11),0.87(3H,m,H-12);13C NMR(125 MHz,CDCl3)δ:194.4(C-5),193.6(C-3),146.4(C-3′),143.9(C-4′),132.7(C-1′),120.8(C-6′),114.3(C-5′),111.0(C-2′),99.5(C-4),55.9(OCH3),40.6(C-2),38.3(C-6),31.7(C-10),31.6(C-1),29.2(C-9),29.0(C-8),25.8(C-7),22.7(C-11),14.0(C-12)。上述数据与文献[20]报道已知化合物一致,鉴定为5-hydroxy-1-(4-hydroxy-3-methoxyphenyl)-4-dodecen-3-one。
化合物3白色固体;分子式C21H32O4;ESI-MS:m/z371 [M+Na];+1H NMR(500 MHz,CDCl3)δ:6.82(1H,dd,J=8.1,5.1 Hz,H-5′),6.68(2H,m,H-2′,6′),5.40(1H,d,J=14.2 Hz,H-4),3.87(3H,d,J=5.2 Hz,OCH3),2.84(2H,m,H-1),2.56(2H,t,J=8.4 Hz,H-2),2.25(2H,t,J=7.5 Hz,H-6),1.57(2H,s,H-7),1.26(12H,m,H-8,9,10,11,12,13),0.87(3H,t,J=7.0 Hz,H-12);13C NMR(125 MHz,CDCl3)δ:194.4(C-5),193.6(C-3),146.4(C-3′),143.9(C-4′),132.7(C-1′),120.8(C-6′),114.3(C-5′),110.9(C-2′),99.5(C-4),55.9(OCH3),40.6(C-2),38.3(C-6),31.9(C-12),31.4(C-1),29.5(C-11),29.4(C-10),29.3(C-9),29.2(C-8),25.8(C-7),22.7(C-13),14.2(C-14)。上述数据与文献[20]报道已知化合物一致,鉴定为5-hydroxy-1-(4-hydroxy-3-methoxyphenyl)-4-tetradecane-3-one。
化合物4白色固体;分子式C17H26O4;ESI-MS:m/z317 [M+Na]+;1H NMR(500 MHz,(CD3)2CO)δ:6.81(1H,d,J=1.9 Hz,H-5′),6.70(1H,d,J=8.0 Hz,H-2′,6′),6.63(1H,dd,J=2.0,8.0 Hz,H-6′),3.99(1H,m,H-5),3.86(3H,s,OCH3),2.75(4H,m,H-1,2),2.51(2H,m,H-4),1.22-1.40(8H,m,H-6,7,8,9),0.87(3H,m,H-10);13C NMR(125 MHz,(CD3)2CO)δ:210.0(C-3),148.1(C-3′),145.6(C-4′),133.6(C-1′),121.4(C-6′),115.6(C-5′),112.6(C-2′),68.3(C-5),56.1(OCH3),50.9(C-4),45.9(C-2),38.1(C-6),32.5(C-1),25.9(C-8),23.3(C-9),14.3(C-10)。上述数据与文献[21]报道的已知化合物一致,鉴定为[6]-姜酚。
化合物5无色油状;分子式C19H30O4;ESI-MS:m/z345 [M+Na]+;1H NMR(500 MHz,CDCl3)δ:6.82(1H,d,J=8.0 Hz,H-5′),6.66(2H,m,H-2′,6′),4.02(1H,br s,H-5),3.86(3H,s,OCH3),2.83(2H,m,H-1),2.73(2H,m,H-2,)2.48~2.55(2H,m,H-4),1.33(12H,m,H-6,7,8,9,10,11),0.87(3H,m,H-12);13C NMR(125 MHz,CDCl3)δ:211.6(C-3),146.4(C-3′),143.9(C-4′),132.7(C-1′),120.7(C-6′),114.4(C-5′),110.9(C-2′),67.7(C-5),55.9(OCH3),49.4(C-4),45.5(C-2),36.4(C-6),31.8(C-1),29.6(C-7),29.3(C-8),29.3(C-9),25.5(C-10),22.7(C-11),14.1(C-12)。上述数据与文献[21]报道的已知化合物一致,鉴定为[8]-姜酚。
化合物6白色固体;分子式C21H34O4;ESI-MS:m/z373 [M+Na]+;1H NMR(500 MHz,CDCl3)δ:6.82(1H,d,J=8.0 Hz,H-5′),6.66(2H,m,H-2′,6′),4.02(1H,br s,H-5),3.83(3H,s,OCH3),2.83(2H,t,J=7.4 Hz,H-1),2.73(2H,t,J=7.7 Hz,H-2,)2.48~2.55(2H,m,H-4),1.33(16H,m,H-6,7,8,9,10,11,12,13),0.87(3H,t,J=6.9 Hz,H-14);13C NMR(125 MHz,CDCl3)δ:211.6(C-3),146.4(C-3′),143.9(C-4′),132.7(C-1′),120.7(C-6′),114.4(C-5′),110.9(C-2′),67.6(C-5),55.9(OCH3),49.3(C-4),45.5(C-2),36.4(C-6),31.9(C-1),29.6(C-7),29.6(C-8),29.6(C-9),29.3(C-10),29.3(C-11),25.5(C-12),22.7(C-13),14.1(C-14)。上述数据与文献[21]报道的已知化合物一致,鉴定为[10]-姜酚。
2.2 生姜化学成分的抗菌活性测定
采用纸片扩散法[22],对化合物1~6进抗菌活性测试,共采用了15株病原菌,结果见表1。测试结果表明:与姜酚型化合物4、5、6相比,烯醇型化合物1、2、3对更多的革兰氏阳性菌具有抑制活性。姜酚型化合物4和5对四种革兰氏阴性菌具有抗菌活性,仅对铜绿假单胞菌无抗菌活性。烯醇型化合物只有化合物1对五种革兰氏阴性菌都具有抗菌活性。就烯醇型化合物而言,化合物1对绝大多数菌株的抗菌活性大于化合物2和3。就姜酚型化合物而言,化合物4的抗菌活性大于化合物5,而化合物6对所有15种菌株均无抗菌活性。上述6个化合物的脂肪链长顺序为:1<2<3;4<5<6。由此初步推测:脂肪链的长度增加,将导致抗菌活性降低。

表1 化合物1~6的抑菌圈直径Table 1 Diameter of inhibition zone of compound 1-6

续表1(Continued Tab.1)
3 讨论与结论
我们从生姜中分离鉴定了6个姜辣素类成分,并对这6个化合物进行抗菌活性测试,在此基础上对构效关系进行初步探讨。总的来说,与姜酚型化合物4、5、6相比,烯醇型化合物1、2、3对更多的革兰氏阳性菌具有抑制活性;姜酚型化合物4和5对革兰氏阴性菌的抗菌活性优于烯醇型化合物。根据我们的抗菌测试数据,并结合Lee等[18]的研究结果来看,姜辣素类成分脂肪链的长度增加,可能导致抗菌活性降低。我们和Lee等[18]的抗菌活性测试都只是针对脂肪链长为5、7、9个碳原子的姜辣素类成分;至于碳原子数少于5个或多于9个的脂肪链,上述规律是否还适用,尚需要进一步探讨。
姜辣素类成分是生姜中的一类重要的抗菌成分,从此类成分中挖掘有苗头的抗菌活性成分或先导化合物是值得进一步探索的。本项研究可以为具有抗菌活性的姜辣素类成分研究与开发及其抗菌机制研究打下基础。

