腔隙性脑梗死脑白质病变与脑微出血的相关性研究
李万春, 孟晏莉, 单志愿
脑小血管疾病病理进程包括脑白质病变(white matter lesion,WML)和脑微出血(cerebral microbleeds,CMBs)两个方面,目前研究普遍认为WML和CMBs均可引发腔隙性脑梗死(lacunar infarction,LI),二者在缺血性卒中患者中的发病率分别为25%和27%[1]。基础研究表明,WML和CMBs的发生与血脑屏障损伤密切相关,严重WML和CMBs是造成LI的重要原因,WML和CMBs的出现可导致病情迅速进展,引起认知功能障碍,并最终导致患者死亡等不良预后[2]。但对于WML和CMBs在LI患者发病中的相互关系却少有研究,鉴于此,本研究通过对LI患者临床资料进行回顾性分析,分析不同CMBs严重程度患者的临床特点,并探讨LI患者WML与CMBs合并发病的相关因素,旨在为临床早期判断和防治提供理论依据,现将结果报道如下。
1 材料和方法
1.1 一般资料 选取2017年1月-2019年5月期间在本院就诊的129例LI患者作为研究对象,129例患者中男性68例,女性61例,年龄30~94岁,平均年龄(57.34±13.07)岁。患者均接受头部MRI和颈动脉超声检查,结果符合《中国急性缺血性脑卒中预防和治疗指南》[3]中有关LI的诊断标准。排除急性期脑梗死、脑出血、脑肿瘤者或合并有脑外伤、精神疾病以及其他原因所致的非血管性脑白质病变者;排除合并有器官功能衰竭、中毒、感染、恶性肿瘤、代谢综合征等严重内科疾病者。
1.2 方 法
1.2.1 资料收集 收集129例患者基本资料和实验室指标水平,基本资料包括年龄、性别、体重指数、烟酒饮酒史及合并基础疾病。实验室指标包括高密度脂蛋白(high-density lipoprotein,HDL-C)、低密度脂蛋白(low-density lipoprotein,LDL-C)、高敏C反应蛋白(high sensitivity C-reactive protein,hs-CRP)及同型半胱氨酸(homocysteine,Hcy)。
1.2.2 WML病情评估 患者均接受MRI检查,根据MRI检查结果,根据脑白质病变评分量表(white matter lesion scale,WMLs),即Fazekas分级标准对患者病情程度进行评估。该量表评估包括脑室周围病变和深部白质病变两个方面,其中脑室周围病变评分标准:无高信号病灶为0分;帽状或铅笔状薄性病变为1分;病变部位显示光滑晕圈为2分(见图1);病变周围强度不规整,并向白质深部延伸为3分。深部白质病变评分标准:无高强度信号为0分;斑点样病变为1分;病灶有融合表现为2分;病灶呈大面积融合为3分。将两部分评分相加即为WML病情评分。
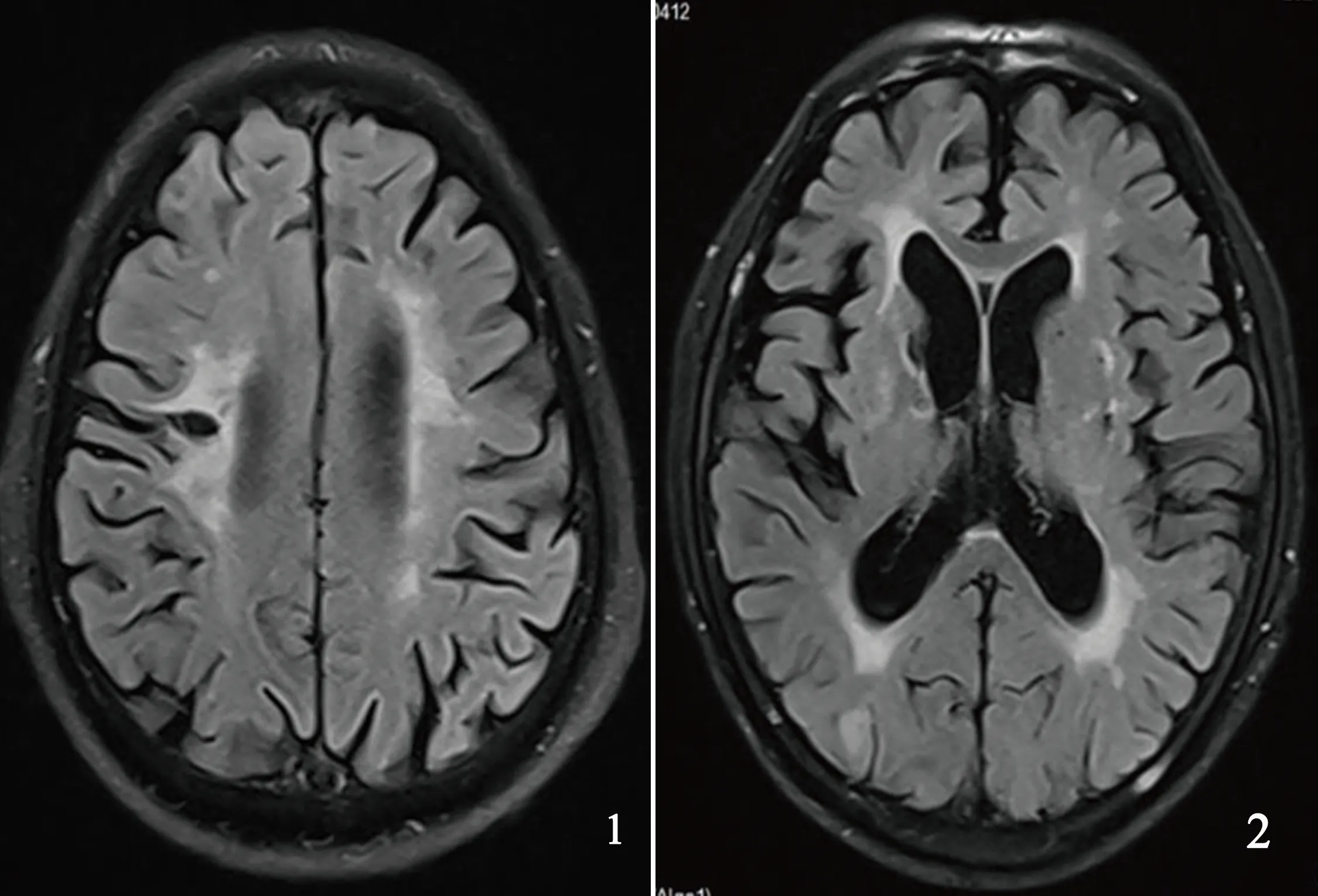
图1 颅内多发点状、片状脱髓鞘,部分融合;图2 颅内白质多发点片状脱髓鞘并多发微出血灶
1.2.3 CMBs病情评估 根据MRI检查结果对CMBs严重程度进行分级,病灶判断依据MRI梯度回波T2*成像上直径2~10 mm类圆形或圆形信号缺失区或减低区。无CMBs病灶为0级;1~5个病灶为1级;6~10个病灶为2级(见图2);>10个病灶为3级,根据CMBs分级将患者分为无出血组(0级,n=20)、轻度组(1级,n=60)、中度组(2级,n=37)及重度组(3级,n=12)。
1.2.4 颈动脉硬化评估 采用彩色多普勒超声系统测定颈动脉内膜中层厚度(carotid intima media thickness,CIMT),以颈总动脉、颈动脉分叉处、颈内动脉和颈外动脉3次测量结果平均值为CIMT标准值,根据同侧颈动脉血管内单个动脉粥样硬化斑块的最大厚度之和进行颈动脉斑块积分评定,<1.2 mm为0分;1.2~2.0 mm为1分;2.1~4.0 mm为2分;单个斑块CIMT>4 mm则为3分。
2 结 果
2.1 不同病情程度患者基本资料比较 不同CMBs病情程度患者年龄和高血压合并症发生情况比较,差异有统计学意义(P<0.05)(见表1)。

表1 不同病情程度患者基本资料比较
2.2 不同病情程度患者实验室指标比较 不同CMBs病情程度患者血清HDL-C、LDL-C、hs-CRP、Hcy、CIMT及颈动脉斑块积分水平比较,差异均有统计学意义(P<0.05)(见表2)。
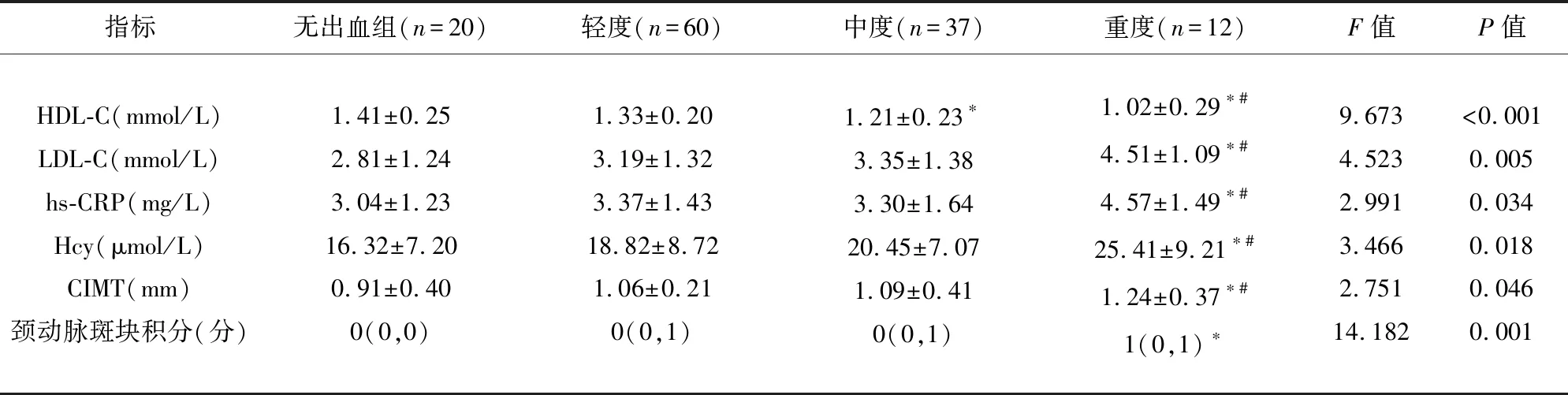
表2 不同病情程度患者实验室指标比较
2.3 不同CMBs分级与WMLs评分相关性分析 LI合并WML无CMBs患者与伴有CMBs患者WMLs评分比较,差异具有统计学意义(P<0.05);不同CMBs分级患者WMLs评分差异亦有统计学意义(P<0.05)(见表3)。

表3 不同病情程度患者WMLs评分[M(Q1,Q3)]
2.4 LI患者WML与CMBs合并发病的危险因素分析 129例患者中,无WML和CMBs患者12例,占比9.30%,合并单纯WML患者8例,合并单纯CMBs患者26例,而WML与CMBs合并发病患者83例,占比70.94%。经Logistic回归分析,年龄、高血压、HDL-C、Hcy及CIMT是影响LI患者WML与CMBs合并发病的独立危险因素(P<0.05)(见表4)。
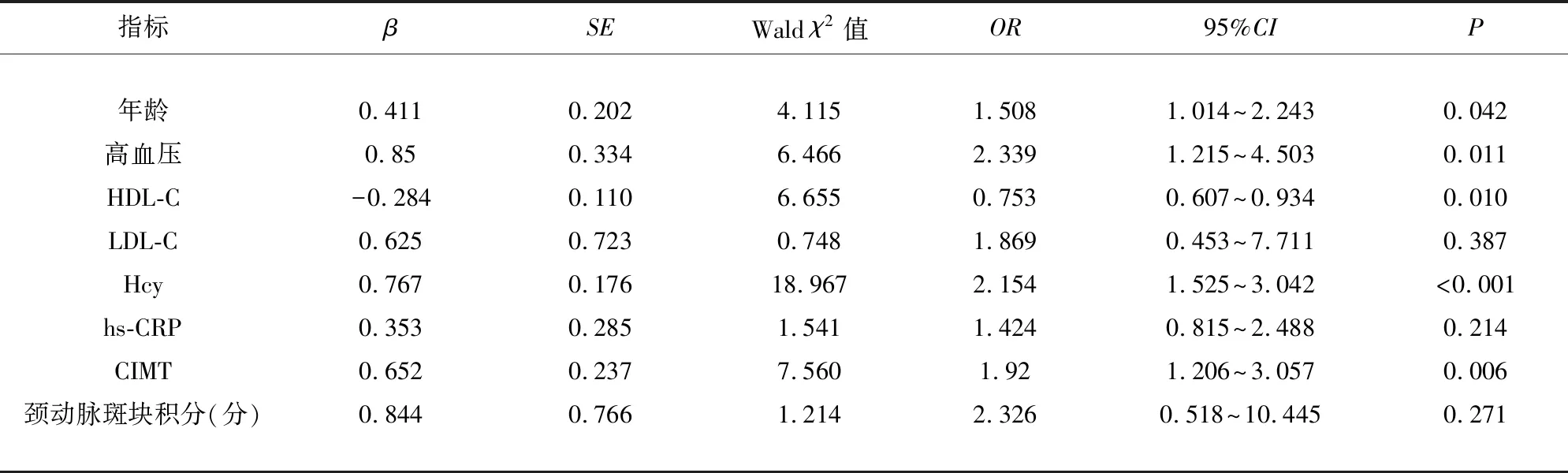
表4 LI患者WML与CMBs合并发病的危险因素分析
3 讨 论
本次研究结果显示,不同CMBs病情程度患者年龄、合并高血压、颈动脉斑块积分及CIMT水平存在显著差异。高龄、高血压病史作为影响脑血管疾病发生及疾病严重程度的重要影响因素,在既往的临床研究中已得到普遍认可,并且有研究认为,对于中老年人群来说,年龄每增加10岁其发生脑小血管病变的风险可增加2~3倍[4]。髓磷脂和卵磷脂水平是构成脑白质髓鞘的重要蛋白,其水平随着年龄增长而逐渐降低,因而随着年龄增长,脑小血管病变风险逐渐增加。而高血压作为诸多疾病发生的高危因素,也被证实在并发CMBs患者中收缩压、舒张压均显著增高[5],这与本研究结果一致。张东等人通过Meta分析发现,运动期间收缩压达到峰值水平是导致WML存在的决定性因素,持续高水平的收缩压或舒张压增高会影响WML病情进展,导致CMBs的发生,尤其是70岁以上患者在此情况下的表现最突出[6]。颈动脉斑块积分和CIMT水平的变化可以客观反映出患者颈动脉粥样硬化的程度。WML包含缺血性和非缺血性改变,目前认为缺血性WML在临床较为常见,主要与脑小血管壁损伤和脑血流灌注低下等基础病历变化有关。张伟等人通过对不同部位WML患者进行观察发现,WML患者的颈动脉斑块积分明显高于正常人群,其中稳定斑块积分在脑室周围以及深部白质部位评分均呈增高特点,而不稳定斑块积分以深部白质部位呈显著增高改变,由此表明动脉粥样硬化斑块与WML发生密切相关,受斑块性质的影响可能导致脑白质的病变部位和严重程度有所不同[7,8]。
CMBs和WML作为脑小血管病的常见病理改变,在脑血管疾病患者中均有较高的检出率,也常共同发生。本次研究的129例患者中,无WML和脑微血管病变患者仅12例,占比9.30%,在发生脑小血管病变患者中,单纯WML患者8例,单纯脑微血管病变患者26例,而WML合并CMBs患者83例,占比70.94%。整体分析显示,在LI患者中CMBs程度与WML程度两者呈正相关,有学者认为,微血管病变是CMBs和WML发生的共同基础[9],暂未发现有明确的发病先后的特点,这也是患者中存在单纯CMBs和单纯WML的原因。目前我国对于脑小血管病变的研究大多集中于单一病变患者,对于WML合并CMBs患者的研究较少。本研究通过对合并发病患者进行Logistic回归分析显示,除年龄、高血压、CIMT等影响因素意外,HDL-C水平降低和Hcy水平增高成为合并发病的独立危险因素。高水平收缩压被认为是导致微小血管破裂出血的主要原因,其机制与血管内皮损伤、脑小动脉玻璃样和纤维化病变所致的血管平滑肌细胞、弹力纤维大量丢失有关[10~12],因此相比WML,高水平收缩压更容易造成CMBs的发生,成为WML合并CMBs的独立危险因素。而HDL-C作为一种抗动脉硬化的血浆脂蛋白,临床已普遍证实其水平与动脉管腔狭窄程度呈负相关,严重脑动脉硬化则可显著增加患者脑微血管病变的发病风险。另外,Hcy作为甲硫氨酸循环代谢过程中的中间产物,其主要作用在于参与人体肾上腺素、胆碱、肉碱等多种物质的代谢过程,当人体代谢功能发生异常时,Hcy则会在血液中大量积累,甚至发展为高Hcy血症。目前研究已证实,Hcy可作为急性LI的独立诊断指标[13,14]。最新的研究结果表明,血Hcy水平与WML、CMBs呈正相关[15],这也提示Hcy水平异常可能成为WML和CMBs合并发病的早期信号,这对指导临床早期干预具有实际的指导意义。因而,整合相关临床检测指标对于评估患者脑小血管病变程度及其发展趋势具有可行性,但建立有效的预测模型不仅需要多中心大样本研究,同时还需要明确WML、CMBs以及两者共病在临床表现中的差异性并进行分类研究。
综上,LI患者WML严重程度与CMBs程度呈正相关,年龄增长、高血压史、收缩压高、低水平HDL-C、高水平Hcy以及CIMT增加是影响LI患者WMLs合并CMBs的危险因素。

