颅内动脉延长扩张症2例报告及文献复习
任雅芳, 付胜奇, 禹 萌, 刘 冰, 刘海涛, 张洪涛, 张淑玲
随着影像技术的发展,在重视动脉粥样硬化血管狭窄致病的同时,越来越多的研究发现颅内动脉延长扩张症与脑血管病之间具有一定的相关性[1,2]。颅内动脉延长扩张症(intracranial arterial dolichoectasia,IADE)是指颅内动脉延长、扩张以及迂曲,根据受累动脉部位的不同,分为颈内动脉延长扩张症和椎基底动脉延长扩张症[2](vertebrobasilar dolichoectasia,VBD)。现报道2例颅内动脉延长扩张症患者的病程进展,讨论IADE的病因、导致脑梗死的发病机制、合并症及治疗。
1 临床资料
1.1 患者男,52岁,2013年12月24日主因“右侧口角低垂、闭目无力2 d”入住我院神经内科。查体:Bp:140/85 mmHg,右侧周围性面瘫,诊断右侧周围性面神经麻痹,经治疗后好转出院。既往有高血压病史。吸烟史约25 y,每日约30支。长期大量饮酒约15 y,每日约5两。2015年1月7日主因“头晕、右侧肢体麻木无力15 d,加重1 d”入院,查体:Bp:140/90 mmHg,双侧眼球向右侧凝视,左眼闭合力弱,左侧鼻唇沟变浅,右侧肢体肌张力低,右侧肢体肌力0级,腱反射(+),右侧巴氏征阳性,右侧偏身痛觉减退,NIHSS评分:13分。头部MRI(见图1A)提示左侧脑桥梗死灶;磁共振MRA(见图1B)提示椎基底动脉延长、扩张。诊断脑梗死(椎基底动脉系统)、椎基底动脉延长扩张症。经治疗后右侧肢体肌力3级,扶持下可行走。2015年9月28日主因“左侧肢体无力7 d,头痛4 d”再次入院,查体:Bp:150/90 mmHg,意识清楚,左侧中枢性面舌瘫,左上肢肌力2级,左下肢肌力3级,左侧肢体肌张力低,左侧巴氏征阴性。右侧肌张力高,右侧肢体肌力0级,右侧巴氏征阳性。腰穿压力300 mmH2O,脑脊液蛋白73.36 mg/dl,结合磁共振影像检查(见图1C、D)示磁共振T2序列及T1增强序列示基底动脉延长、扩张突入第三脑室致幕上脑室脑积水继发大脑半球深部脑白质血管源性水肿,基底动脉扩张,横径最宽处约7~8 mm。诊断梗阻性脑积水,行脑脊液脑室腹腔分流术,术后复查头部CT(见图1E)双侧侧脑室较前明显缩小。治疗后言语障碍、左侧肢体肌力基本恢复正常,右侧肢体无力部分恢复,扶持下可行走。2016年12月13日主因“头晕5 d,饮水呛咳、吞咽困难1 d”再次入院,查体:Bp:140/80 mmHg,构音障碍,右侧眼裂小,右眼向右侧凝视有粗大眼震,左侧眼球外展不充分。右侧鼻唇沟变浅,伸舌偏右,右上肢近端肌力3级,远端0级,右下肢近端肌力3+级,远端0级,右侧肌张力偏高,右侧巴氏征阳性,NIHSS评分:7分。头部MRI(见图1F、G)DWI序列提示右侧延髓、脑桥点状梗死灶,头部MRA(见图1H)示椎基底动脉延长扩张较2015年变长,诊断脑梗死(椎基底动脉系统)、椎基底动脉延长扩张症,治疗后吞咽困难较前好转出院。

图1 病例1,头部MRI(2015年1月7日) :A(DWI)左侧脑桥梗死灶(白色箭头);B(MRA)椎基底动脉延长、扩张。头部MRI(2015年9月28日):C(T2)、D(T1增强)示基底动脉延长、扩张突入第三脑室致幕上脑室脑积水继发大脑半球深部脑白质血管源性水肿,基底动脉扩张横径最宽处约7~8 mm。头部CT(2015年10月3日):E示脑脊液引流术后复查,双侧侧脑室较前明显缩小。头部MRI(2016年12月14日);F(DWI)、G(DWI)示右侧延髓、脑桥点状梗死灶;H(MRA)示椎基底动脉延长扩张较2015年变长
1.2 患者男,58岁,主因“突发言语不清、左侧肢体无力60 min”于2021年11月16日入院。入院60 min前患者回家途中突然出现言语不利、左侧肢体无力,伴左上肢麻木,症状呈持续性。查体:Bp:202/124 mmHg。双眼向左凝视,左侧中枢性面舌瘫,吞咽稍困难,左侧肢体肌力3级,左侧肢体肌张力低,左侧巴氏征阴性。左侧肢体痛觉减退。NIHSS评分:10分。至我院急诊启动卒中绿色通道,头部CT排除出血,和家属沟通后拒绝静脉溶栓治疗。既往史:患“高血压病”10 y。患“高尿酸血症”1 y。有吸烟史30 y,每天10支。辅助检查:低密度脂蛋白胆固醇 3.47 mmol/L。头部MRI(见图2A、B)提示右侧脑桥急性梗死灶,SWI(见图2C)提示双侧侧脑室旁、基底节区、左侧丘脑、双侧枕叶多发散在微出血灶。头部CTA(见图2D~F)示双侧颈内动脉C6、C7段梭形动脉瘤,基底动脉远端动脉瘤(瘤颈直径8 mm),局部梭形膨大并多发钙化斑块及非钙化斑块;颈部CTA(见图2G)左侧椎动脉优势;磁共振管壁分析(见图2H)示基底动脉偏不稳定斑块形成,脑桥层面基底动脉直径约7 mm,并向左侧弯曲。肾动脉、双下肢动脉彩超未见明显异常。冠脉CTA左前降支近中段、左回旋支近段、右冠状动脉近中段,管腔局部轻度狭窄,未见明显扩张。入院后诊断为脑梗死(椎基底动脉系统)、椎基底动脉延长扩张症、颅内多发动脉瘤,给予阿司匹林抗血小板聚集、强化他汀、控制血压等治疗,症状逐渐加重,左侧肢体肌力2级,更换为替罗非班静脉泵入后左侧肢体无力逐渐好转,NIHSS评分:5分,转康复医学科继续治疗。
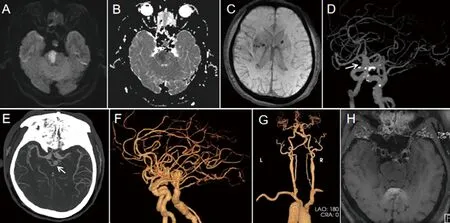
图2 病例2,头部MRI(2021年11月20日):A(DWI)、B(ADC)示右侧脑桥急性梗死灶;C(SWI)示双侧侧脑室旁、基底节区、左侧丘脑、双侧枕叶多发散在微出血灶。头颈联合CTA(2021年11月21日):头部CTA(D~F)示双侧颈内动脉延长、扩张伴C6、C7段梭形动脉瘤,基底动脉远端动脉瘤(瘤颈直径8 mm),局部梭形膨大并多发钙化斑块及非钙化斑块;颈部CTA(G)左侧椎动脉优势。磁共振管壁(2021年11月20日):H(管壁成像)基底动脉偏不稳定斑块形成,脑桥层面基底动脉直径约7 mm,并向左侧弯曲
2 讨 论
VBD是以椎基底动脉显著扩张、延长、扭曲或成角为特征的少见脑血管异常变异,是颅内动脉延长扩张(IADE)的最常见类型。普通人群中IADE的患病率大约为0.06%~5.8%[3,4],卒中患者中,IADE比率上升至12%[2]。研究表明,在第一次发生卒中的人群中,VBD的发生率约为2.06%[5]。IADE的发病机制尚不清楚,Pico F等[2]提出其病理为血管中膜内弹力层的疏松和内弹性膜的破裂。推测其在先天因素、血管金属蛋白酶(matrix metalloproteinases,MMP)及后天血管异常重构共同作用下发病。后天获得性危险因素包括高血压、男性、吸烟等。本文中2例均为男性患者,均有吸烟、高血压等病史,与文献报道相一致[2,6]。
本文中病例1为中年男性,既往有吸烟、饮酒、高血压等脑血管病危险因素,先后出现面神经受压导致面神经麻痹、反复后循环梗死以及梗阻性脑积水等临床表现,头部MRA提示基底动脉扩张横径最宽处约7~8 mm,且突入第三脑室。病例2为中年男性,既往有高血压、吸烟等脑血管病危险因素,头部MRI提示右侧脑桥急性梗死灶,头部CTA血管成像示双侧颈内动脉C6、C7段梭形动脉瘤,基底动脉远端动脉瘤(瘤颈直径8 mm)。磁共振管壁分析示基底动脉偏不稳定斑块形成,脑桥层面基底动脉直径约7 mm,并向左侧弯曲。VBD的诊断依靠影像学特点,包括Smoker[7]的CT标准以及Giang DW[8]的磁共振标准,Giang DW的磁共振标准如下:通过高分辨磁共振测量脑桥层面基底动脉(Basilar artery,BA)的直径、分叉处高度和位置。BA直径大于4.5 mm定义为异常;BA 分叉处的高度积分标准为:低于或平鞍背水平计0分,在鞍上池水平计1分,到达第三脑室底间计2分,压迫或突入第三脑室计3分。BA侧向偏移位置积分标准为:0级为在中线上;1级为可能偏离中线;2级为明显偏离中线;3级为偏移至桥小脑角。当BA高度或偏移度积分≥2分称为延长,当BA 直径在任何部分均>4.5 mm可诊断为扩张。VBD的影像学诊断标准为BA同时满足以上延长和扩张条件。按照以上标准,本文中2例患者均符合VBD的诊断,且病例2患者同时存在双侧颈内动脉延长扩张症。
IADE可无任何临床症状,当出现症状时,则表现各异[2]。其中,以缺血性脑卒中最为常见,其次为脑出血、脑干及脑神经受压症状、梗阻性脑积水等。病例1先后出现面神经受压导致面神经麻痹、后循环梗死以及梗阻性脑积水等表现,在临床中较为少见。此外研究提示VBD更容易导致脑桥旁正中动脉供血区域梗死[9],病例2右侧脑桥梗死与既往文献报道相一致[9]。VBD发生缺血性卒中的发病机制[2]包括:(1)血栓直接堵塞穿支;(2)从扩张基底动脉脱落的栓子堵塞远端穿支动脉;(3)原位血栓形成。其次在kumrl E[10]的研究中指出VBD的椎基底动脉内血流呈双向,前向血流减少,虽血流峰值速度相对不变,但平均血流速度减低,由此可导致供血区域血流灌注不足诱发缺血性脑卒中。此外,研究表明,延长扩张的椎基底动脉使分支血管受到牵拉和扭曲,特别是基底动脉的分支,使这些穿支动脉血流减少从而发生脑梗死[1]。病例1患者反复后循环梗死,考虑与血栓直接堵塞穿支及平均血流速度减低相关,但因技术问题未能完善磁共振斑块分析检查证实。病例2患者为扩张的基底动脉向左侧弯曲,右侧脑桥发生急性梗死灶,且有逐渐加重的临床过程,结合磁共振斑块分析结果及以上文献报道,考虑其发病机制为基底动脉存在动脉粥样硬化斑块逐渐堵塞穿支动脉,延长扩张的血管局部血流异常,并使脑桥旁正中支受到牵拉,从而产生脑梗死。
脑小血管病与IADE之间存在联系[11,12],IADE患者更容易出现腔隙性脑梗死、白质疏松、微出血等。VBD微出血灶主要分布于后循环区域[13]。病例2患者SWI提示多发微出血灶位于双侧侧脑室旁、基底节区、左侧丘脑、双侧枕叶散在多发微出血灶,提示可能与颅内动脉延长扩张症相关。Pico F[2]等报道HIV感染可出现颅内动脉延长扩张,IADE可伴发动脉瘤,如腹主动脉瘤、冠状动脉扩张,病例2患者经过冠脉CTA检查已排除冠脉扩张。同时IADE可发生于代谢性疾病(Fabry’s病,Pompe病)、其他基因疾病(常染色体显性遗传多囊肾、Marfan’s综合征、弹力纤维性假黄瘤)等。临床工作中遇到IADE患者需尽可能完善冠脉CTA、肾脏彩超、其他部位动脉彩超等检查,注意追问相关病史及家族史,以发现其他导致IADE的相关疾病。
IADE存在颅内多发微出血灶,其次颅内动脉扩张可形成梭形动脉瘤[2],同时也容易合并其他部位颅内动脉瘤,以上因素均导致其出血风险增高。研究表明,VBD所致的出血与基底动脉延长扩张的程度显著相关,高血压病以及使用抗血小板或抗凝药物均可增加VBD破裂出血的风险[14]。本文中2例患者均有使用抗血小板药及存在高血压病史,其出血风险较高,因此未使用阿司匹林联合氯吡格雷的双抗治疗。同时治疗过程中需严密监测血压,避免血压波动诱发动脉瘤破裂出血。针对IADE延长扩张的血管本身缺乏有效的治疗手段,可依据不同的临床症状,推荐不同的治疗手段[2]。症状性脑积水行脑室分流术是有效的,脑梗死可参照临床指南个体化治疗。此外1 y内基底动脉扩张大于2 mm,提示高出血风险,建议手术、控制血压更低或血管内治疗。建议每6个月或1 y复查一次磁共振,以防出现新的症状。
综上所述,IADE患者总的死亡率和卒中相关死亡率高于非延长扩张的卒中患者[15],需引起临床医生的重视。目前尚无明确的治疗方案,出血与缺血之间的治疗需个体化平衡。1 y内快速扩张的动脉是破裂的危险信号,应用抗血小板药物的同时积极控制血压,定期复查影像学检查,及时调整治疗方案以提高这类患者的整体预后。

