经大鼠尾动脉置鞘法建立介入通路的研究
高 群, 胡 深, 樊静雯, 王大明
啮齿类动物已发展成为准确描述疾病生物学基本过程不可或缺的工具[1]。随着啮齿类动物的大量应用,改良的成像技术(如CT和MR)已被广泛用于小动物模型[2]。作为侵入性成像的技术之一,选择性动脉插管联合数字剪影血管造影术(Digital silhouette angiography,DSA)是能够呈现实时药物、细胞或器械时间和空间分辨的成像技术[3,4]。经颈动脉和股动脉选择性插管是啮齿类动物模型常用的血管途径[5,6]。然而,经股动脉或颈动脉途径引起的一侧肢体或颈部的并发症包括术后缺血、神经损伤、感染等也较为常见[7,8]。由此导致的动物行为学变化以及致死致残率常常影响实验效果的评估。因此,课题组探索成年大鼠尾动脉鞘管通路在介入动物模型制作中的优势,设计出了一种便捷、可重复的介入操作方法。
1 材料与方法
1.1 实验动物 取清洁级雄性成年Sprague Dawley(SD)大鼠6只(北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006),体重650 g~700 g。大鼠分笼饲养于安静环境中,昼夜自然光照射,自由饮水,室温控制在22 ℃~25 ℃,术前禁食12 h。所有操作均按照NIH指南进行,并经北京大学动物实验伦理委员会批准(批准号:LA2021426)。
1.2 实验设备及器械 数字减影血管造影机(Philips,荷兰),18G静脉留置针外套管(BD,美国),直径0.035英寸(0.87 mm)的导丝(泰尔茂,9F股动脉穿刺包),碘克沙醇(320 mgI/ml),造影微导管(Marathon microcatheter 1.5F/2.7F)及微导丝(Mirage Hydropphilic Guidewire 0.010 inchs),1.5 mm×15 mm tazuna球囊,4.0 mm×20 mm solitaire支架及配套导管Rebar 18;手术刀柄,眼科剪,眼科镊,止血钳,持针器,玻璃分针,4-0医用尼龙缝线(上海医用缝合针厂),放大镜,直尺,游标带表卡尺(精度0.01 mm),1 ml、5 ml注射器,小动物动脉夹,消毒液,生理盐水,木质动物手术台,无菌布巾,无菌纱布,橡皮筋。
1.3 手术方法 术前12 h停止进食,自由饮水。用2%戊巴比妥钠腹腔注射麻醉(0.35 ml/100 g),待全身麻醉后,将大鼠仰卧,四肢及头部固定于木质解剖台,用热毛毯保持体温在36.5 ℃,尾部正中备皮、消毒。取距尾根部3 cm处行尾腹侧正中直行切口,切口长1 cm,显微剪刀切开筋膜,分离皮下结缔组织,尾动脉距真皮质约1 mm,在放大镜下,可清晰显示大鼠尾动脉,用剥离子将尾动脉与周围小静脉钝性分离,避免锐性解剖,分离时动作要轻柔,切忌粗暴。安全有效地分离尾动脉约0.5 cm。分离结束后,局部滴入少许2%利多卡因避免痉挛,带入2根4-0缝线,一根结扎尾动脉远心端,另一根留近心端备用。利用近心端丝线将尾动脉提起后用动脉夹夹闭近端尾动脉,使用显微剪将血管做鱼嘴形切口,切口约为血管直径的1/3~1/2大小,超过此范围在置鞘时切口处易断裂,小于该范围鞘管不易进入尾动脉。置鞘管前需仔细检查鞘管尖端是否光滑,导丝在鞘内进退是否顺利。使用5 ml注射器的针头辅助挑起尾动脉断端,缓慢在切口处由远心端向尾动脉近心端置入导丝,然后经导丝指引置入鞘管通道(见图1)(在此过程中需显微镊辅助,注意操作轻柔,切勿扯断动脉),当鞘管头端进入动脉3~5 mm时,动脉近端丝线即可结扎固定鞘管,缓慢抽出鞘管内的导丝,经动脉鞘管注入肝素100 IU/kg,维持动脉血流通畅,防止操作过程中血栓形成。
1.4 经尾动脉血管造影及介入操作 成功置入尾动脉鞘管通道后,将0.010英寸(0.025 cm)微导丝及Marathon微导管(1.5 Fr)沿尾动脉鞘管通道依次进入尾动脉、荐中动脉、腹主动脉,撤出微导丝,行血管造影检查导管是否位于腹主动脉,直视下继续沿胸主动脉上行至主动脉弓处,导管到位后退出导丝,将高压注射器连接管与微导管部连接后经尾动脉注入对比剂碘克沙醇(0.2 ml/s,压力100 psi,总量1.0 ml)。观察主动脉弓及分支血管情况。完成主动脉弓造影后,继续沿血管上行,在导丝指引下行选择性颈总动脉、颈内动脉造影;造影结束后,引入直径1.5 mm×15 mm球囊,球囊顺利通过尾动脉鞘管,于胸主动脉处扩张球囊,球囊充盈完全,缓慢撤回球囊,模拟球囊损伤/扩张模型。沿尾动脉鞘管引入Solitaire支架导管,至胸主动脉处释放支架,支架释放完全。造影及介入操作结束后拔出导管及留置鞘管,结扎尾动脉近心端,逐层缝合尾部切口,并腹腔内注射1.5 ml抗生素溶液(80万U青霉素+100万U链霉素溶于250 ml生理盐水)。
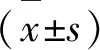
2 结 果
2.1 总体情况 全部6只SD大鼠均置尾动脉鞘管成功,成功率为100%(6/6),未出现尾动脉暴露不良、导引导丝或留置鞘管穿破尾动脉以及鞘管无法置入等情况;术后1 w大鼠存活率为83.33%(5/6),死亡主要原因是术后1 d尾部伤口裂开,失血过多所致;余5只大鼠全部存活,未出现因麻醉、大量出血和(或)感染死亡的情况。
2.2 改良18G鞘管可顺利植入大鼠尾动脉 选取距尾基部3 cm处作为切开位点(见图1A),可见尾动脉由肌腱之间的腹筋膜覆盖,处于适宜插管的位置,钝性分离尾动脉带入缝线(见图1B),结扎尾动脉远端后经动脉切口植入导丝(见图1C、D),鞘管内径(1.27 mm)大于导丝直径(0.87 mm),鞘管可经导丝顺利导引进入尾动脉(见图1E、F)。本实验所选大鼠尾动脉经测量直径约(1.19±0.14)mm,通过局部利多卡因预防血管痉挛以及导丝导引,在血管容受范围内可顺利植入18G鞘管(1.27 mm) (见图1F)。
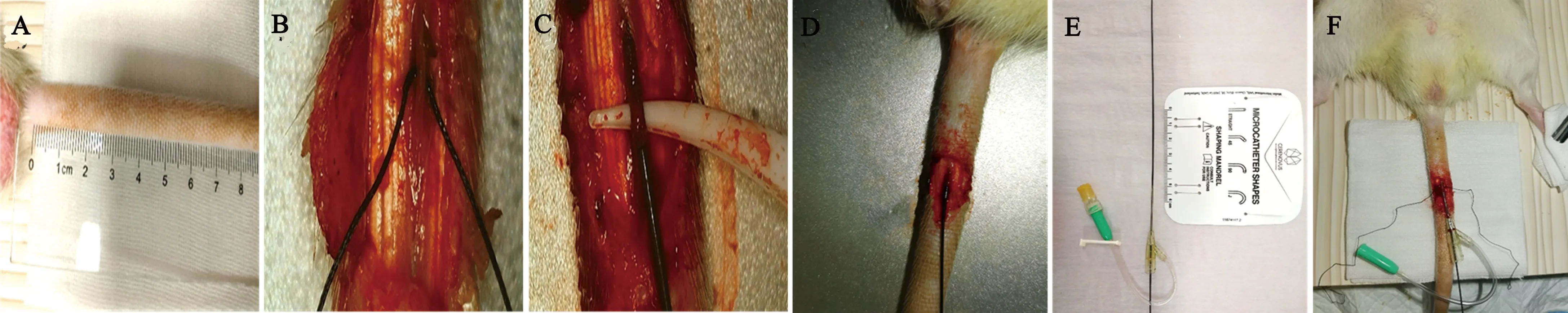
图1 大鼠尾动脉分离及插管。(A)尾动脉体表定位;(B)尾动脉分离、带线;(C、D)导丝经动脉切口置入尾动脉;(E、F)鞘管可顺利通过导丝并在导丝指引下进入尾动脉
2.3 盆腔部血管造影 经鞘管置入微导丝后引导微导管进入尾动脉,透视显影显示微导丝及微导管沿尾动脉走行,未出现鞘管通道异常及导管阻塞等情况(见图2A、B);沿尾动脉-荐中动脉继续上行,显示导管顺利进入腹主动脉内,至腹主动脉-肠系膜上动脉开口处行选择性肠系膜上动脉造影,结果显示腹主动脉第一腰椎高度发出肠系膜上动脉,动脉主干呈向右侧稍凸的弓状,从弓的凸侧发出分支动脉(胰十二指肠动脉和空、回肠动脉),凹侧分支动脉为结肠动脉,并且透视下可见膀胱内充盈代谢的造影剂(见图2C)。
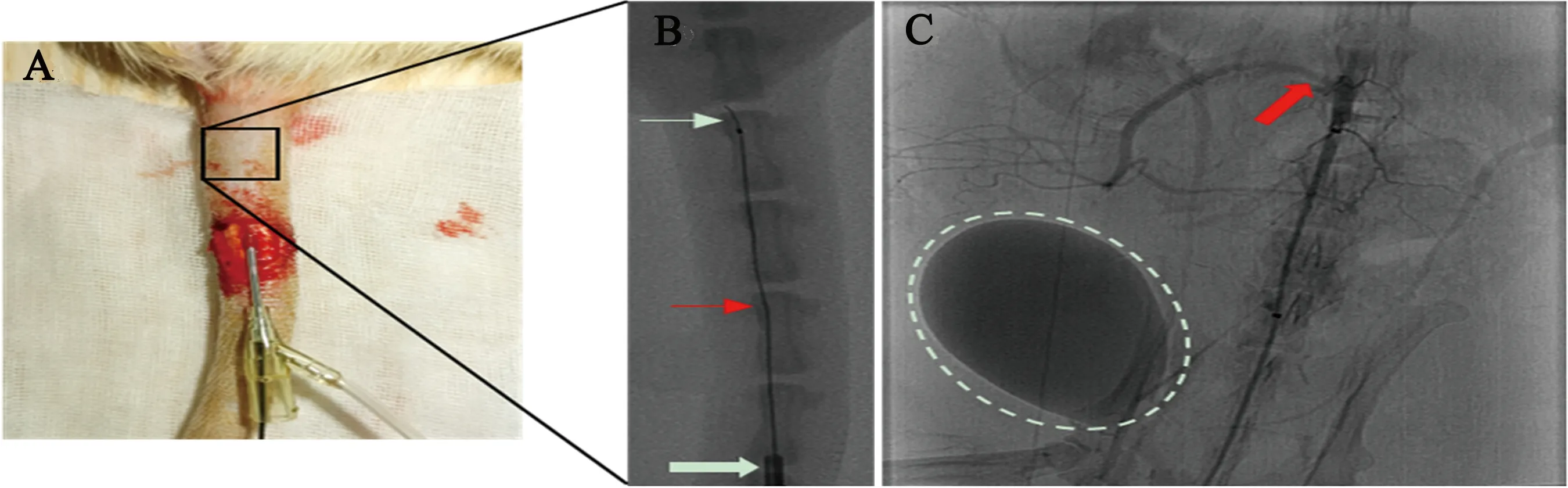
图2 经微导管选择性肠系膜上动脉造影。(A)尾动脉鞘管通道完成;(B)微导丝、微导管以及鞘管在尾动脉的透视显影图;(C)肠系膜上动脉选择性造影及充满代谢性造影剂的膀胱。白色细箭头示:微导丝;红色细箭头:微导管;白色粗箭头:尾动脉鞘管头端;红色粗箭头:肠系膜前动脉。白色虚线圈:膀胱
2.4 主动脉弓及分支血管造影 微导管在0.010英寸导丝引导下插至主动脉弓,行主动脉弓造影显示双侧锁骨下动脉及颈总动脉全程显影,血管光滑规整(见图3A~C),在0.010英寸导丝引导下将微导管插至右侧颈总动脉造影,颈总动脉分支颈外动脉及颈内动脉清晰可见(见图3D~G),行大鼠造影时微导管未弹出,顺利完成目标血管造影并获得满意的造影图像。
图3 主动脉弓及分支血管造影。(A)主动脉弓微导管到位;(B、C)主动脉弓及分支动脉造影正侧位;(D~G)选择性右侧颈总动脉造影正侧位
2.5 选择性颈内动脉造影 取左侧颈总动脉路图影,可见颈总动脉分为颈内动脉及颈外动脉,颈内动脉由下至上依次分为颅外翼颚动脉、颅内大脑后动脉、大脑中动脉及大脑前动脉(见图4A),沿颈总动脉上行至颈动脉分叉部,颈内动脉朝向后、外侧走行,微导管在微导丝引导下进入颈内动脉前段,造影显示颈内动脉首先分出翼颚动脉,进入颅内后分为大脑后动脉、大脑中动脉以及大脑前动脉(见图4B)。
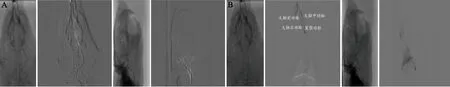
图4 选择性左侧颈外动脉造影。(A)正侧位路图下微导丝指引微导管到位;(B)微导管到位后造影显示左侧颈内动脉颅外分支(翼颚动脉)及颅内分支(大脑前、大脑后、大脑中动脉)
2.6 球囊及支架血管腔内释放 为了验证球囊导管以及Solitaire FR支架导管直径0.021英寸(0.533 mm)是否可以经尾动脉鞘管进入主动脉,我们首先在体外测试球囊导管及支架导管是否可以通过鞘管,球囊导管及支架导管可以顺利通过鞘管(见图5A);尾动脉置鞘完成后,体内测试球囊导管及支架导管的通过程度,结果显示,球囊导管以及支架导管不仅可以通过动脉鞘管,而且能够在体内完成充盈及释放(见图5B、C)。
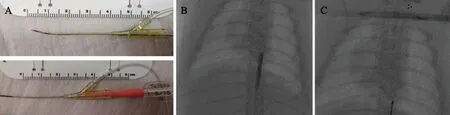
图5 球囊及支架导管可顺利经尾动脉鞘管进入主动脉。(A)体外检测1.5 mm×15 mm球囊导管可顺利通过18G鞘管;(B)球囊导管顺利到达胸主动脉并且能够完全充盈;(C)Solitaire FR支架导管到达胸主动脉并释放
3 讨 论
本文报道了利用大鼠尾动脉进行动脉鞘管置入的新方法,该方法可经单一鞘管通道对大鼠进行连续的DSA造影和/或重复的介入操作。该方法将进一步提高大鼠作为人类疾病模型的应用范围。
介入血管术在神经科、介入血管科、肿瘤科应用广泛;虽然对大型动物(如灵长类动物、猪或狗)的研究可用于获得可靠的血管评估[9],但研究费用昂贵、相关分子生物学试剂定制困难等情况,常常不利于精确描述疾病发生发展的生物学基本过程;对于啮齿类动物,由于体型较小血管较细,施行介入操作较为困难[10,11]。既往研究常采用经股动脉或颈动脉直接置入导管法进行介入操作[12,13],然而,股动脉或颈动脉不仅结构复杂、解剖创面大,并且供血范围广泛,介入操作完成后结扎动脉残端,极易发生一系列并发症(术后缺血、神经损伤、感染等),影响动物神经行为学评估以及造模后恢复[7,8]。近期国外研究者Kumagai等人报道利用大鼠尾动脉直接插管法进行动物介入研究[14],该方法虽然简易、迅速,有效避免了经股、颈动脉通路带来的并发症,但是未能做到单一置管位点重复使用,导管退出之后需重新插管,存在术中退管动脉大出血等潜在问题。我们改良的尾动脉鞘管置入法通过可单一鞘管通路重复插入造影导管、球囊导管或支架导管,并且可在操作过程中滴注润滑防止术中导管干涩、血栓形成。
研究中选用SD大鼠(650 g~700 g),温度保持36.5 ℃。尾近端3 cm内,皆可作为置管位点,在此范围血管直径变化不大,可提高置管成功率。大鼠尾部主要的血供为“一动三静”以及动静脉侧支循环网络,尾动脉位于大鼠腹侧,为荐中动脉的延续,尾部腹侧及两侧为静脉。尾动脉在解剖学上位置浅表,容易暴露[8]。经我们的实验检测尾动脉置入鞘管平均时间(11.00±1.90) min比既往研究(9.5±2.0) min[14]稍长,这可能与我们需要固定鞘管有关。既往研究股动脉插管所需的时间约为尾动脉的3倍[15],这与解剖的复杂性有极大的相关性。在我们的研究中,股动脉插管时间(18.17±3.43) min大约是尾动脉的1.65倍,颈动脉插管时间(24.5±4.51) min 大约是尾动脉的2.23倍,这可能与操作者之前对颈动脉、股动脉位置以及解剖结构较为熟悉有关。尾部血供丰富,尾侧动脉的存在可以有效避免尾动脉结扎尾部缺血的发生[14]。尾动脉通路是高效、可重复、并发症较低的介入通路,因此可以作为替代股动脉或颈动脉通路的一种选择。
尾动脉“直线形”的解剖结构使得介入操作在透射台上可以很好的执行。经尾动脉入路对大鼠脑、内脏、大血管和周围血管造影获得完整、可靠的造影结果。并且能够经尾动脉鞘管顺利置入球囊导管以及支架导管,该技术的实现为大鼠内皮损伤、动脉粥样硬化、脑梗死以及血管狭窄等疾病模型提供了技术支撑。该技术主要受限于靶血管及介入导管的直径,在规格合适的范围内完全可以推广到体重更轻、血管更细的啮齿类动物。
综上所述,我们利用大鼠尾动脉鞘管置入建立介入通路的方法,建立了单通道、可重复操作的大鼠介入动物模型,能够很好探究介入大鼠模型的临床表现、血管病变特征以及病理生理改变;而且可顺利完成球囊及支架介入治疗,这将为血管狭窄、动脉粥样硬化、脑梗死、内皮损伤、肿瘤等大鼠模型的研究提供一个崭新的平台。

