绕行钙化斑块正向内膜下重回真腔技术开通左前降支慢性完全闭塞病变1 例
陆阳 彭乾坤 季德 赵仙先
1 临床资料
患者 女,55岁。因“反复活动后心前区疼痛2年”于2020年6月8日就诊于安徽省泗县人民医院。患者于2018年开始反复出现活动后心前区疼痛不适,呈压榨样,每次持续3~5 min,休息后可自行缓解,曾就诊于当地医院,给予阿司匹林、阿托伐他汀口服后,症状无明显改善。1个月前自觉胸痛症状明显加重,胸痛发作时伴大汗,持续2 h不能缓解,遂再次就诊于当地医院。心电图示:窦性心律,Ⅱ、Ⅲ、aVF导联ST段抬高1 mm,V2~V3导联ST段轻度压低。急诊行冠状动脉造影示:左主干体尾部狭窄30%~40%,左前降支近中段发出第一对角支后完全闭塞;左回旋支细小,中远段弥漫性病变,最重处狭窄约90%,远段通过房室支发出侧支提供右冠状动脉左心室后支血流;右冠状动脉中段完全闭塞,闭塞段内可见少量对比剂滞留;右心室支通过心外膜侧支供应左前降支远段血流。结合患者病史及冠状动脉造影结果认为右冠状动脉为罪犯血管,于右冠状动脉串联置入Firebird 2支架[微创医疗器械(上海)有限公司]2.5 mm×29 mm及3.0 mm×23 mm各1枚。复查造影示:支架膨胀良好,右冠状动脉血流恢复。心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)血流分级Ⅲ级。患者术后恢复良好,给予抗血小板、调脂、降压、降糖等治疗,于术后第3天出院。此次为开通左前降支闭塞病变入安徽省泗县人民医院。既往有高血压病、2型糖尿病史多年,长期规律口服降压、降糖药,血压、血糖控制可;否认吸烟史。入院查体:血压134/72 mmHg(1 mmHg=0.133 kPa);双肺呼吸音清,未闻及干湿性啰音;心界不大,心率78次/分,律齐,未闻及杂音;双下肢无水肿。心电图示:窦性心律,大致正常心电图。超声心动图示:心脏各房室大小正常,左心室舒张功能减低,左心室收缩功能正常(左心室射血分数52%)。
排除手术禁忌证后于2020年6月10日再次行冠状动脉造影。经右桡动脉入路送入6 F EBU 3.5指引导管至左冠状动脉口,经左侧桡动脉入路送入6 F SAL 1.0指引导管至右冠状动脉口,双侧造影显示右冠状动脉通过后降支发出侧支至左前降支远段。由于左前降支闭塞病变入口难以识别,闭塞远段呈弥漫性狭窄(图1),决定首先尝试逆向介入治疗。沿右冠状动脉指引导管送入150 cm Corsair微导管,沿微导管先后送入SION及SUOH 03导丝至后降支反复尝试均无法通过间隔支侧支,微导管造影同样未能发现良好侧支循环。遂放弃逆向介入治疗,转为正向介入治疗。经左冠状动脉指引导管送入SION导丝至第一间隔支,尝试送入血管内超声至间隔支内失败。后送入135 cm Corsair微导管,沿微导管送入SION导丝至左前降支闭塞段近端。跟进微导管后,于左前降支闭塞段近端经微导管造影,结果显示左前降支闭塞段内似有微通道与左前降支远段连接。经微导管送入Fileder XTR导丝未能通过闭塞处,后更换为GAIA Second导丝,顺利通过闭塞段至左前降支远段,经多体位对侧造影提示导丝位于真腔。尝试跟进Corsair微导管困难,以NANTO法退出微导管后,经GAIA Second导丝先后送入mini TERK 1.2 mm×8 mm、TAZUNA 1.25 mm×10 mm预扩张球囊至闭塞处,以12~22 atm(1 atm=101.325 kPa)反复扩张仍无法通过。后使用mini TERK 2.0 mm×15 mm预扩张球囊于第一对角支内锚定,球囊仍无法通过闭塞处(图2)。使用mini TERK 1.2 mm×8 mm预扩张球囊以30 atm行球囊爆破(ballon-assisted microdissection, BAM),但球囊仍无法通过。考虑患者闭塞段内严重钙化,决定尝试使用导丝绕行钙化。保留左前降支内导丝,重新送入Corsair微导管,经微导管送入SION导丝至左前降支闭塞处,跟进微导管后,更换UB 3导丝主动于左前降支闭塞处进入内膜下(图3),缓慢调整导丝头端方向,将其送至闭塞段远端,跟进Corsair微导管至闭塞处远端少许,交换Miracle 12导丝。使用延长导丝退出微导管,沿Miracle 12导丝送入Stingray-LP球囊,对侧造影提示球囊位于闭塞远端,退出Miracle 12导丝,加压至4 atm扩张Stingray-LP球囊,持续透视下调整Stingray-LP球囊呈单轨征,经Stingray-LP球囊送入GAIA Third导丝(图4)。将左前降支内GAIA Second导丝作为标志,并行对侧造影确认左前降支远段真腔方向,多次调整导丝头端走行后,GAIA Third导丝成功穿刺进入远段血管腔,经对侧造影提示导丝位于真腔,使用延长导丝退出Stingray-LP球囊,沿GAIA Third导丝送入mini TREK 2.0 mm×15 mm球囊至闭塞段(图5),以12 atm×10 s行预扩张。退出球囊,沿导丝送入Corsair微导管至左前降支远段,退出GAIA Third导丝,更换SION Blue导丝至左前降支远段,退出微导管及GAIA Second导丝,沿SION Blue导丝送入volcano超声导管至左前降支远段,结果提示导丝近段及远段位于血管真腔,中段闭塞处左前降支可见重度环形钙化斑块(图6),导丝在钙化部位走行于内膜下。最终沿导丝串联置入Firebird 2 2.5 mm×33 mm、3.0 mm×29 mm及3.5 m m×2 3 m m 药物洗脱支架,使用N C TREK 3.0 mm×15 mm及4.0 mm×15 mm球囊行后扩张,复查血管内超声提示支架贴壁、膨胀良好(图7)。术后患者生命体征平稳,复查肌钙蛋白、肌酸激酶同工酶均未见异常,于术后第2天出院。术后6个月随访,患者无活动后胸闷、胸痛等不适症状。
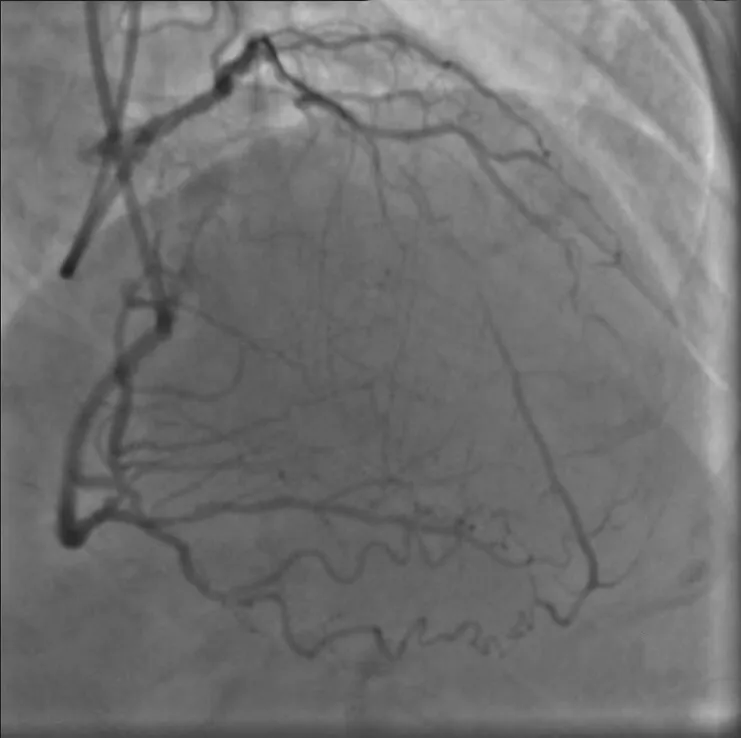
图1 双侧造影提示左前降支完全闭塞
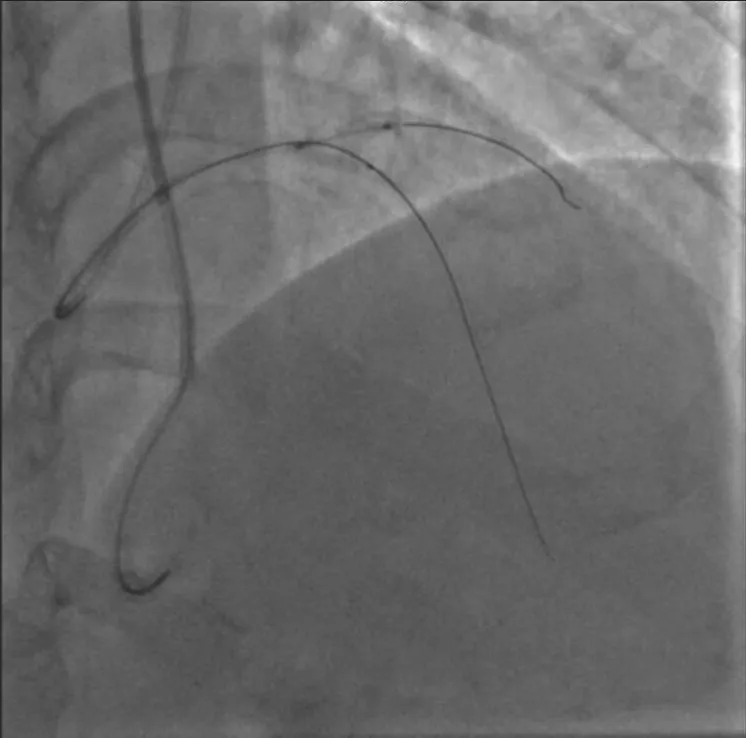
图2 GAIA Second 导丝通过后球囊无法通过
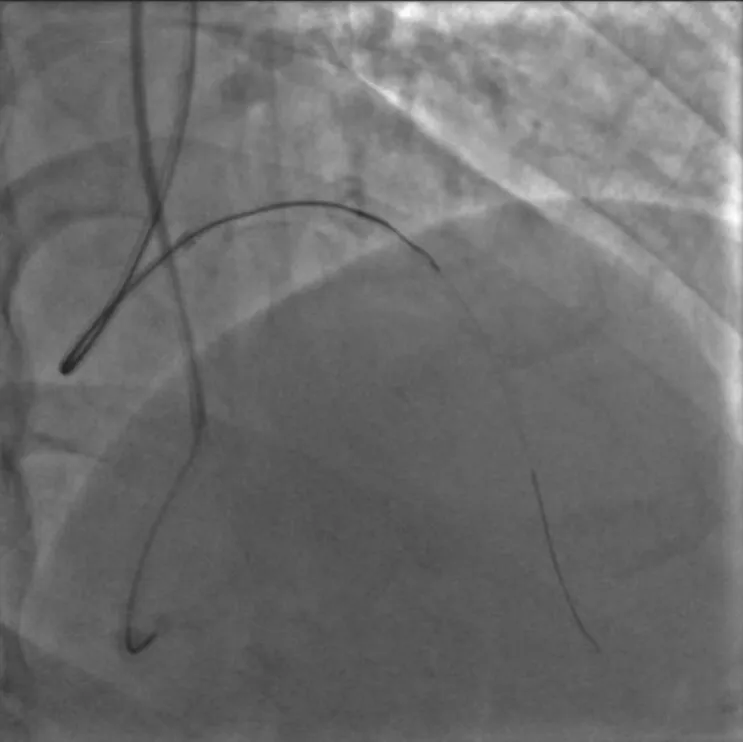
图3 使用UB 3 导丝进入内膜下
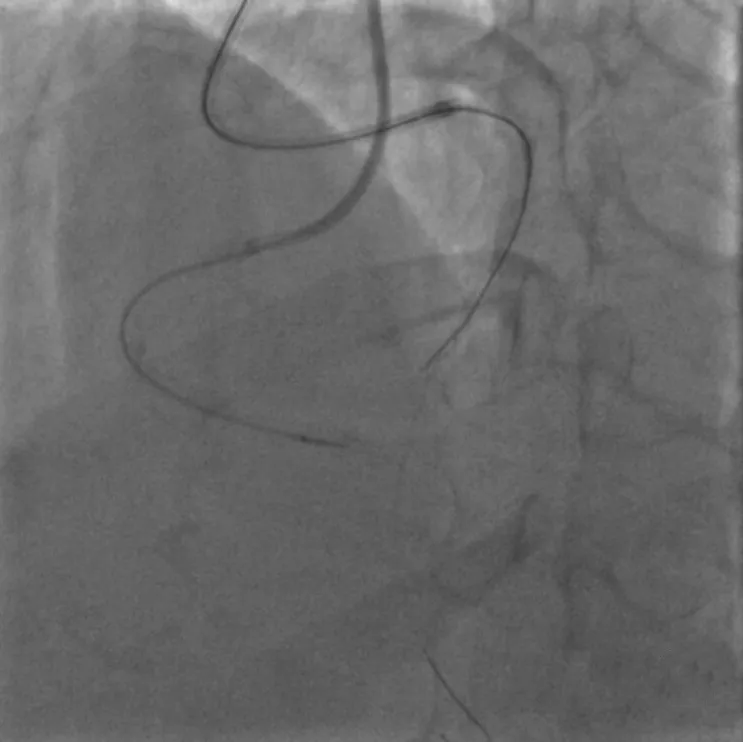
图4 Stingray-LP 球 囊 辅 助 下GAIA Third 导丝穿刺
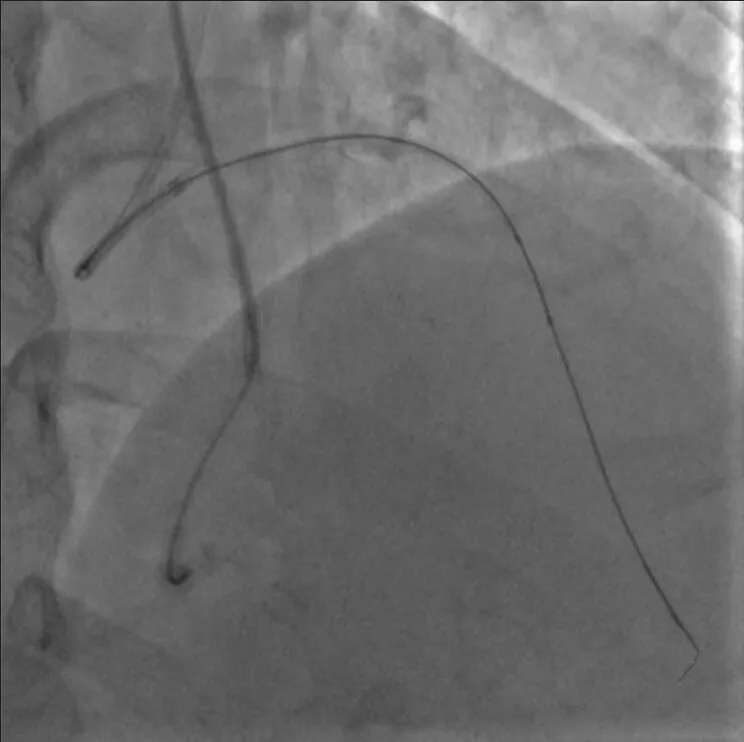
图5 GAIA Third 进入远端真腔后使用mini TREK 2.0 mm×15 mm 球囊扩张
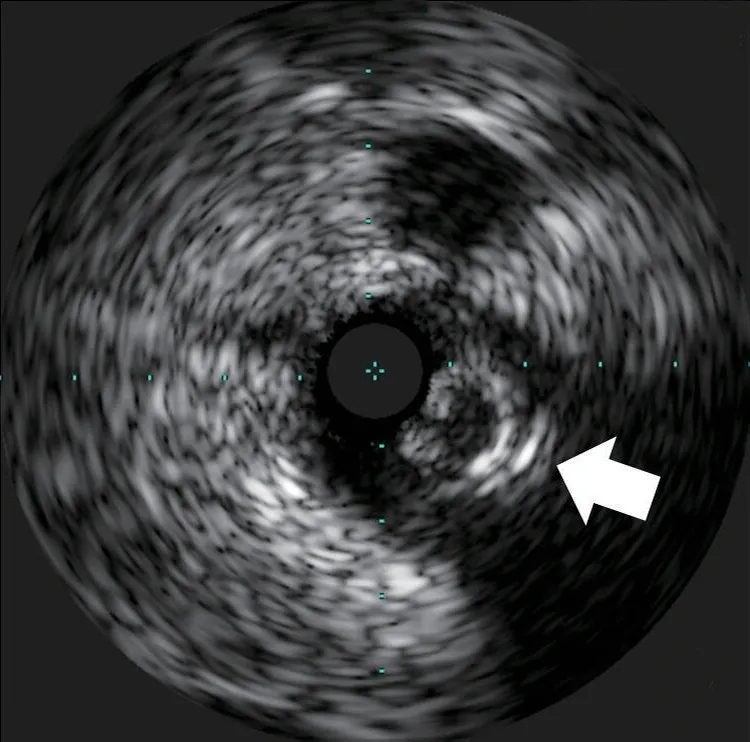
图6 血管内超声显示左前降支360°环形钙化(箭头所示)
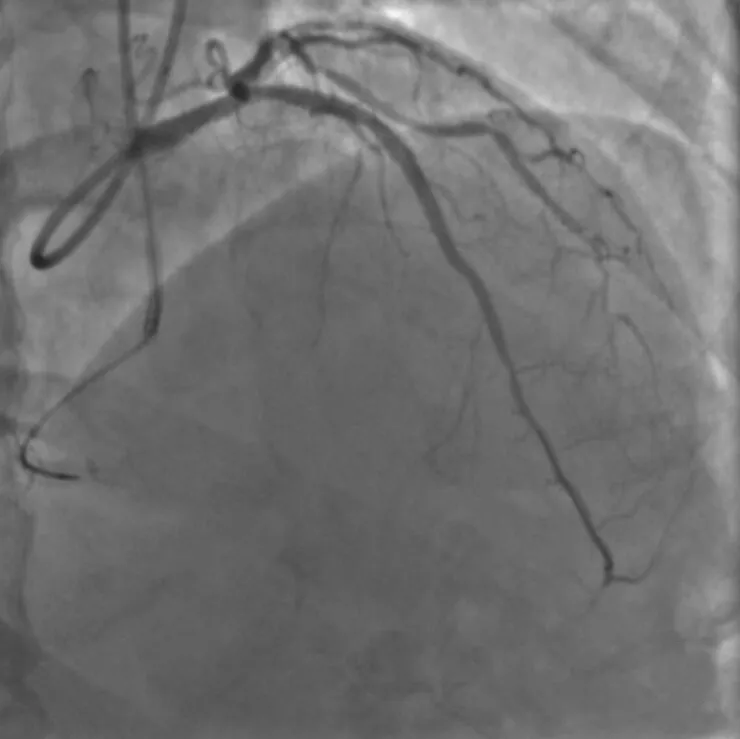
图7 复查血管内超声提示支架贴壁、膨胀良好
2 讨论
流行病学资料显示,冠状动脉钙化的发生率随年龄增加而增加,在40~49岁人群中的发生率为50%,在60~69岁人群中的发生率为80%[1]。根据钙化部位不同,可将冠状动脉钙化分为内膜钙化和外膜钙化。其中,冠状动脉内膜钙化会显著增加介入治疗难度及风险。
冠状动脉慢性完全闭塞(chronic total occlusion,CTO)病变是目前冠状动脉介入治疗中最大的挑战,如合并严重内膜钙化,会造成导丝、球囊、微导管、支架等器械通过困难,介入治疗成功率大幅下降[2]。导引导丝能否通过CTO病变是介入治疗的关键环节,对于合并严重钙化病变,时常出现导丝通过后球囊无法通过的情况,通常的解决方法有:小球囊扩张、大球囊近端高压力扩张、增加指引导管支撑力、多导丝松解斑块、Tornus微导管扩张、小球囊主动破裂技术、斑块销蚀(旋磨、准分子激光)、逆向导丝通过后导丝体外化等,术者可以根据不同病变特点尝试使用一种或多种技术,大部分情况下,可以完成球囊预扩张,并最终置入支架。除以上常用的技术外,还有一种极端情况下可以尝试的方法,即内膜下通过技术,该方法需要将导引导丝在严重钙化处送入内膜下,避开内膜钙化,在钙化病变远端调整导丝重新进入血管真腔。使用绕行钙化经内膜下通过技术,仅推荐冠状动脉CTO病变介入治疗经验丰富的术者应用,该操作具有一定风险和难度,其难点主要在于如何将进入内膜下的导丝重新送入远段真腔内。
正向内膜下重回真腔技术(antegrade dissection reentry,ADR)指操控进入内膜下的导丝重入真腔,以开通CTO病变。近年通过应用CrossBoss导管及Stingray球囊的BridgePoint系统(BridgePoint Medical System,Plymouth,Minnesota),大大提高了正向开通CTO病变的效率及成功率[3-6]。既往在冠状动脉CTO病变介入治疗中,导丝进入内膜下常常导致手术失败。近几年,随着ADR技术在国内推广开展,为导丝进入内膜下后重回真腔提供了良好的技术支持。但此技术相较于其他技术而言有较大难度及风险,导丝进入内膜下后会造成内膜下夹层及血肿形成,当导丝进入内膜下后应缓慢操控导丝前行,控制导丝在内膜下行进距离,通过对侧造影判断重回真腔着陆区(landing zone),尽可能缩短导丝位于内膜下的距离。ADR操作中血肿控制非常重要,也是决定能否成功穿刺重回真腔的关键步骤。控制血肿的常用方法为控制患者血压、球囊、微导管或延长导管封堵闭塞病变入口等。本病例中术者使用UB3导丝在闭塞近端缓慢操作,当导丝头端阻力明显下降时,通过不同体位连续旋转透视确认导丝与左前降支内导丝并行,并通过对侧造影确认导丝走行于血管内膜下,立即缓慢跟进微导管至闭塞段内,封闭内膜下通道入口,血肿控制良好是手术成功的关键。
对于本病例,也可尝试直接交换旋磨导丝后进行冠状动脉旋磨术,但是CTO病变冠状动脉旋磨成功率约为90%[7-8],无法操控旋磨导丝直接通过病变是其主要失败原因。与冠状动脉旋磨不同,准分子激光冠状动脉消融术(excimer laser coronary atherectomy,ELCA)不需要交换已通过CTO病变导丝,可沿该导丝将激光消融导管送到病变处进行消融,从而提高后续器械通过率[9]。大多数情况下,可以单独使用激光消融,即推送激光消融导管全程或部分通过病变,从而辅助后续器械通过,但仍有少部分病例需要使用ELCA联合旋磨治疗,在激光消融闭塞病变近端纤维帽后,可提高旋磨导丝交换成功率,因此,有学者将其命名为“Raser”技术[10-12]。本病例在球囊无法通过时也可以首先尝试旋磨或ELCA。但是,上述两种操作需要使用费用昂贵的设备,国内目前仅有部分大型医院具有相应条件,且仅有极少数医师具有相关操作经验。在无法使用旋磨及ELCA的情况下,使用绕行钙化病变技术,一方面是因为术者具有大量CTO病变介入治疗经验,且已良好掌握Stingray球囊辅助ADR技术;另一方面则出于减少患者再次手术产生额外费用的考虑。
为提高类似病例手术成功率及远期效果,在介入治疗中应注意以下几个问题:(1)尽量使用Stingray球囊辅助完成ADR,切勿盲目在内膜下反复操控导丝尝试直接使用导丝重回远端真腔,在导丝进入内膜下,确认导丝位于血管结构内后,应尽早果断启动ADR,降低内膜下血肿扩大风险,提高导丝穿刺重回真腔成功率;(2)尽量缩短导丝内膜下行进距离,着陆区虽应选取钙化病变远段相对正常冠状动脉节段,但目前对于有经验术者,亦可选择斑块内穿刺,失败后,再逐步向远端调整穿刺点,尽量缩短内膜下置入支架长度。
使用绕行钙化技术开通冠状动脉CTO病变国内外鲜有报道。对于球囊、旋磨导丝无法通过病变情况下,对于有丰富CTO病变介入治疗及Stingray辅助ADR操作经验的术者,可以尝试应用该方法提高介入治疗成功率。
利益冲突 所有作者均声明不存在利益冲突

