植物乳杆菌HCS03-001安全性评价及其益生特性分析
矫艳平,余 萍,赵 迪,张春宇,宋 佳,汤 纯,曹 蓝
(江西仁仁健康产业有限公司,江西樟树 331200)
近年来,人们越来越意识到肠道微生态对人体健康的重要性,益生菌作为定植于肠道内并对人体健康有益的活性微生物,被广泛应用于各种发酵食品、功能性食品、药品及膳食补充剂等。益生乳酸菌即发酵糖类产生乳酸的益生菌,在食品应用中未发现过严重的不良反应,普遍认为乳酸菌的应用是安全的[1]。然而,陆续有研究表示从败血症、心内膜炎、急性胰腺炎和尿路感染患者体内分离出了乳酸菌,还有关于摄入乳酸菌引起局部或全身感染的报道,使乳酸菌的安全性进入人们关注的视野,并将其作为乳酸菌应用的前提条件[2−3]。
植物乳杆菌(Lactobacillus plantarum)是一类存在于人体肠道内并发挥益生作用的革兰氏阳性益生菌群[4]。大量研究表明,植物乳杆菌具有调节免疫功能[5−6]、调节血糖、血脂和血压平衡[7−11]、抑制胃肠道致病菌感染[12−15]、调节肠道功能[16−18]、调节神经功能[19−20]等作用,其作为乳酸菌的一种,其安全性被高度认可,并应用于多种食品、饲料、医疗保健等领域[21]。植物乳杆菌发挥益生作用的基础是其能够耐受胃酸环境和十二指肠的高胆盐环境,摄入后能够以活菌状态到达小肠和大肠,继而发挥益生功能[22]。
分离自哺乳婴儿肠道及母乳中的人源性益生菌株更能够在人体肠道内存活[23]。本研究对从婴儿粪便样品中筛选出的植物乳杆菌HCS03-001的安全性进行了评价,并测定其对酸和胆盐的耐受能力,为其进一步应用提供研究基础。
1 材料与方法
1.1 材料与仪器
植物乳杆菌HCS03-001 分离自顺产健康8月龄女婴粪便样品,保存于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.16258;清洁级昆明种(KM)小鼠(18~22 g) 沈阳艾克赛斯生物科技有限公司(许可证号:NO.SCXK(辽)2020—0001);块状鼠料 辽宁长生生物技术有限公司;哥伦比亚血琼脂平板 无锡赛维商务有限公司;盐酸洛哌丁胺 西安杨森制药有限公司;肺炎链球菌ATCC49619 上海复祥生物科技有限公司;英诺克李斯特氏菌CICC 10417、金黄色葡萄球菌CICC 10473 中国工业微生物菌种保藏管理中心;梅里埃E-Test药敏试条 北京兰伯瑞生物技术有限责任公司;胆盐(HPLC级SIGMA) 西格玛奥德里奇(上海)贸易有限公司;鼠伤寒沙门氏菌ATCC14028、福氏志贺氏菌CMCC(B)51572、单增李斯特菌ATCC19115
上海鲁微科技有限公司;牙龈卟啉单胞菌ATCC 33277 中国普通微生物菌种保藏管理中心;白色念珠菌ATCC10231 青岛高科技工业园海博生物技术有限公司;大肠埃希氏菌ATCC25922、金黄色葡萄球菌ATCC12598、变异链球菌GIM1.530 广东省微生物菌种保藏中心;盐酸洛哌丁胺胶囊(含盐酸洛哌丁胺2 mg/粒) 西安杨森制药有限公司;植物乳杆菌HCS03-001培养基:酵母蛋白胨10 g/L,酵母浸出物5 g/L,葡萄糖20 g/L,柠檬酸5 g/L,乙酸钠5 g/L,磷酸二氢钾2 g/L,硫酸镁0.5 g/L,硫酸锰0.08 g/L,吐温80 0.6 g/L,余量为纯化水,pH6.60,115 ℃灭菌30 min。
SW-CJ-2D双人单面净化工作台 苏州净化设备有限公司;DHP-500BS电热恒温培养箱 北京市永光明医疗仪器厂;LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;XSP-10CA生物显微镜
上海佑科仪器仪表有限公司;DZKW-S-8电热恒温水浴锅 北京市永光明医疗仪器有限公司;TGL-16M低温高速离心机 湖南湘仪实验室仪器开发有限公司;FiveEasy Plus型pH计 梅特勒-托利多仪器(上海)有限公司;MHY-28473麦氏浊度计 北京美华科技有限公司。
1.2 实验方法
1.2.1 菌种活化 将植物乳杆菌HCS03-001菌种冻存管置37 ℃水浴锅中使其迅速溶化,取100 μL菌液加入10 mL植物乳杆菌HCS03-001液体培养基中,37 ℃培养16 h后扩大培养至100 mL,放4 ℃备用。
1.2.2 溶血试验 将已活化好的HCS03-001菌株菌悬液接种点样于哥伦比亚血琼脂平皿中,在同一平皿中接种点样阴性对照菌英诺克李斯特氏菌CICC 10417和阳性对照菌金黄色葡萄球菌CICC 10473,37 ℃培养48 h,观察平皿中菌落周围有无溶血圈出现并拍照记录。
1.2.3 耐药性试验 采用E试验法对植物乳杆菌HCS03-001进行耐药性评价。挑取纯化后的植物乳杆菌HCS03-001菌落接种至MRS培养基,并于35 ℃培养至浊度达到0.5麦氏单位以上,用生理盐水调节菌液浓度至0.5麦氏单位。用无菌棉沾取菌悬液涂布于90 mm的MRS琼脂平板表面,反复涂布3次,每次旋转平板60°,室温下静置5 min,用无菌镊子夹取E-test试条紧贴于MRS琼脂培养基表面,15 min后将平板置5%二氧化碳环境孵育24~48 h后读取抑菌圈边缘与E-test药敏条相交处的MIC值。以肺炎链球菌ATCC49619为质控菌株,药物敏感性结果依据CLSI M45-A3(2015)标准执行,判定标准见表1。
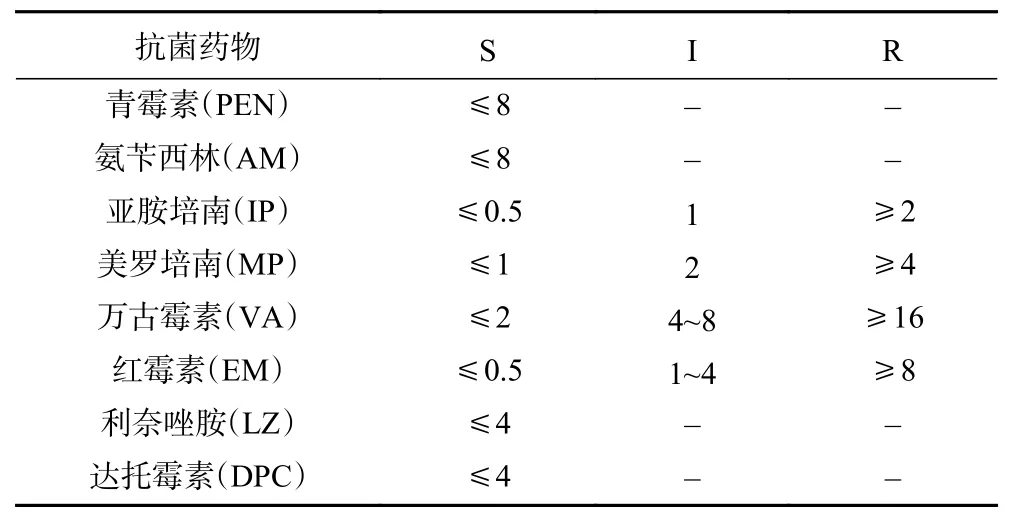
表1 乳杆菌属药敏试验判定标准(μg/mL)Table 1 Criteria for antimicrobial susceptibility test of Lactobacillus (μg/mL)
1.2.4 急性经口毒性试验 按照GB15193.3-2014限量法评价植物乳杆菌HCS03-001对小鼠的经口急性毒性。将20只实验小鼠分为雌性组和雄性组。实验环境设置为温度22±1.5 ℃,湿度50%±10%,工作照度160~280 Lux,噪音<60 dB,给予鼠粮和纯净水,适应环境3 d后进行实验。实验前小鼠禁食不禁水6 h。将植物乳杆菌HCS03-001菌粉(1×1011CFU/g,菌粉基质为麦芽糊精)按照15 g/kg的剂量,20 mL/kg的灌胃体积,灌胃小鼠一次,灌胃后观察14 d,记录中毒症状及死亡情况。
1.2.5 耐酸性试验 用1 mol/L盐酸将MRS培养基pH调成2.0和3.0,115 ℃高压蒸汽灭菌30 min,冷却备用。将活化后的植物乳杆菌HCS03-001菌液以10%(V/V)的接种量分别接种于pH3.0、pH2.0的MRS培养基中。37 ℃恒温静置培养,于0、1、2、3 h用灭菌的生理盐水进行10倍系列稀释,分别取适宜稀释度的菌液1000 μL移入无菌空平皿中,将冷却至48 ℃的MRS琼脂培养基倾注入平皿约15 mL,转动平皿使其混合均匀。每个稀释度3次重复,37 ℃静置培养48 h后计数。耐酸试验存活率计算公式(1)如下:
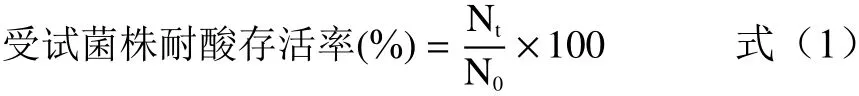
式中:Nt为1、2、3 h测得的活菌数,lg CFU/mL;N0为0 h测得的活菌数,lg CFU/mL。
1.2.6 耐胆盐试验 在MRS培养基中加入牛胆盐,配制胆盐质量浓度分别为0.3、0.5、1.0、1.5 g/L的MRS培养基,115 ℃高压蒸汽灭菌30 min,冷却备用。将活化后的植物乳杆菌HCS03-001菌液按照10%(V/V)的接种量分别接种于上述培养基中,37 ℃恒温静置培养,于0、1、2、3 h用灭菌的生理盐水进行系列10倍稀释,分别取适宜稀释度的菌液1000 μL移入无菌空平皿中,将冷却至48 ℃的MRS琼脂培养基倾注入平皿约15 mL,转动平皿使其混合均匀。每个稀释度3次重复,37 ℃静置培养48 h后计数。耐胆盐试验菌株存活率计算方法见公式(2)。

式中:N1为1、2、3 h测得的活菌数,lg CFU/mL;N0为0 h测得的活菌数,lg CFU/mL。
1.2.7 抑菌功能特性试验 试验以大肠杆菌ATCC 25922、金黄色葡萄球菌ATCC12598、鼠伤寒沙门氏菌ATCC14028、志贺氏菌CMCC(B)51572、单增李斯特菌ATCC19115、白色念珠菌ATCC10231、牙龈卟啉单胞菌ATCC33277、变异链球菌GIM 1.530为指示菌,采用牛津杯法[24]测定HCS03-001代谢产物的抑菌性。
1.2.7.1 植物乳杆菌HCS03-001发酵液浓缩 取一菌株冻存管在37 ℃水浴锅中使其迅速溶化,用微量移液器取10 μL菌液加入4.5 mL生理盐水中,逐级稀释至10-6,取稀释液50 μL涂布平板,37 ℃培养24~48 h,挑取单菌落于5 mL培养基中37 ℃培养20 h,5%接种量扩大培养至100 mL培养基中,37 ℃培养17 h后,10000 r/min离心10 min,取上清,加热100 ℃浓缩至5倍,放4 ℃备用。
1.2.7.2 抑菌圈直径测量 分别将指示菌加入到对应的液体培养基中进行活化并稀释菌液浓度为105CFU/mL,取菌悬液100 μL均匀涂布于培养基上。用镊子将无菌牛津杯竖于涂布有致病菌液的平皿中,牛津杯中加入200 μL活化后的植物乳杆菌HCS03-001浓缩上清液。将平皿置于37 ℃的恒温培养箱中,24 h后观察拍照,并用游标卡尺计量抑菌圈直径。
对应培养基:大肠杆菌ATCC25922、金黄色葡萄球菌ATCC12598:LB培养基;鼠伤寒沙门氏菌ATCC14028、志贺氏菌CMCC(B)51572:营养琼脂培养基;单增李斯特菌ATCC19115:TSA-YE培养基;白色念珠菌ATCC10231:SB培养基;牙龈卟啉单胞菌ATCC33277:TSA+5%脱纤维羊血;变异链球菌GIM1.530:BHI培养基。
1.2.8 小鼠通便功效试验
1.2.8.1 试剂和动物准备 试验选用清洁级昆明种(KM)小鼠40只,18~22 g,雄性。试验环境为清洁级动物实验室,温度22±1.5 ℃,湿度50%±10%,工作照度160~280 lx,噪音<60 dB。
盐酸洛哌丁胺混悬液的配制:取盐酸洛哌丁胺胶囊10粒或20粒,去除囊壳,将药粉加蒸馏水定容至100 mL配制成0.02%或0.04%的浓度。
墨汁配制方法:将阿拉伯胶5 g与40 mL蒸馏水混合煮沸至澄清透明,再与2.50 g活性炭粉混合均匀煮沸3 次,冷却,蒸馏水定容至50 mL,置于4℃冰箱保存备用。
1.2.8.2 小肠运动试验 经口灌胃给予造模药物盐酸洛哌丁胺,建立小鼠小肠便秘模型,计算一定时间内小肠的墨汁推进率,来判断小肠蠕动功能。以植物乳杆菌HCS03-001菌粉(1×1011CFU/g)为受试物,根据人体推荐量的10倍量将试验设置2个剂量组(受试物1.5 g/kg及3.0 g/kg)、一个空白对照组和一个模型对照组。将植物乳杆菌HCS03-001菌粉溶于蒸馏水中,每天灌胃一次,灌胃体积为10 mL/kg,模型对照组和空白对照组灌胃同体积蒸馏水,共给予21天后,剂量组和模型对照组给予0.02%的盐酸洛哌丁胺混悬液(盐酸洛哌丁胺5 mg/kg BW)造便秘模型,造模0.5 h后,各组小鼠均灌胃10 mL/kg墨汁,计时20 min后处死小鼠,解剖,测量小肠全长及自胃部下端幽门处到墨水运动前沿的距离,小肠推进率按公式(3)计算。
1.2.8.3 排便粒数、排便时间试验 经口灌胃给予造模药物盐酸洛哌丁胺,建立小鼠便秘模型,考察实验动物6 h内排黑便粒数与首次排黑便时间,来反映模型排便情况。以植物乳杆菌HCS03-001菌粉(1×1011CFU/g)为受试物,试验设置2个剂量组(受试物1.5 g/kg及3.0 g/kg)、一个模型对照组和一个空白对照组,将植物乳杆菌HCS03-001菌粉溶于蒸馏水中,每天灌胃一次,灌胃体积为10 mL/kg,模型对照组和空白对照组灌胃同体积蒸馏水,共给予8 d后,剂量组和模型对照组给予0.04%的盐酸洛哌丁胺混悬液(盐酸洛哌丁胺10 mg/kg BW)造便秘模型,造模0.5 h后,各组小鼠均灌胃10 mL/kg墨汁,开始记录首粒排黑便时间和6 h内排黑便粒数。
1.3 数据处理
每个试验重复3次平行测定,数据采用SPSS 19.0软件和Excel软件进行数据分析,当P<0.05时,差异被认为是有意义的,结果表示为平均值±标准差。
2 结果与分析
2.1 溶血性评价结果
测定乳酸菌溶血现象是评价乳酸菌安全性的一项重要指标。溶血试验结果如图1所示,将已活化好的HCS03-001菌株菌悬液、阴性对照菌英诺克李斯特氏菌CICC 10417和阳性对照菌金黄色葡萄球菌CICC 10473接种点样于哥伦比亚血琼脂平皿中,37 ℃培养48 h后,阳性对照菌金黄色葡萄球菌CICC 10473出现明显的透明圈,表现为溶血。植物乳杆菌HCS03-001与阴性对照菌英诺克李斯特氏菌CICC 10417结果一致,均无透明圈,即不溶血。说明植物乳杆菌HCS03-001在溶血性方面是安全的。
2.2 耐药性评价试验结果
益生菌中是否含有抗生素抗性基因,抗性基因是否会在肠道正常菌群与致病菌之间发生转移,已成为评价菌株安全性的一个重要方面[25]。植物乳杆菌HCS03-001耐药性实验结果见表2所示。植物乳杆菌HCS03-001对青霉素(PEN)、氨苄西林(AM)、亚胺培南(IP)、美罗培南(MP)、利奈唑胺(LZ)、达托霉素(DPC)敏感,对红霉素(EM)中敏,对万古霉素(VA)耐药。目前针对益生菌的耐药性质有认为其携带耐药基因并可能转移至宿主体内,还有观点认为这种耐受通常是自身内在染色体编码的,不具转移性[26]。众多关于乳酸菌研究均对一种或多种抗生素有耐受现象,其耐受原因及是否能够转移有待进一步研究。
2.3 急性经口毒性试验结果
植物乳杆菌HCS03-001急性经口毒性试验结果如表3所示。雌雄小鼠精神状况良好,观察期内体重保持增长,无中毒或死亡情况发生;解剖后未见心肝脾肺肾等内脏器官异常。根据《食品安全国家标准急性经口毒性试验》 GB15193.3-2014,植物乳杆菌HCS03-001的经口急性毒性耐受剂量大于15 g/kg,其LD50>15 g/kg。

表3 植物乳杆菌HCS03-001小鼠急性经口毒性试验结果Table 3 Acute oral toxicity test of Lactobacillus plantarum HCS03-001
2.4 菌株HCS03-001的耐酸试验结果
益生菌进入人体后主要在肠道内发挥有益作用,因此必须具有较强的耐受胃酸能力,才能以较高的存活性通过胃环境。人体在空腹时胃液pH为2.0以下,进食后pH能达到3.0左右[27]。因此试验选定pH3.0和pH2.0进行检验菌株HCS03-001的耐酸性能力,试验结果见表4。由表4可知,菌株HCS03-001在pH2.0和pH3.0、37 ℃条件下培养3 h,虽活菌数对数值较0 h时显著下降(P<0.05),但存活率存活率仍达92.33%和94.29%。说明该菌株对酸环境具有一定的耐受能力,其耐酸能力可能与菌株的双组分信号调节及酸环境下细胞膜组成变化、蛋白质和DNA的损伤修复等耐酸机制有关[28]。
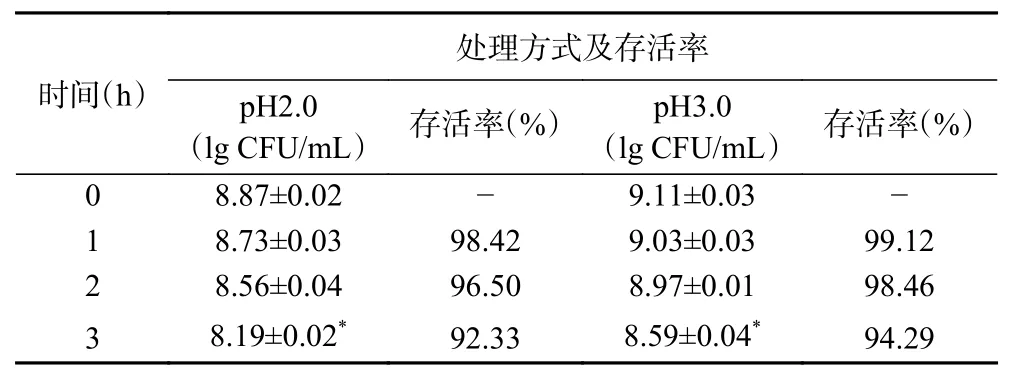
表4 菌株HCS03-001的耐酸试验结果(n=3)Table 4 Result of acid resistance tests of strain HCS03-001(n=3)
2.5 菌株HCS03-001的耐胆盐试验结果
益生菌能够在肠道内保持存活性,较强的胆汁的耐受能力是先决条件。菌株HCS03-001经0.3、0.5、1.0、1.5 g/L牛胆盐处理后的存活率见表5。随着牛胆盐含量的增加和处理时间的延长,菌株HCS03-001的存活率呈下降趋势,当牛胆盐含量达到1.5 g/L时,处理3 h后活菌数对数值较0 h虽显著下降(P<0.05),但存活率仍能达到88.82%,说明该菌株耐胆盐能力较强,有利于其在宿主肠道中的定植,其对胆盐的耐受能力可能是由于该菌株在生长繁殖过程中产生胆盐水解酶来降低胆盐对自身细胞的危害或其表层蛋白对细胞的保护作用等[29]。
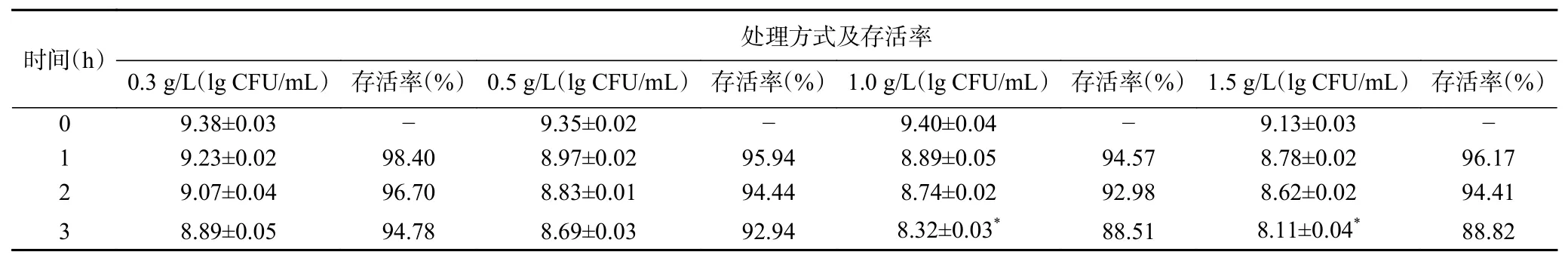
表5 菌株HCS03-001的耐胆盐试验结果(n=3)Table 5 Results of bile salt tolerance tests of strain HCS03-001(n=3)
2.6 抑菌功能性试验结果
乳酸菌能够产生有机酸、过氧化氢等代谢产物、分泌细菌素,具有抑制致病菌生长及减少腐败菌毒素产生的作用,因此抑菌功能是乳酸菌重要的益生特性[30]。试验选取大肠埃希氏菌、金黄色葡萄球菌、鼠伤寒沙门氏菌、福氏志贺氏菌、单增李斯特菌、牙龈卟啉单胞菌、变异链球菌为指示菌,结果见表6所示。植物乳杆菌HCS03-001发酵上清液对肠道致病菌及口腔致病菌(牙龈卟啉单胞菌和变异链球菌)均有一定程度的抑制作用,其中对变异链球菌的抑菌圈直径最大,显著高于其他菌株(P<0.05);对大肠埃希氏菌ATCC25922与金黄色葡萄球菌ATCC12598的抑菌圈直径与周钦育等[31]所测LGG抑菌圈直径接近。

表6 植物乳杆菌HCS03-001抑菌特性试验结果Table 6 Experimental results of antimicrobial properties of Lactobacillus plantarum HCS03-001
2.7 通便功效试验结果
2.7.1 小肠运动试验 经口灌胃给予造模药物盐酸洛哌丁胺,建立小鼠小肠便秘模型,给予植物乳杆菌HCS03-001灌胃21 d,试验结果见表7,与空白对照组(75.59%)相比,模型对照组小鼠的小肠墨汁推进率(32.38%)显著降低(P<0.05),说明小鼠便秘模型构建成功。与模型对照组相比,受试物在1.5和3.0 g/kg的剂量下,小鼠的小肠墨汁推进率均显著提高(P<0.05),分别为49.08%、52.05%,说明植物乳杆菌HCS03-001对盐酸洛哌丁胺造模的小鼠便秘模型有一定的通便效果。
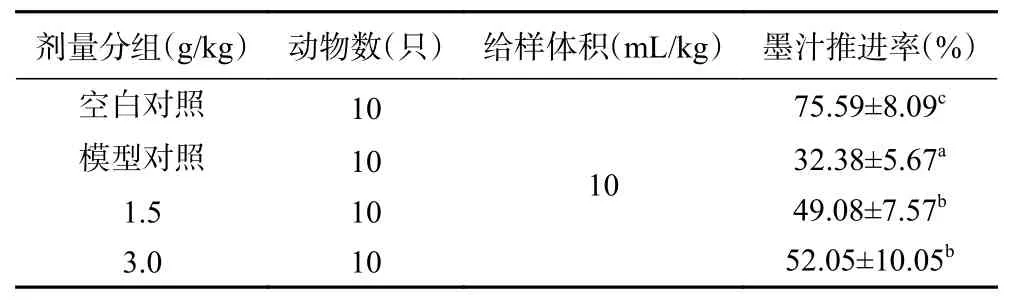
表7 小肠运动试验结果Table 7 Results of intestinal motility test
2.7.2 排便粒数、排便时间试验 经口灌胃给予造模药物盐酸洛哌丁胺,建立小鼠便秘模型,以植物乳杆菌HCS03-001为受试物,考察实验动物6 h内排黑便粒数与首次排黑便时间。试验结果见表8,与空白对照组相比,模型对照组的6 h内排黑便粒数显著降低(P<0.05),首次排黑便时间显著增加(P<0.05),说明小鼠便秘模型构建成功。经过服用受试物后,1.5和3.0 g/kg剂量组的6 h排黑便粒数显著高于模型对照组(P<0.05),首次排黑便时间显著短于模型对照组(P<0.05),说明植物乳杆菌HCS03-001对盐酸洛哌丁胺的便秘模型有较好的排便效果。
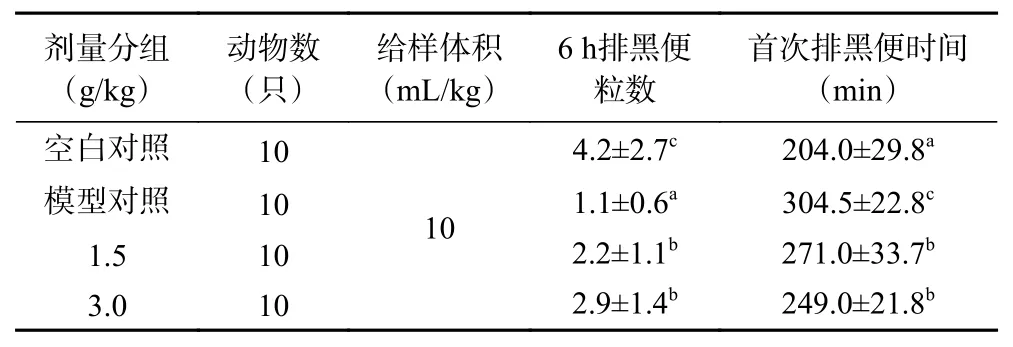
表8 排便粒数、排便时间试验结果Table 8 Defecation particle number and defecation time
3 结论
通过对植物乳杆菌(Lactobacillus plantarum)HCS03-001的安全性评价,该菌株在溶血性实验中表现为不溶血,无致病性;耐药实验中,对青霉素(PEN)、氨苄西林(AM)、亚胺培南(IP)、美罗培南(MP)、利奈唑胺(LZ)、达托霉素(DPC)敏感,对红霉素(EM)中敏,对万古霉素(VA)耐药;在急性经口毒性实验中,小鼠精神状况较好,进食稳定,各内脏器官无异常,无中毒情况发生。在益生特性评价试验中,该菌株对酸及胆盐环境的耐受性良好,对肠道主要革兰氏阳性与革兰氏阴性致病菌及口腔致病菌(牙龈卟啉单胞菌和变异链球菌)均有抑制作用,对小鼠的盐酸洛哌丁胺的便秘模型有较好的促排便效果。综上,植物乳杆菌(Lactobacillus plantarum)HCS03-001具有良好的安全性及益生特性,为进一步生产应用提供了理论基础。

