不同糖类对草鱼鱼糜凝胶的影响
阙 凤,高天麒,汪 超,熊光权,石 柳,吴文锦,乔 宇,丁安子,李 新,汪 兰,
(1.湖北工业大学生物工程与食品学院,湖北武汉 430068;2.湖北省农业科学院农产品加工与核农技术研究所,湖北省农业科技创新中心农产品加工研究分中心,湖北武汉 430064)
随着中国渔业经济的稳步发展,淡水鱼产量不断提高,鱼类产品加工业不断发展,对草鱼的需求不断增加。草鱼是中国传统的四大家鱼之一,是重要的淡水鱼品种,价格优、产量高及肉厚刺少等特点使其常作为鱼糜加工的主要原料之一[1]。鱼糜制品是鱼类深加工中的产品,大多为鱼糜凝胶,因其高蛋白、低胆固醇、低脂肪、口感鲜嫩、食用方便等特点,具有广阔的利用价值,越来越受到消费者的重视[2]。为了延长鱼糜制品货架期,最常用的方法是低温储存;然而,鱼肉蛋白质在冻藏过程中容易发生变性,导致鱼肉品质恶化,鱼肉蛋白质的保水性、可溶性和凝胶性等功能降低,将会影响鱼糜制品的味道和营养价值[3]。通常采用添加抗冻剂的方式防止鱼糜蛋白质冷冻变性,当前商用抗冻剂主要包括4%蔗糖和4%山梨糖醇的混合物(简称“商业抗冻剂”)。且在工业化生产的鱼糜中添加4%~8%的蔗糖作为冷冻保护剂,但是蔗糖的甜度和热量较高,不符合现代生活中人们对健康饮食的追求[4],关于开发低甜度、低热量抗冻剂的研究有待进一步深入。
葡聚糖是以葡萄糖为单糖组成的同型多糖,葡萄糖单元之间由糖苷键相连接,仅由D-葡萄糖组成,主链是α(1,6)键,也有α(1,4)或α(1,3)键的支链。它能够减少低密度脂蛋白含量,提高高密度脂蛋白的含量。海藻糖是由两个葡萄糖分子以α,α,1,1-糖苷键构成的非还原性糖,甜度是蔗糖的45%,性质稳定[5]。海藻糖能较好地防止蛋白质在冷冻、高温或干燥时变性,有效保护蛋白质分子的天然结构,使食品的风味和质地保持不变[6]。低聚果糖是由β-D-呋喃果糖苷酶作用于蔗糖,使蔗糖分子中的D-果糖以β-(2→1)糖苷链连接1~3个果糖而成的,属于果糖和葡萄糖构成的直链杂低聚糖,具有超强双歧因子和水溶性膳食纤维,有类似于糖或葡萄糖浆的功能,提供良好平衡的甜味特征[7],其甜度为蔗糖的30%~60%。低聚木糖是一种低分子量功能性多糖,由2~7个木糖分子和β-1,4糖苷键组成。苏赵等[8]的研究表明海藻糖能抑制草鱼鱼糜蛋白在冻藏过程中的变性,延缓鱼糜冻藏品质的下降。Chou等[9]的研究表明,添加低聚木糖,在低温条件下盐溶性蛋白质的稳定性和溶解性高于添加其他糖类或组合,推测低聚木糖可能会降低蛋白质疏水基团的暴露。Wang[10]指出鱼糜凝胶中添加魔芋葡甘露聚糖(KGM)会影响鱼糜凝胶的持水性、胶强度和变性。多糖是高分子量聚合物,广泛用于食品的增稠、成膜、凝胶等,多糖和蛋白质发生相互作用形成复合物,会改变蛋白质凝胶特性[11]。
本实验拟在鱼糜制品加工过程中分别添加4%葡聚糖、蔗糖、海藻糖、低聚果糖、低聚木糖,探讨其对草鱼鱼糜微观结构、蛋白质结构、水分分布、白度、凝胶质构特性等性质的影响,旨在为糖类抗冻剂在鱼糜制品加工中的应用奠定基础。
1 材料与方法
1.1 材料与仪器
新鲜草鱼(质量约4 kg) 购自白沙洲水产市场;葡聚糖(7000 Da)、蔗糖、海藻糖(378.33 Da)、低聚果糖(180.158 Da)、低聚木糖(300.28~1050.98 Da)、氯化钠、十二烷基硫酸钠、双缩脲试剂、标准牛血清蛋白 购自上海源叶生物科技有限公司;其他试剂均为分析纯。
PL602-L电子天平、AL104电子天平 梅特勒-托利多仪器(上海)有限公司;JJ-1精密增力电动搅拌器 国华电器有限公司;IKA均质机 广州东南科创科技有限公司;DHG-9078A电热恒温鼓风干燥箱上海精宏实验设备有限公司;GL-21M高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;CR-400/410色彩色差仪 美能达(中国)投资有限公司;Eclipse CI光学显微镜、NMI20-025V-I成像系统日本尼康公司;NMI20-025V-I核磁共振成像分析仪
苏州纽迈分析仪器股份有限公司;TA.XT 2i/50质构仪 英国Stable Micro Systems公司;VERTEX70傅里叶变换红外光谱仪 德国Bruker Optice公司。
1.2 实验方法
1.2.1 草鱼鱼糜凝胶的制备 将新鲜草鱼带冰水于30 min内活运至实验室,于4 ℃冷库宰杀,去鱼鳞、内脏,清洗干净后取草鱼背部肉,去除可见的红色肉、结缔组织等,切碎用斩拌机低速(5挡)斩拌5 min,将粉碎后的草鱼肉用五倍体积的冷水和0.5%NaCl溶液冲洗,然后将碎肉通过四层300目纱布过滤,脱水2次以获得鱼糜,处理过程中温度保持在10 ℃以下(冷库中进行)。称取一定质量的鱼糜,用斩拌机低速(5档)斩拌1 min,分别加入鱼糜质量2%的NaCl和4%的糖类,将混合物的水分含量调整至78%,高速(9档)斩拌5 min后装入裱花袋,挤压灌入肠衣,两端封口,控制其长度和直径分别为15 cm和3 cm。将制好的鱼肠于90 ℃恒温水浴锅中加热30 min,然后置于冰水中冷却15 min,于4 ℃冰箱中冷藏过夜,次日取出测定相关指标。以不添加糖的鱼糜凝胶为空白对照[12]。
1.2.2 微观结构 将鱼糜凝胶用软刀片切成2.5 mm×2.5 mm×2.5 mm的小块置于1.5 mL的离心管中,加入2倍体积的2.5%的戊二醛,置于4 ℃冰箱放置2~24 h;用0.1 mol/L PBS缓冲溶液(pH7.0)洗涤3次,每次浸泡10~15 min;用不同浓度乙醇(30%、50%、70%、90%、100%)进行梯度洗脱,每次浸泡10~15 min;100%的乙酸异戊酯洗脱一次浸泡5~10 min,重新更换乙酸异戊酯浸泡样品,存放于4 ℃冰箱。将样品冷冻干燥后用导电胶固定在样品台上,样品表面真空喷金,用扫描电镜观察,加速电压为20 kV[13]。
1.2.3 傅里叶红外光谱分析 取适量添加不同糖的草鱼鱼糜冻干样品置于检测器上,程序参数:扫描范围4000~400 cm−1,分辨率4 cm−1,扫描频率10 kHz[14]。
1.2.4 低场核磁共振测定样品水分分布 参考李银等[15]的方法并加以修改,使用NMI20-025V-I核磁共振分析及成像系统测定样品水分与组织结合程度和水分分布情况。将鱼糜凝胶切成18 mm×18 mm×20 mm的长方体,在磁共振成像仪上通过多自旋回波(MSE)成像序列获得凝胶的质子密度成像。重复时间为1500 ms,回波时间为18.2 ms,中心频率为23.319 MHz。凝胶成像层面为4,每层厚度为2.0 mm。
1.2.5 白度的测定 参考胡亚芹等[16]的方法,用色度仪测定并记录L*(明亮度)、a*(红绿偏差)和b*(黄蓝偏差)值,每个样品测量平行10次。白度按下列公式计算:

1.2.6 质地剖面分析TPA(Texture profile analysis)测定 参考王蒙娜等[17]的方法,使用配备有探针P/36R的质构分析仪进行鱼糜凝胶的质构图分析(TPA)。将凝胶样品切成厚度为2 cm圆柱体,在40%的压缩度下压缩,测试前和测试后的速度设定为2 mm/s,测试速度为1 mm/s以获得TPA参数(硬度、弹性、粘结性、咀嚼性和回复性)。使用5.0 g触发力,触发类型为auto。
1.3 数据处理
所有实验均重复3次,所得数据均采用Microsoft Excel 2019,Origin-2017及Graph Pad Prism 5软件进行统计处理及绘图。
2 结果与分析
2.1 不同糖类对草鱼鱼糜凝胶微观结构的影响
图1所显示的分别为空白对照和添加4%的葡聚糖、蔗糖、海藻糖、低聚果糖、低聚木糖的草鱼鱼糜凝胶在扫描电镜下的微观结构。从图中可以看出空白对照组鱼糜凝胶网络组织结构较疏松,孔洞较大(图1A);添加葡聚糖、蔗糖的鱼糜样品形成了更紧密的凝胶三维网络结构,孔洞较小且分布相对均匀(图1B,图1C);添加海藻糖的鱼糜凝胶较致密,其表面存在较多大小不一的孔洞(图1D);添加低聚果糖的鱼糜凝胶切面凹凸不平(图1E);添加低聚木糖的鱼糜凝胶分布较均匀,但表面比较疏松出现了空隙,孔洞较大(图1F)。多糖分子结构特殊,与鱼糜凝胶肌原纤维蛋白结合相互作用会形成网络交织[11]。添加4%的多糖均有利于草鱼肌原纤维蛋白凝胶形成均匀致密的三维网络结构,且添加葡聚糖和蔗糖的效果最好,可能是糖作为填料填充了蛋白质网络之间的间隙,加强其结构[18]。含低聚果糖样品中无明显网络结构形成,推测与添加量有关,可能是因为低聚果糖聚合度较小(图1E)。精细而有序的凝胶网络更有可能吸收水[19],使得鱼糜凝胶网络中的破裂太严重而不能形成连续相[7];不同种类多糖对鱼糜凝胶微观结构的影响不同,这很可能与糖类自身凝胶形成能力有关。不同种类糖在最适添加量下的鱼糜凝胶的致密程度、孔洞大小以及分布存在一定的差异性[20]。

图1 不同糖类对鱼糜凝胶的微观扫描电镜图(2000×)Fig.1 Electron micrograph of microscopic scanning of surimi gel with different carbohydrates (2000×)
2.2 不同糖类对草鱼鱼糜凝胶蛋白的FITR测定结果及分析
红外光谱中酰胺Ⅰ带和酰胺Ⅲ带可用于定量分析蛋白质二级结构含量,其中酰胺Ⅰ带信号强,但酰胺Ⅰ带结构中有水振动带的强干扰和相对非结构化的光谱轮廓等限制[21]。因此,本文采用红外光谱中酰胺Ⅲ带(1220~1330 cm−1)分析鱼糜凝胶蛋白质二级结构,如图2B所示。α-螺旋和β-折叠为肌原纤维蛋白主要的二级结构,空白组、添加蔗糖、海藻糖、低聚果糖、低聚木糖和葡聚糖的鱼糜凝胶α-螺旋结构相对含量分别为39.26%、36.99%、35.7%、37.51%、42.85%和39.6%,β-折叠含量为19%~30%。添加低聚木糖样品中α-螺旋的含量最高为42.85%,葡聚糖样品中β-转角含量最高为22.23%,海藻糖样品二级结构中无规则卷曲含量最高为20.87%。与空白相比,添加蔗糖、海藻糖和低聚果糖鱼糜凝胶中α-螺旋结构占比下降。Zhuang等[22]报道添加魔芋葡甘低聚糖会使猪肉肌原纤维蛋白中α-螺旋含量减少,β-折叠含量增加。Hong等[23]也表明树胶促进了鱼糜蛋白的α-螺旋转化为其他结构。添加不同低分子糖类的鱼糜凝胶二级结构不一样,这可能是由于糖的分子组成及糖苷键不一样,与鱼糜蛋白质形成凝胶过程中相互作用有差异。

图2 不同糖类对鱼糜凝胶蛋白的FTIR分析Fig.2 FTIR analysis of different carbohydrates on surimi gel protein
2.3 不同糖类对草鱼鱼糜凝胶水分子分布的影响
MRI是利用磁场和射频脉冲使样品中的氢核振动发出射频信号,然后经计算机处理后成像的一种技术,通过该技术可以获得肌肉中水分的高分辨率MRI成像[24]。质子密度图像可以直观地观察样品中水的空间分布[25],核磁共振成像还可以突出样品中水的不同相的信号,若信号值强显红色,无信号值显蓝色,同时其质子密度越高,MRI图像中亮度越强,样品中水分含量越高[26]。常用低信号强度(暗或蓝色区域)是反映与大分子相关的结合水或不动水,而高信号强度(亮或红色)则表示自由的水[27]。由图3A可知,在空白样品、添加蔗糖和海藻糖的鱼糜凝胶核磁成像为亮绿色,添加低聚木糖和葡聚糖的鱼糜凝胶为蓝色,低聚果糖介于两者之间;部分图片中能观察到少量橙色光点,提示有水分子分布不均匀的现象。图3B为草鱼鱼糜凝胶横向弛豫时间T2分布,可以明显观察到T22和T23两个峰。根据水分子与组分结合的紧密情况,一般将横向弛豫时间在0~10 ms水分子定义为结合水(T21),这部分水与蛋白质结合紧密;横向弛豫时间在10~100 ms的水分子定义不可移动水(T22),这部分水位于肌原纤维蛋白凝胶结构之中;横向弛豫时间大于100 ms的水分子定义为自由水(T23),可以自由运动,这部分水在凝胶结构外[18]。显然,鱼糜凝胶的T21和T23较小,表明具有更强的结合水和限制水分子自由运动的能力[18]。与对照组相比,5种多糖的添加均减缓了鱼糜凝胶的水分迁移。如表1所示,与空白鱼糜凝胶相比,添加蔗糖的鱼糜凝胶,T22显著升高,T23显著降低(P<0.05);添加葡聚糖、海藻糖、低聚果糖、低聚木糖均增加了鱼糜凝胶的T21和T22,说明这几类糖的添加会降低鱼糜凝胶的水分子运动性,这可能是自由水转移至不可移动水中,水的流动性降低所导致。除蔗糖外,所有糖均增加了鱼糜凝胶中结合水(P21),但降低了鱼糜凝胶自由水(T23)所占比例P23,说明在鱼糜中添加糖促进了水与蛋白质更紧密的结合,而且限制水分子从不可移动水转变为自由水。不同种类的糖最适添加量有所不同,添加量不足或过量均会引起蛋白质分子聚集[28],当蛋白质高速聚集时,鱼糜凝胶形成具有不均匀和大孔的网络结构[29],可能影响到凝胶中水分子的运动性。

图3 糖类对鱼糜凝胶核磁共振成像伪彩图和水分分布的影响Fig.3 Effect of various carbohydrates on surimi gel MRI pseudo-color image and water distribution
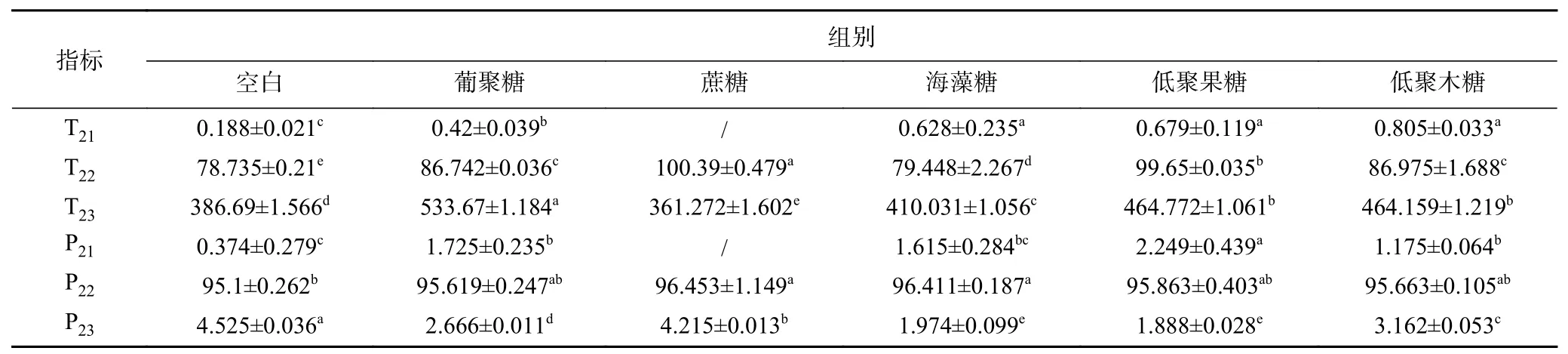
表1 不同糖类对鱼糜凝胶水分分布的影响Table 1 Effect of different carbohydrates on the water distribution of surimi gel
2.4 不同糖类对草鱼鱼糜外观形态、质构凝胶特性和白度的影响
质构和白度是衡量鱼糜品质的重要指标[30]。添加不同种类糖的草鱼鱼糜白度如图4A及表2所示,添加5种糖均不会对鱼糜凝胶样品的外观色泽造成影响。图1B为不同种类糖溶液,其中低聚木糖糖溶液偏黄,葡聚糖糖溶液呈淡黄色。Duangmal等[31]和Gao等[32]发现鱼糜凝胶的颜色特征主要取决于添加剂的类型。低聚木糖溶液呈黄色,降低了鱼糜凝胶白度。添加蔗糖、海藻糖、低聚果糖、葡聚糖可在一定程度上增加凝胶的白度(P<0.05)。如表2所示,添加5种糖的鱼糜凝胶硬度和咀嚼性显著降低(P<0.05),弹性和胶黏性无明显变化,多糖的加入会减小鱼糜发生形变时所产生的应力。其中低聚果糖样品的硬度、弹性和咀嚼性最低,这可能是因为低聚果糖水分活度较高、粘度较大,硬度降低,而对弹性的影响不大(P>0.05)。添加葡聚糖样品的回复性最低,为0.373±0.006,推测这可能与糖的分子量有关。若干研究报告称,肉类产品的凝胶强度或弹性降低可能会导致咀嚼性或胶黏性下降[18,33],而Cardoso等[34]的研究则持相反的结果。这些差异取决于所用肉和添加剂的类型。
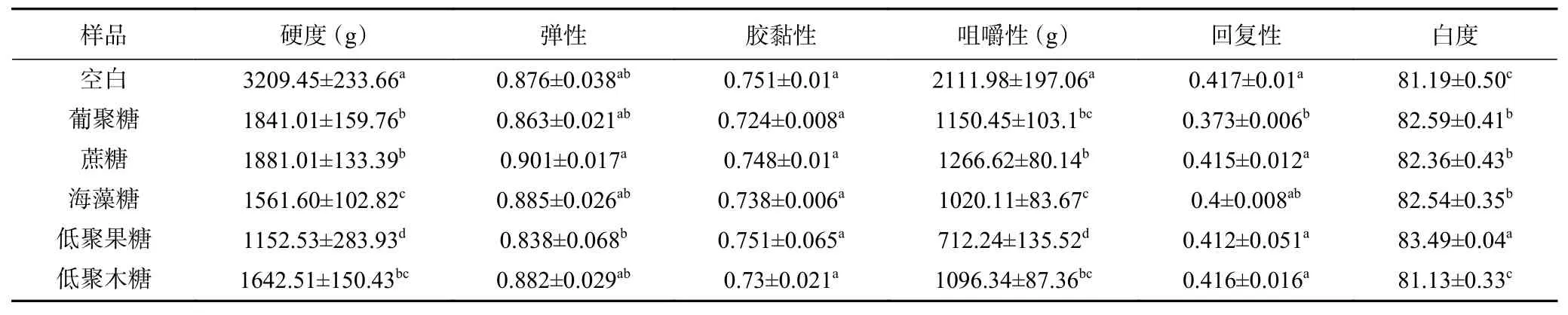
表2 不同糖类对鱼糜凝胶质构特性和白度的影响Table 2 Effects of different carbohydrates on the texture properties and whiteness of surimi gel
2.5 不同糖类对草鱼鱼糜凝胶特性及二级结构的相关性分析
由表3可知,添加糖后的鱼糜凝胶咀嚼性与硬度极显著相关(P<0.01),β-折叠与其回复性显著正相关(P<0.05),无规则卷曲与硬度、咀嚼性、白度之间显著相关(P<0.05),无序结构与弹性呈显著正相关(P<0.05)。鱼糜凝胶的二级结构与质构特性有关,推测可能是因为部分糖替代蛋白质,蛋白分子间相互交联,与Zhang等[35]报道结果一致,α-螺旋减少,无规则卷曲结构增加,蛋白质结构变化,鱼糜凝胶的咀嚼性和回复性下降。由于形状不规则,无规则卷曲和β-转角结构的相对含量不利于有序凝胶网络结构的形成[36]。Zhuang等[22]也表示鱼糜凝胶强度与α-螺旋转换为其他类型的二级结构有关。
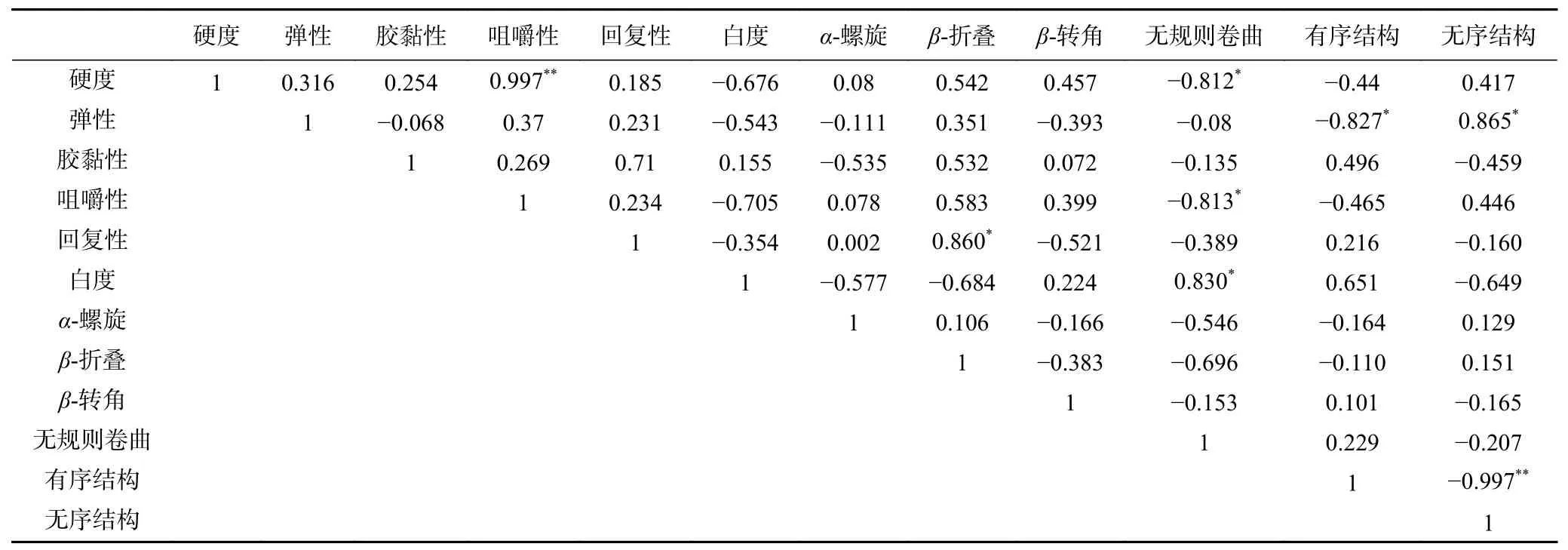
表3 添加不同种类糖对鱼糜凝胶特性各指标的相关性分析Table 3 Correlation analysis of various indexes of surimi gel properties by adding different kinds of carbohydrates
3 结论
本文主要探究了添加葡聚糖、蔗糖、海藻糖、低聚果糖和低聚木糖等不同糖对草鱼鱼糜凝胶特性的影响。添加4%葡聚糖、蔗糖和海藻糖可以促进致密有序的凝胶网络形成。糖的分子组成不同,与蛋白质交联形成网络结构有所差异,对肌原纤维蛋白的二级结构作用不同,无序结构多,鱼糜凝胶弹性较好。糖的添加会使鱼糜凝胶中的自由水转变为不可移动水和结合水。添加葡聚糖、蔗糖、海藻糖和低聚果糖可在一定程度上提高草鱼鱼糜凝胶的白度,但是降低了鱼糜凝胶的质构凝胶特性,5种糖均导致草鱼鱼糜凝胶的硬度和咀嚼性显著下降,说明糖与鱼糜凝胶蛋白质之间可能结合发生相互作用,进而改变了鱼糜凝胶的质构。

