辣木籽抗氧化肽的分离鉴定及其稳定性分析
郭其洪,李兴丽,范江平,王雪峰
(云南农业大学食品科学技术学院,云南昆明 650201)
辣木(Moringa oleifera)属于热带落叶乔木,广泛种植于热带和亚热带地区,在我国云南、广西、台湾等地区均有大面积种植[1]。辣木籽含有丰富的脂质和蛋白质[2],其中不饱和脂肪酸含量高达脂质的80%[3],且蛋白质、氨基酸的含量均高于FAO/WHO的推荐标准[4]。研究发现,辣木籽中还含有多种生理活性物质,如:抗氧化肽、ACE抑制肽、黄酮等,具有延缓机体衰老、降低人体血压、控制血糖、杀菌消炎等功能[5];此外,辣木籽中还含有的维生素D、微量元素(锌、铁、碘)等人体生长、发育必须的营养元素[6−7]。
多肽是由2个及以上的α-氨基酸以不同的排列顺序并以肽键为连接点连接而成的化合物的总称[8]。抗氧化多肽因性质稳定、具有抗菌、抗氧化作用而表现出诸多生理活性[9−10]。隋晓等[11]综述了芝麻活性肽类,具有抑菌、抗氧化及金属螯合作用,展现了其较好的应用前景。然而在实际生产加工过程及应用过程中,肽类物质因受到氧化、水解、螯合等作用的影响而发生降解,不同的加工环境(pH、金属离子、加热)也会使多肽的结构发生变化,从而影响其抗氧化活性及功能[12]。所以,研究不同加工条件对肽活性的影响,对肽功能性食品的应用具有重要的价值。辣木籽多肽因含有高含量的缬氨酸、异亮氨酸、苯丙氨酸、组氨酸等也被报道具有一定的抗氧化、抗菌作用[13−14],但这些多肽的活性及结构也会受到加工条件的影响。刘华勇等[15]研究发现未经纯化的辣木籽抗氧化肽在加热条件下其活性会受到糖类物质的影响,美拉德反应会使辣木籽肽的活性增加。目前,虽然已有研究报道辣木多肽的功能活性,但大多都只是在研究粗多肽阶段,而没有深入进行分离纯化、鉴定及其稳定性分析。
因此,本研究以柱层析纯化后的辣木籽抗氧化肽为研究对象,旨在探究不同加工条件对其稳定性的影响,为提高辣木籽及其蛋白肽的利用率提供实验基础并为后续功能性多肽产品的开发利用提供参考。
1 材料与方法
1.1 材料与仪器
辣木籽 云南天佑科技开发有限公司,样品前处理后经粉碎过60目筛,备用;DPPH、碱性蛋白酶(10万U/g) 上海源叶生物科技有限公司;无水乙醇、磷酸氢二钠、柠檬酸、氯化钾、硫酸铜、硫酸镁、氯化钙、氯化钠(≥99.5%) 分析纯,天津市风船化学试剂科技有限公司。
JJ500型电子天平 常熟双杰测试仪器厂;TGL20M型高速冷冻离心机 北京中兴伟业仪器有限公司;RE-52A1A型旋转蒸发仪 上海亚荣生化精密科学仪器厂;Sephadex G-15 层析柱、凝胶填料美国GE公司;SCIENTZ-18N型真空冷冻干燥机上海比朗仪器制造有限公司;Merck Millipore超滤杯 上海轩仪仪器设备有限公司;UV-1800CP紫外分光光度计 上海美谱达仪器有限公司;STARTER 3100 pH计 奥豪斯仪器(上海)有限公司;Agliebt 1200型高效液相色谱仪 安捷伦公司;UItimate3000型高效液相色谱仪、Fusion高分辨质谱仪、ultiskan GO酶联免疫检测仪 美国Thermo Scientific公司。
1.2 实验方法
1.2.1 辣木籽蛋白粉的制备 配制0.3 mol/L NaCl溶液和0.1 mol/L NaOH溶液。蛋白提取:将1 g辣木籽粉与10 mL配置好的NaCl溶液混合均匀,用0.1 mol/L NaOH调节pH至7.15放入水浴锅,在50 ℃下搅拌提取30 min,抽滤去渣,收集滤液,真空冷冻干燥,得到辣木籽蛋白粉。
1.2.2 辣木籽粗蛋白肽的制备
1.2.2.1 酶解液的制备 将5 g辣木籽蛋白粉溶解于150 mL去离子水中,匀浆5 min,添加0.275 g碱性蛋白酶酶解,酶解条件:温度55 ℃、时间4.5 h、pH9,酶解完成后95 ℃水浴灭酶10 min,离心(4000 r/min,30 min),取上清液至−20 ℃冰箱保存。
1.2.2.2 酶解液的超滤分离 将1.2.2.1制得的上清液旋转蒸发浓缩10倍,过3 kDa的超滤膜,收集滤液后真空冷冻干燥,得到冻干粗蛋白肽。
1.2.3 Sephadex G-15葡聚糖凝胶柱层纯化辣木籽蛋白肽 Sephadex G-15葡聚糖凝胶按说明书进行前处理结束后,装柱,用去离子水平衡24 h。柱子平衡后将1.2.2中制得的辣木籽粗蛋白肽配制为10 mg/mL浓度,过0.45 μm的有机孔膜后上样,用去离子水洗脱,控制流速25 mL/h,每管收集8 mL,用紫外分光光度计(波长215 nm)测定每管的出峰值,绘制洗脱曲线,收集洗脱峰组分,旋蒸浓缩,冷冻干燥,得到纯化后的辣木籽蛋白肽。
1.2.4 辣木籽蛋白肽的HPLC-MS/MS鉴定 将1.2.3中纯化得到的辣木籽蛋白肽经过前处理后进行LCMS/MS鉴定。
色谱条件:色谱柱Trap column,100 μm×20 mm(RP-C18 ,Thermo Inc),柱温25 ℃,液相A液为0.1%甲酸-水溶液,B液为0.1%甲酸-乙腈溶液,梯度洗脱:0~39 min,10%~23% B;39~49 min,23%~35% B;49~50 min,35%~93% B;50~57 min,93% B;57~60 min,93%~10% B;流速为300 mL/min。
质谱条件:母离子扫描范围:350~1950 m/z,质谱扫描方式为信息依赖的采集工作模式下,每次全扫描后采集最强的10个碎片图谱,碎裂方式:高能碰撞解离,NCE能量28,动态排除时间:30 s,MS1在M/Z 200时分辨率为60000,AGC target设置为4e5,最大注射时间50 ms,MS2分辨率设置为15000,AGC target设置为5e4,最大注射时间50 ms。
1.2.5 不同分离阶段辣木籽粗蛋白肽的RP-HPLC纯度分析 将辣木籽蛋白酶解液、3 kDa超滤液、柱层析纯化物冻干后用超纯水溶解成溶液,采用分析型Aglient1200高效液相色谱仪分析。色谱条件:流速为1 mL/min,柱温为30 ℃,进样量:5 μL;检测波长215 nm;流动相:A相为0.1%三氟乙酸乙腈溶液,B相为0.1%三氟乙酸水溶液,洗脱条件为梯度洗脱:0.01 min,A:10%,B:90%;15 min,A:50%,B:50%。
1.2.6 辣木籽粗蛋白酶解液、超滤液、柱层析纯化物的抗氧化活性分析
1.2.6.1 总还原力的测定 根据裴斐等[16]方法并稍作修改。分别将辣木籽粗蛋白冻干酶解物、超滤物、柱层析纯化物依次配置成6个浓度梯度:0.6、0.8、2、4、6、8 mg/mL。在1 mL各浓度样品中加入2.5 mL质量分数为1%的铁氰化钾溶液和2.5 mL浓度为0.2 mol/L的磷酸盐缓冲液(pH6.6),混合后在50 ℃条件下保温20 min,然后加入2.5 mL质量分数为10%的三氯乙酸,混合后以3000 r/min离心10 min,取上清液2.5 mL,加入2.5 mL蒸馏水和2.5 mL质量分数为0.1%的三氯化铁,混匀后,从每个样品中取出200 μL加入到96孔板中,并在700 nm检测波长下测定其吸光值,还原力用吸光值A700表示,Vc为阳性对照。
1.2.6.2 DPPH自由基清除率的测定 将辣木籽蛋白酶解物、超滤物、柱层析纯化物依次配置成6个浓度梯度:0.01、0.05、0.1、0.2、0.4、0.6 mg/mL,自由基清除率测定按照刘红等[17]的方法,并稍作调整[18],配制0.2 mmol/L DPPH(避光)溶液和70%的无水乙醇放入冰箱备用。溶液混合后室温下避光反应30 min,以酶联免疫检测仪测定其在517 nm下的吸光值。

式中:A0为1 mL DPPH与1 mL 70%乙醇的吸光值;Ai为1 mL DPPH与1 mL样品的吸光值;Aj为1 mL 70%乙醇与1 mL样品的吸光值。
1.2.7 辣木籽抗氧化肽稳定性分析
1.2.7.1 不同温度对辣木籽抗氧化肽活性的影响将辣木籽抗氧化肽(冻干粉)配制成0.1 mg/mL溶液,采用工业中常见的3种加热方式(65、100、115 ℃)分别加热20 min后,使温度自然降低到25 ℃,测定其DPPH自由基清除率。
1.2.7.2 pH对辣木籽抗氧化肽活性的影响 朱楚楚[19]的研究表明,碱性条件下抗氧化肽会发生消旋作用,使肽链的构象发生变化,导致其活性损失,因此本研究将辣木籽肽(冻干粉)配制成0.1 mg/mL(原始pH7.3),调节pH至酸性范围:3.4、4.0、4.4、5.0、5.4、6.0,一组样品溶液静置1 h后直接测定各样品溶液的DPPH自由基清除率;另一组样品静置1 h后,115 ℃下加热20 min,自然冷却到25 ℃后测定各样品溶液的DPPH自由基清除率。
1.2.7.3 金属离子对辣木籽抗氧化肽活性的影响辣木籽肽(冻干粉)配制成0.1 mg/mL溶液,向样品溶液中加入硫酸铜、硫酸镁、氯化钙、氯化钾,使各样品金属离子的浓度分别达到0.25、0.5、1、2 mmol/L,一组样品溶液静置1 h后直接测定各样品溶液DPPH自由基清除率;另一组样品溶液静止1 h后,115 ℃下加热20 min,冷却至25 ℃后测定各样品溶液的DPPH自由基清除率。
1.3 数据处理
采用Excel 2010和SPSS 19.0对实验数据进行整理和显著性分析,ProteomeDiscover2.4数据处理软件,对实验组样本进行蛋白定性。
2 结果与讨论
2.1 Sephadex G-15葡聚糖凝胶柱层析纯化辣木籽蛋白肽
2.1.1 葡聚糖柱层析洗脱效果 通过3 kDa超滤膜进行分离的辣木籽蛋白酶解液,洗脱曲线如图1所示。在215 nm波长测定下,从第18管到40管出现单一洗脱对称峰,为较均一的辣木籽蛋白肽。

图1 层析柱纯化后得到的洗脱峰Fig.1 The elution peaks obtained after column separation
2.2 辣木籽抗氧化肽的鉴定
按照1.2.4中的方法对的样品进行HPLCMS/MS分析鉴定,结合ProteomeDiscover2.4数据处理软件,对实验组样本进行蛋白定性和相对定量分析。图2是样品鉴定过程中的色谱图。如表1所示,经柱层析纯化后的辣木籽蛋白肽通过HPLCMS/MS主要鉴定出5条多肽,分子量分布在2000~3100 Da,含有18~26个氨基酸残基。XIA等[20]鉴定出大麦谷蛋白抗氧化肽序列中的疏水氨基酸占总残基的50%~67%,本实验中通过计算五条多肽中疏水性氨基酸分子量与总分子量的比值,发现鉴定出的KVLTMTGGKFVVNDVNGNVR、MSINLQSHA FAGNPLRSRTPK、NRLSLAMERTGQWVFSQDIPS 3条抗氧化多肽中疏水性氨基酸占据总氨基酸含量的50%~54%。此外,疏水性氨基酸残基Leu、Val、Ala、Pro及Phe能够提高肽在脂相中的溶解度,有利于肽与脂质中自由基的相互作用[21−23]。本研究中,QQTLAREHNQEYKAALQR序列中疏水性氨基酸Ala-Ala的叠加作用进一步提高了抗氧化肽抑制脂质过氧化的能力。

图2 分离组分超高效液相色谱图Fig.2 Ultra performance liquid chromatography-mass spectrometry of the separated components

表1 辣木籽蛋白肽组分的鉴定Table 1 Identification of Moringa oleifera seed protein peptides
GUO等[24]研究蜂王浆蛋白抗氧化肽的构效关系,发现在C-末端含有Lys残基或Arg残基的肽序列Phe-Lys、Phe-Pro-Arg表现出较强的抗氧化活性,本试验从辣木籽中分离纯化的抗氧化肽序列MSINLQSHAFAGNPLRSRTPK(Thr-Pro-Lys)与上述肽段的相似结构,所以该条多肽的抗氧化活性可能与C-末端含有的Lys残基有重要关系。有研究报道,Pro中的吡咯烷环可以与肽的二级结构相互作用,增加其柔性,由于其较低电离电势也能够淬灭单线态氧,从而起到抗氧化作用[25]。相似地,Gly中单个氢原子也可以增加肽骨架的柔性并有助于肽段抗氧化性质,Glu能够与Ca、Fe、Zn等形成螯合物而有助于其抗氧化性质[26],所以,本研究鉴定出的五条肽序列中所含的Gly、Glu、Pro可能是其表现出抗氧化活性的重要原因之一。此外,5条肽中含有Met、His、Trp、Tyr等供氢或供电子能力的氨基酸残基,也被证明均具有良好的清除自由基的能力[27−29]。
2.3 辣木籽粗蛋白酶解物、超滤液、柱层析纯化物的RP-HPLC纯度分析
采用分析型Aglient 1200 型RP-HPLC进行纯度分析,结果如图3所示。辣木籽蛋白酶解液中的蛋白肽可通过超滤分离得到比较对称的峰形,进一步柱层析纯化后得到的目标物峰形较对称,杂峰较少。说明对辣木籽蛋白酶解液通过超滤、Sephadex G-15葡聚糖凝胶柱层析分离纯化可获得纯度较高的辣木籽蛋白肽。

图3 辣木籽粗蛋白酶解物、超滤收集液、柱层析纯化物的RP-HPLC纯化Fig.3 Purification of Moringa oleifera seed crude protease hydrolysate, ultrafiltration collection solution and column chromatography purification by RP-HPLC
2.4 辣木籽粗蛋白酶解液、超滤液、柱层析纯化物的抗氧化活性分析
将辣木籽蛋白酶解物、超滤物、柱层析纯化物按照1.2.6中的浓度梯度配置好后,对其分别进行总还原力及DPPH自由基清除率的测定,结果如图4、图5所示。由图4可知:随着辣木籽蛋白酶解物、超滤物、以及柱层析纯化物的浓度逐渐增加,其还原能力值也在不断增大,在浓度范围内,酶解物的还原能力吸光值由0.058上升到0.21,超滤物还原力吸光值由0.133上升到0.75,柱层析纯化物的还原能力值由0.21上升到0.83,三者的还原能力大小排序为:柱层析纯化物>超滤物>酶解物。图5中,辣木籽蛋白酶解物、超滤物、柱层析纯化物的DPPH自由基清除率也随着三者浓度的增加而不断增大,活性也随之增强,三者的浓度在0.6 mg/mL时,其DPPH自由基清除率分别为50%、65%和71%,DPPH自由基清除率排序为:柱层析纯化物>超滤物>酶解物,说明超滤和柱层析纯化具有较好的分离效果。

图4 辣木籽粗蛋白酶解物、超滤液、柱层析纯化物的还原能力Fig.4 Reducing ability of Moringa oleifera seed crude proteolysis product, ultrafiltration collection solution, column chromatography purification product

图5 辣木籽粗蛋白酶解物、超滤液、柱层析纯化物的DPPH自由基清除能力Fig.5 The scavenging ability of DPPH free radicals of Moringa oleifera seed crude proteolysis product, ultrafiltration collection solution, and column chromatography purification product
2.5 辣木籽蛋白肽稳定性分析
2.5.1 不同温度对辣木籽抗氧化肽活性的影响 由图6可知,在65 ℃条件下,其辣木籽抗氧化肽的自由基清除率最高为18%,在115 ℃和不加热的条件下自由基清除率未见显著变化(P>0.05),在100 ℃下其自由基清除率为12%。刘丹等[18]以大豆浓缩蛋白为原料,利用酶法制备得到的大豆抗氧化肽,发现当加热温度在63~70 ℃范围内时,其抗氧化活性会增加,本实验中加热到65 ℃时的自由基清除率较不加热提高了4%。当温度达到95 ℃以上时,由于高温可能会使辣木籽抗氧化肽发生分解,使其抗氧化活性降低,此时100 ℃条件下的自由基清除率相比65 ℃条件时降低至12%。

图6 温度对辣木籽肽抗氧化活性影响Fig.6 Effect of temperature on the activity of Moringa oleifera seed antioxidative peptide
2.5.2 常温与加热条件下pH对辣木籽抗氧化肽稳定性的影响 由图7得知,非热条件处理下,pH在3.4~5.4范围内,其DPPH自由基清除能力保持在17%左右,趋于平稳。刘华勇等[15]研究发现,在酸性条件下,辣木籽抗氧化肽的稳定性更好,且对辣木籽多肽的活性影响不明显,但是,当pH为6.0接近6.3时的自由基清除率为26%。由图8可知,在加热条件处理下,当pH在3.4~5.4范围时,与非加热相比,加热条件下的自由基清除率增加了4%左右,说明在酸性条件下加热能提高辣木籽抗氧化肽的活性。朱楚楚[19]研究pH对金瓜籽抗氧化肽活性时发现,碱性条件下抗氧化肽会发生消旋作用,会使肽链的构象发生变化,导致其活性损失,若将辣木籽肽应用于酸性饮料,经热处理后,能适当提高抗氧化活性。
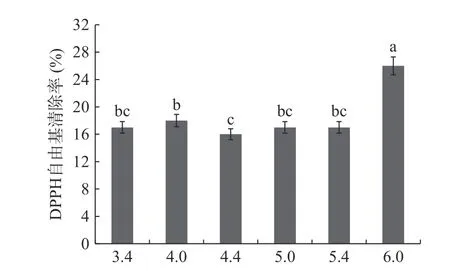
图7 常温条件下pH对辣木籽抗氧化肽活性的影响Fig.7 Effect of pH on the activity of Moringa oleifera seed antioxidative peptide under non-heat treatment

图8 115 ℃加热条件下pH对辣木籽抗氧化肽活性的影响Fig.8 Effect of pH on the activity of Moringa oleifera seed antioxidative peptide under heating at 115 ℃
2.5.3 常温条件处理和热条件处理下金属离子对辣木籽抗氧化肽活性的影响 由图9可知,4种金属离子对自由基清除率的影响均不同,其中不同质量浓度的Ca2+、Mg2+对自由基清除率没有明显影响,当K+和Cu2+浓度为2 mmol/L时的自由基清除率分别为34%和28%,辣木籽抗氧化肽的自由基清除率较不加热未添加金属离子样品分别提高了20%和14%(见图6);研究表明[30],金属离子对抗氧化物的抗氧化能力有一定影响,过渡金属离子K+、Cu2+具有未充满电子的阶层d轨道,更容易形成配合物,能够引发自由基和非自由基活性氧的产生。由图10可知,2 mmol/L K+、Cu2+、Mg2+浓度对应的自由基清除能力为9%、23%和11%,较不加热添加金属离子条件相比下降了25%、5%和4%,4种金属离子对自由基清除率均有所下降,这是因为加热可能加速促进辣木籽肽与金属离子的螯合反应,形成部分絮凝产物,因此其抗氧化活性降低;然而随着Cu2+的浓度增加,其自由基清除能力有所提高,这可能与辣木籽肽与Cu2+形成的螯合物的空间结构特性相关,需进一步研究,探明其作用机理。因此,若辣木籽多肽产品需要暴露在热条件下,应避免和K+、Mg2+和Ca2+接触。

图9 常温下金属离子对辣木籽抗氧化肽活性的影响Fig.9 Effects of metal ions on antioxidant peptide activity of Moringa oleifera seeds under room temperature
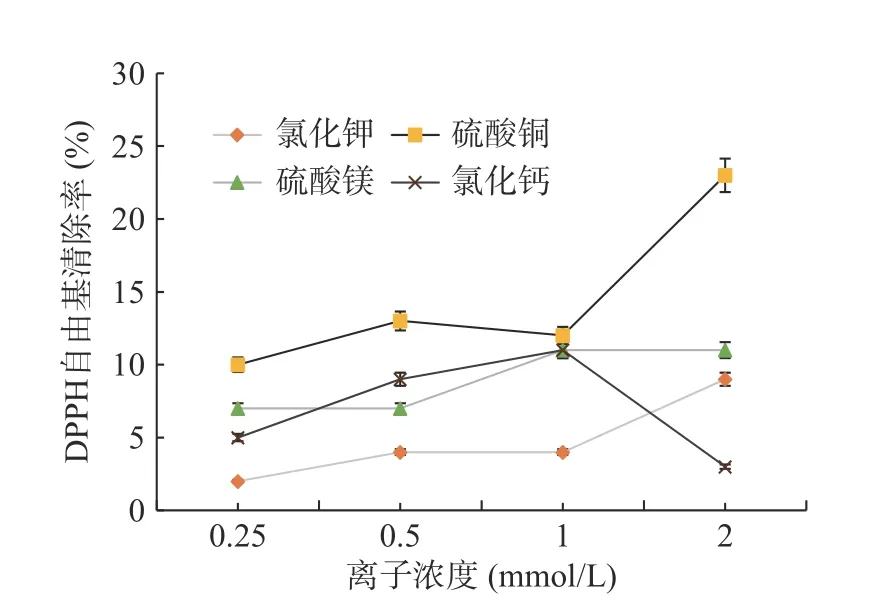
图10 加热条件下金属离子对辣木籽抗氧化肽活性的影响Fig.10 Effects of metal ions on antioxidant peptide activity of Moringa oleifera seeds under heating conditions
3 结论
本实验以辣木籽蛋白为原料,通过碱性蛋白酶水解制备抗氧化肽,采用超滤和Sephadex G-15葡聚糖柱层析分离纯化抗氧化肽,进一步对纯化物进行了肽序列鉴定,探究了pH、金属离子、温度对纯化物活性稳定性的影响。通过反向高效液相色谱分析酶解物、超滤物、柱层析纯化物得到的目标物纯度较高,峰形较对称;酶解物、超滤物、柱层析纯化物在浓度8 mg/mL时的还原力值分别为0.21、0.75、0.83,在浓度为0.6 mg/mL时,自由基清除率达到最高,分别为50%、65%和71%,说明目标物有较好的抗氧化效果;柱层析纯化物中主要鉴定出5条潜在的抗氧化肽,分别为KVLTMTGGKFVVNDVNGNVR、MS INLQSHAFAGNPLRSRTPK、QQTLAREHNQEYK AALQR、NRLSLAMERTGQWVFSQDIPS、EHAIN TDIQMSAFHEIEEDKAPDTPS。柱层析纯化物抗氧化活性稳定性研究表明:常温条件下pH3.4~5.4范围内其活性较为稳定,加热条件下其活性提高了4%;加热条件下,Cu2+、Ca2+、K+、Mg2+对辣木籽肽的活性较常温条件下分别降低了5%、23%、25%和4%,热处理条件下金属离子对辣木籽抗氧化肽活性的影响较大,该研究可为后续辣木籽抗氧化肽的开发应用提供参考。

