地黄对失眠小鼠视交叉上核生物钟基因Clock及 Bmal1表达的影响*
河北中医学院
杨伟丽 刘艳蕊 王 芮 鲁 琴 王 茜 柴天川△(石家庄 050091)
提要 目的:通过观察地黄对小鼠学习记忆、生物钟基因Clock及 Bmal1表达的影响,探索地黄改善失眠及学习记忆的机制。方法:将60只昆明小鼠随机分为4组:正常组、模型组、阳性药组、生地黄组。除正常组外,其他各组腹腔注射对氯苯丙氨酸(PCPA)以制备睡眠剥夺模型。采用翻正反射实验检测小鼠的睡眠潜伏期及睡眠时间;尾动脉无创血压测量分析系统检测小鼠收缩压、舒张压和心率;Morris水迷宫检测小鼠学习记忆能力; Real time-qPCR法检测视交叉上核(SCN)中Clock、Bmal1 mRNA的表达;免疫组化法检测SCN中Clock、Bmal1蛋白的表达。结果:与正常组小鼠比较,模型组小鼠睡眠发生率无变化、睡眠潜伏期明显延长(P<0.05),睡眠时间呈现缩短的趋势;与模型组小鼠比较,药物治疗组小鼠睡眠发生率提高,睡眠潜伏期缩短,睡眠时间延长(P<0.05)。与正常组小鼠比较,模型组小鼠逃避潜伏期延长较为显著,航行的总路程变长,穿过平台所在区域的次数变少(P<0.05,P<0.01);与模型组小鼠比较,药物治疗组小鼠的逃避潜伏期和行走的总路程缩短较为显著(P<0.05,P<0.01),穿过平台区域的次数增多。与正常组小鼠比较,模型组小鼠的收缩压、舒张压和心率有升高趋势;与模型组小鼠比较,药物治疗组小鼠收缩压、舒张压和心率有降低趋势。与正常组小鼠比较,模型组小鼠Clock和Bmal1的mRNA、蛋白表达水平明显升高(P<0.05);与模型组小鼠比较,药物治疗组Clock和Bmal1的mRNA、蛋白表达下降(P<0.05)。结论:生地黄能够有效缩短睡眠剥夺小鼠的睡眠潜伏期,明显延长睡眠持续时间,进而改善学习记忆能力,具有镇静催眠的作用,其作用机制可能与调节SCN中Clock和Bmal1的表达有着密切关系。
失眠,又称之为“不寐”,主要表现为睡眠时间、深度的不足,轻者入睡困难,或寐而不酣,时寐时醒,或醒后不能再寐,重则彻夜不寐[1]。失眠症在人群中普遍可见,流行病学调查显示,我国各类睡眠障碍者约占总人口的38%,高于世界27%的比例,失眠患者占睡眠障碍患者的95%以上[2]。生地黄的原植物为玄参科植物地黄[Rehmanniaglutinosa(Gaert.) Libosch.,]用药部位为其干燥块根,具有清热凉血、养阴生津的功效[3]。现代药理研究显示,地黄有抗抑郁、抑制中枢神经系统,改善认知和记忆能力的作用[4-6]。生物钟是肌体一种内源性的调控系统,与睡眠有着密切的关系[7]。视交叉上核(SCN)内的生物钟调节基因种类繁多,其中与失眠联系紧密的有生物钟基因Clock、时钟管理基因 Bmal1、晶体蛋白基因Cry1和Cry2、系列周期基因Per1、Per2、Per3等[8]。相关研究显示[9],睡眠剥夺小鼠SCN中生物钟基因Clock和Bmal1表达增高。前期研究表明[10],地黄具有镇静安神的功效,但其改善失眠的作用是否与调节Clock、Baml1有关尚不明确。因此,本研究采用对氯苯丙氨酸(PCPA)法复制睡眠剥夺模型,RT-qPCR法和免疫组化法检测SCN中Clock和Bmal1的表达,来探究地黄改善失眠的作用机制。
1 材料与方法
1.1 实验动物 昆明小鼠,SPF级,雄性,体质量为(20±2)g,许可证号:SCXK(冀)2018-004,由河北医科大学动物实验中心提供,温度和湿度保持恒定,光照采用12 h黑白循环,自由进食进水。本实验已通过河北中医学院伦理委员会的审查,批准号:DWLL2019004。
1.2 实验药物与试剂 生地黄配方颗粒(广东一方制药有限公司,批号:0071943);地西泮片(河北省中医院,批号:20200402);对氯苯丙氨酸(PCPA,美国Sigma 公司,批号:1001542324);戊巴比妥钠(德国进口分装,批号:020402)。
1.3 实验仪器 大鼠Moriss水迷宫视频分析系统(北京众实迪创科技发展有限责任公司);动物无创血压分析系统(美国visitech);SHA-B恒温振动器(常州国华电器有限公司);1-15K高速冷冻离心机(美国Sigma公司),MDF-382E超低温保存箱(日本三洋);CFX96实时荧光定量PCR仪(英国BIO-RAD公司);TDL-5-A离心机(上海安亭科学仪器厂);MK3FC酶联免疫检测仪(美国Thomer Fisher公司)。
1.4 分组、造模及给药 昆明小鼠60只首先适应性喂养1周,随机分为正常组、模型组、阳性药组、生地黄组,各组15只。模型组及各给药组每天随机给予夹尾2 min、冷水浴3 min、昼夜颠倒24 h、鼠笼45°倾斜24 h、交替鼠笼24 h、禁食不禁水24 h等外界刺激中的2种,连续4周,于最后1周的第4 d开始,连续3 d腹腔注射PCPA混悬液(450 mg/kg),1次/d。正常组腹腔注射等剂量的生理盐水。生地黄组小鼠灌胃给予含生药量为2.25 g/kg的生地黄溶液;阳性药组灌胃给予1.38 mg/kg的地西泮溶液;正常组和模型组小鼠灌胃给予等量的生理盐水。用药体积为0.01 mL/g,1次/d,连续给药7 d。
1.5 指标检测及方法
1.5.1 翻正反射实验:末次给药后,随机从各组中选出8只小鼠腹腔注射3.5 mg/mL戊巴比妥钠水溶液,记录30 min内小鼠入睡数量,得出睡眠发生率。各组剩余的7只小鼠腹腔注射4.5 mg/mL戊巴比妥钠水溶液,记录30 min内小鼠的睡眠潜伏期以及睡眠的持续时间。其中戊巴比妥钠用药体积为0.01 mL/g。将小鼠于仰卧位放置,超过1 min无法翻正,即认为翻正反射消失,翻正反射消失为发生睡眠,翻正反射恢复为觉醒。睡眠潜伏期为从戊巴比妥钠注射时开始至翻正反射消失的时间,睡眠时间为翻正反射消失到翻正反射恢复的时间。
1.5.2 Morris水迷宫实验:给药1周后,应用Morris水迷宫实验评价各组小鼠的空间记忆及学习能力[11-12]。
Morris水迷宫训练分为2部分。第1部分为定位航行实验:整个实验区域划分为4个象限,每个象限壁上贴有不同颜色图案的标志性卡片,将各组小鼠分别从各象限依次入水训练,使其能够自由地寻找平台区域,观察其产生的路径图并记录其到达平台区域所用的时间,此时间命名为逃避潜伏期。时间限定为1 min,若未到达平台区域,记录其逃避潜伏期为1 min,并且将其引导至平台区域停留10 s,持续训练5 d。第2部分为空间探索实验:在平台区域所在象限对侧象限的中点作为入水点,面向池壁入水,记录小鼠到达平台区域所用的时间,判断各组小鼠的记忆能力。
1.5.3 小鼠血压、心率的检测:末次给药30 min后,运用动物无创血压测量分析系统测量各组小鼠的收缩压、舒张压及心率,此过程中需要同一人进行操作。
1.5.4 Real time-PCR检测下丘脑SCN中Clock、Bmal1表达 取SCN组织10 mg,用Trizol提取组织样本中总RNA,测定RNA质量和浓度。按产品说明书的操作步骤进行反转录。再进行PCR扩增,扩增条件为:95 ℃、10 min预变性;95 ℃ 、10 s,58 ℃ 、60 s,完成40个循环。扩增完毕,得到目的基因及内参基因β-actin的Cq值,目的基因Cq值-β-actin Cq值=ΔCq;按照公式Q=2-ΔCq计算得到各目的基因的Q值及其均值,按照公式RQ值=Q值/Q均值计算得到各目的基因表达的相对定量值(RQ值)。Clock、Bmal1及内参β-actin 序列见表1。

表1 Clock、Bmal1和β-actin的引物序列表
1.5.5 免疫组化法检测下丘脑SCN中Clock、Bmal1表达:实验结束后,断头并迅速在冰上分离出下丘脑,在4%多聚甲醛中固定48 h。石蜡包埋,切片,脱水处理;滴加一抗Clock(1∶200)和Bmal1 (1∶100),室温孵育1 h;然后滴加二抗(1∶1 000),室温孵育1 min;PBS冲洗;DAB显色液孵育5 min;水洗、复染、脱水、透明。镜下观察切片,从每组切片中随机选取5个高倍(×400)视野,用Image Pro Plus 6.0对图像进行处理并获取平均光密度(OD)值。
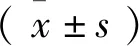
2 实验结果
2.1 各组小鼠睡眠发生率、睡眠潜伏期、睡眠时间的比较 与正常组小鼠相比较,模型组小鼠睡眠发生率无变化、睡眠潜伏期延长较为显著(P<0.05),小鼠的睡眠时间呈现缩短的趋势;与模型组小鼠相比较,药物治疗组小鼠睡眠发生率提高,睡眠潜伏期缩短,睡眠时间延长(P<0.05)。详见表2。

表2 各组睡眠发生率、睡眠潜伏期、睡眠时间的比较
2.2 各组小鼠水迷宫逃避潜伏期、总路程、穿越平台次数比较 与正常组小鼠比较,模型组小鼠的逃避潜伏期及总路程延长较为显著,穿越平台次数显著减少(P<0.05,P<0.01);与模型组小鼠比较,药物治疗组小鼠逃避潜伏期和总路程明显缩短(P<0.05,P<0.01),穿越平台次数呈现增多的趋势。详见表3。

表3 各组小鼠水迷宫逃避潜伏期、总路程、穿越平台次数比较
2.3 各组小鼠收缩压、舒张压以及心率的比较 与正常组小鼠比较,模型组收缩压、舒张压和心率有升高的趋势;与模型组小鼠比较,给药组收缩压、舒张压和心率有降低的趋势,但差异均无显著性(P>0.05)。详见表4。
2.4 各组小鼠SCN中Clock和Bmal1表达的比较 与正常组小鼠相比较,模型组小鼠Clock和Bmal1两者的mRNA、蛋白表达水平升高显著(P<0.05);与模型组小鼠相比较,给药组Clock和Bmal1的mRNA、蛋白表达水平下降(P<0.05)。详见表5~表6、图1~图2。

表4 各组小鼠收缩压、舒张压、心率的比较

表5 各组小鼠SCN中Clock,Bmal1 mRNA表达的比较

表6 各组小鼠SCN中Clock,Bmal1的平均OD值比较
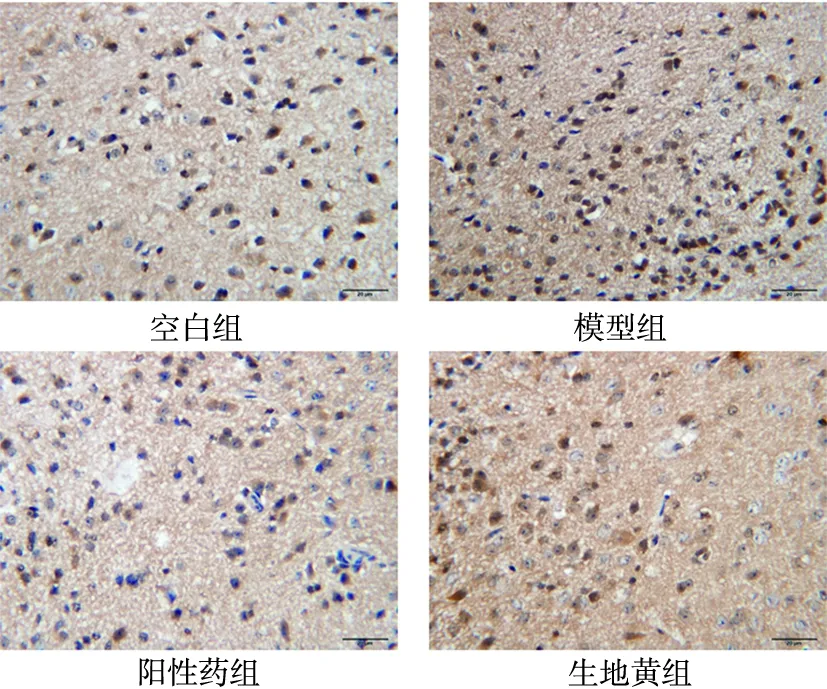
图1 生地黄对睡眠剥夺小鼠SCN中Clock蛋白表达的影响(×400)

图2 生地黄对睡眠剥夺小鼠SCN中Bmal1蛋白表达的影响(×400)
3 讨论
良好的睡眠觉醒周期能够有效消除肌体疲劳、增强免疫,并且对情绪调节、学习记忆等认知功能具有不可替代的调控作用[13]。失眠不仅可以造成认知障碍,还能够影响人的学习记忆能力。研究表明[14],PCPA是一种5-羟色胺的合成抑制剂,腹腔注射于小鼠体内,能够抑制小鼠大脑内5-羟色胺的合成,导致睡眠昼夜节律消失,以致完全失眠,此模型造模时间较短,可重复性较强,是目前国内外较为公认的失眠模型[15]。PCPA可损伤小鼠的空间学习记忆能力,Morris水迷宫是检测小鼠学习记忆能力的常见评估工具,本研究结果显示:PCPA所致的模型组小鼠逃避潜伏期较长,总路程较长,穿越平台次数较少,说明模型组失眠小鼠的学习记忆能力减弱。给药后,生地黄组小鼠的逃避潜伏期明显缩短,在池中航行的总路程显著性缩短,在平台区域穿越的次数也呈现增长趋势,定位航行能力有了明显改善。因此,可以推测出失眠导致小鼠的学习记忆等认知能力下降,而生地黄能够有效的改善失眠小鼠的学习记忆能力。
有研究表明,地黄在抗焦虑,抗抑郁[3],镇静催眠[16]方面有一定的作用。戊巴比妥钠协同实验方法为探讨中药治疗失眠作用的经典方法,该方法将小鼠翻正反射消失作为观察的指标[17]。有关研究显示,有镇静催眠功效的药物均能有效缩短戊巴比妥钠阈上剂量诱导的小鼠睡眠潜伏期,提高阈下剂量诱导的睡眠发生率,延长睡眠持续时间[18]。本研究结果显示,生地黄能够有效地提高小鼠的睡眠发生率,缩短其睡眠潜伏期,延长其睡眠时间,尤其在缩短睡眠潜伏期方面作用明显。提示地黄能够在一定程度上发挥促进睡眠的作用。
睡眠-觉醒活动受睡眠节律基因的调控,在哺乳动物体内,生物钟系统的结构比较复杂,是由SCN和附属的外周生物钟系统组成[19]。Clock、Bmal1基因是SCN中的2类兴奋性调节基因,若其表达增高,则会引起神经兴奋性的增强,从而造成睡眠质量下降、睡眠时间减少[20-21]。Clock基因的主要作用是维持睡眠的稳态,是最先被发现的生物钟基因[22-23]。当Clock基因突变时,小鼠会极度兴奋、睡眠时间减少, 多巴胺能神经元活性会增加[24-25]。Bmal1基因是转录起始的主要调节因子,并激活昼夜节律生物钟基因表达[22],其缺失会导致小鼠活动节律紊乱[26-27]。本研究结果显示,睡眠剥夺的模型复制成功后,小鼠SCN中Clock、Bmal1基因和蛋白的表达水平升高;给予生地黄进行治疗后,两者的基因和蛋白表达水平明显降低。提示生地黄可能通过降低SCN中Clock、Bmal1两者的基因、蛋白水平的表达来治疗失眠。
综上所述,生地黄能够有效缩短睡眠剥夺小鼠的睡眠潜伏期,并且能够明显延长睡眠剥夺小鼠的睡眠持续时间,进而改善学习记忆能力,可能与调节SCN中Clock和Bmal1的表达有关,有待开展更系统、严谨的研究加以验证。

