解毒护肝方抑制NLRP3炎症小体活化缓解对乙酰氨基酚诱导的小鼠急性肝损伤*
河北中医学院药学院
于泽鹤 胡巍巍△ 巨晓宁△△ 彪雅宁 王 茜 韩 雪 张一昕(石家庄 050091)
提要 目的:探讨解毒护肝方对对乙酰氨基酚(APAP)所致小鼠急性肝损伤(ALI)的保护作用及其机制。方法:60只C57BL/6N小鼠随机分为正常组、模型组、阳性药组以及解毒护肝方低、中、高剂量组。APAP造模同时,分别灌胃给予相应药物治疗,连续14 d。实验结束后,采集血清和肝组织,检测血清中丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、直接胆红素(DBIL)、总胆红素(TBIL)、白介素-1β(IL-1β)和白介素-18(IL-18)的活性或含量;苏木精-伊红(HE)染色法观察肝脏病理形态学变化;实时荧光定量聚合酶链式反应(Real-time PCR)和蛋白免疫印迹法(Western blot)法检测肝脏中核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)和半胱氨酸天冬氨酸酶-1(caspase-1)的基因蛋白表达水平。结果:与正常组比,模型组小鼠血清 AST、ALT、DBIL、TBIL、IL-1β和IL-18的活性含量均显著升高(P<0.01),肝脏中NLRP3和caspase-1基因蛋白表达明显上调(P<0.01),肝细胞内可见嗜酸性变和炎性细胞浸润;与模型组比,解毒护肝方各剂量组能明显降低血清 AST、ALT、DBIL、IL-1β和IL-18的活性或含量以及肝脏中NLRP3和caspase-1基因蛋白表达水平(P<0.01或P<0.05),改善肝脏病理损伤。结论:解毒护肝方可有效防治APAP诱导的小鼠ALI,其机制可能与抑制NLRP3炎症小体介导的炎症反应有关,为临床治疗ALI提供了用药实验依据。
对乙酰氨基酚(APAP)为临床上常用的解热镇痛药,服用过量或应用不当可引发急性肝损伤(ALI)[1]。据统计,APAP引发的ALI呈上升趋势,已成为导致药物所致ALI最常见的药物之一,并成为欧美等发达国家引起急性肝衰竭的最主要因素[2]。研究表明,炎症反应是APAP诱导ALI发生的一个重要机制,其中核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体的活化是肝细胞炎症反应的核心环节,其活化后可激活半胱氨酸天冬氨酸酶-1(caspase-1),并进一步促进炎症因子白介素-1β(IL-1β)和白介素-18(IL-18)的释放,加重炎症反应,促进ALI病情发展[3-4]。课题组以茵陈蒿汤、小柴胡汤和逍遥丸为基础,加减化裁自拟解毒护肝方,前期研究已证实该方对APAP诱导的肝损伤大鼠有较好的保肝疗效[5],但其能否通过调节NLRP3炎症小体的表达达到保护肝脏作用,尚不明确。故本实验观察了解毒护肝方对APAP诱导的ALI小鼠模型肝功能、炎症因子、肝脏病理形态学以及NLRP3、caspase-1基因蛋白表达的影响,进一步探讨解毒护肝方防治ALI的作用机制。
1 材料与方法
1.1 实验药物 解毒护肝方组成为柴胡、五味子、生甘草各10 g,炒白芍、炒白术、丹参、生黄芪、楮实子、茵陈各15 g,田基黄30 g,方中所用药物均为广东一方制药有限公司生产的配方颗粒,批号分别为:1030913、1010233、17120058、0122303、1030293、1012143、18010046、11080711、1016583、0075913。水飞蓟宾胶囊(天津天士力圣特制药有限公司,35 mg/粒),生产批号:750709172,批准文号:国药准字H20040299;对乙酰氨基酚片(石药集团欧意药业有限公司,0.5 g/片,生产批号:016171002,批准文号:国药准字 H13022763。实验时中药配方颗粒、水飞蓟宾胶囊、对乙酰氨基酚片均配置一定浓度的药液于4 ℃冰箱贮存备用。
1.2 实验动物 SPF级C57BL/6N小鼠60只,雄性,体质量20~24 g,购自北京维通利华实验动物技术有限公司,合格证号:110011210101691148,许可证号:SCXK(京)2016-0006。
1.3 实验试剂 丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)试剂盒均购于深圳市库贝尔生物科技股份有限公司;直接胆红素(DBIL)、总胆红素(TBIL)试剂盒均购自南京建成生物工程研究所;IL-1β试剂盒购于北京博奥森生物技术有限公司;IL-18试剂盒购于深圳欣博盛生物科技有限公司;NLRP3;抗多克隆抗体、caspase-1一抗多克隆抗体均购于武汉三鹰科技有限公司;辣根过氧化物酶(HRP)标记的山羊抗兔免疫球蛋白(Ig)G、抗β肌动蛋白小鼠单抗(β-actin)、PCR扩增试剂盒、逆转录试剂盒均购自武汉赛维尔生物科技有限公司;ECL发光试剂盒购于苏州新赛美生物科技有限公司。
1.4 实验仪器 iChem300型全自动生化仪(深圳市库贝尔生物科技有限公司);DP73型数码显微镜(日本OlymPus公司);TSY-B 型脱色摇床、KZ-II 型研磨仪、BV-2 型垂直电泳仪(武汉赛维尔生物科技有限公司); CFX 型荧光定量 PCR 仪(美国 Bio-rad 公司);Fusion FX5 Spectra 多功能成像系统(法国Vilber公司)。
1.5 动物模型建立及分组给药 小鼠适应性饲养1周后,按体质量分层原则随机分为6组:正常组、模型(APAP)组(600 mg/kg)、阳性药(水飞蓟宾)组(0.144 g/kg)、解毒护肝方低剂量(1.11 g/kg)、中剂量(2.22 g/kg)和高剂量组(4.44 g/kg),每组10只,参照陈奇主编的《中药药理研究方法学》中人与小鼠体表系数法换算得出给药剂量。每天上午8:00,给药组给予相应药物灌胃,正常组和模型组给予等量蒸馏水;下午4:00,模型组及给药组给予APAP混悬液灌胃,建立ALI模型,正常组给予等量蒸馏水,给药剂量10 mL/kg,给药14 d。
1.6 标本采集 最后1次灌胃结束后,禁食不禁水12 h,摘眼球取血,置1.5 mL离心管中,以4 000 r/min离心20 min,收集血清,冷贮备用;迅速剖取部分肝组织,液氮保存;另取1份0.5×0.5×0.2 cm大小的肝组织,4%多聚甲醛固定。
1.7 指标检测及方法
1.7.1 血清指标检测:采用全自动生化分析仪检测小鼠血清中ALT和AST的活性,化学氧化法检测血清中DBIL和TBIL的含量,酶联免疫吸附试验(ELISA)法检测血清中IL-1β和IL-18的含量,以上操作均严格按试剂盒说明进行。
1.7.2 HE染色法观察肝脏的病理形态学变化:经4%多聚甲醛处理的肝组织进行常规脱水、石蜡包埋、切片、HE 染色,光镜下观察染色结果。
1.7.3 实时荧光定量聚合酶链式反应(Real-time PCR)检测肝脏中NLRP3和caspase1的基因表达:
冻存的肝脏经研磨仪研磨后,Trizol提取其总RNA,逆转录为cDNA 后加入扩增反应体系,进行Real-time PCR 检测,PCR 反应条件为 95 ℃预变性15 min;95 ℃变性 10 s,58 ℃退火30 s,72 ℃延伸30 s,40个循环。按照相对定量方法分析,用2-ΔΔCt法表示基因的相对表达量。引物设计如下:NLRP3上游引物5′-TCTTTGCGGCTATGTACTATCT-3′,下游引物5′-TTCTAATAGGACCTTCACGT-3′;caspase-1上游引物5′-TGCCTGGTC TTGTGACTTGGAG-3′,下游引物5′-TGTCCTGGGAAGAGGTAGAAACG-3;β-actin上游引物5′-TGCTATGTTGCCCTAGACTTCG-3,下游引物5′-GTTGGCAT AGAGGTCTTTACGG-3。
1.7.4 蛋白免疫印迹法(Western blot)检测肝脏中NLRP3和caspase-1的蛋白表达:称取100 mg液氮冻存的肝脏,置冰上剪碎,加入RIPA强效裂解液,混匀后研磨仪研磨,冰上静置10 min后,12 500 r/min离心30 min,收集上清液,测定蛋白浓度。蛋白煮沸变性后,经SDS-PAGE凝胶电泳分离,后转移到PVDF膜,封闭液封闭1 h后,TBST洗膜4×5 min,加入一抗NLRP3和caspase1(稀释比例均为1∶1 000),4 ℃孵育过夜,TBST洗膜5 min/次,连洗4次,将洗涤后的一抗反应膜放入二抗(1∶3 000)中,室温孵育1.5 h,TBST洗膜5 min/次,连洗4次,洗去游离二抗。采用ECL化学发光进行显色,多功能成像系统检测,ImageJ软件分析蛋白灰度值。

2 结果
2.1 各组小鼠血清中ALT、AST活性和DBIL、TBIL含量变化 与正常组比,模型组小鼠血清中ALT、AST、DBIL和TBIL的活性或含量均明显升高(P<0.01);与模型组比,各用药组小鼠血清中ALT、AST和DBIL的活性或含量以及低剂量组小鼠血清中TBIL含量均明显降低(P<0.01或P<0.05);各用药组之间对比发现,低剂量组小鼠血清中DBIL含量明显低于阳性药组和高剂量组(P<0.01),高剂量组小鼠血清中ALT活性明显高于中剂量组(P<0.05)。详见表1。

表1 各组小鼠血清中ALT、AST、DBIL和TBIL活性或含量的变化
2.2 各组小鼠血清中IL-1β和IL-18含量变化 与正常组比,模型组小鼠血清IL-1β和IL-18含量均显著升高(P<0.01);与模型组比,各用药组小鼠血清IL-1β和IL-18含量均显著降低(P<0.01或P<0.05);高剂量组小鼠血清IL-18含量明显低于阳性药组和低剂量组(P<0.05)。详见表2。

表2 各组小鼠血清中IL-1β和IL-18的含量变化
2.3 各组小鼠肝脏病理形态学变化 光镜下观察,正常组小鼠肝小叶结构完整,肝细胞大小均匀,肝细胞索排列整齐,以中央静脉为中心呈放射状排列;模型组小鼠肝细胞索排列紊乱,肝细胞内可见大量的嗜酸性变和小面积的炎性细胞浸润,偶见点状坏死;阳性药组可见少量的嗜酸性变以及小面积的肝细胞片状坏死;解毒护肝方各剂量组可明显减轻嗜酸性变和细胞坏死现象,高剂量组仍可见少许的点状坏死。见图1。
2.4 各组小鼠肝组织中NLRP3、caspase-1基因和蛋白表达水平的变化 与正常组比,模型组小鼠肝组织中NLRP3、caspase-1基因和蛋白表达水平均显著升高(P<0.01);与模型组比,各用药组小鼠肝组织中NLRP3、caspase-1基因和蛋白表达水平均显著降低(P<0.01或P<0.05);各用药组之间比较发现,高剂量组小鼠肝组织中NLRP3 基因以及NLRP3、caspase-1蛋白表达水平均显著低于阳性药组和低剂量组(P<0.01或P<0.05)。详见表3、图2。
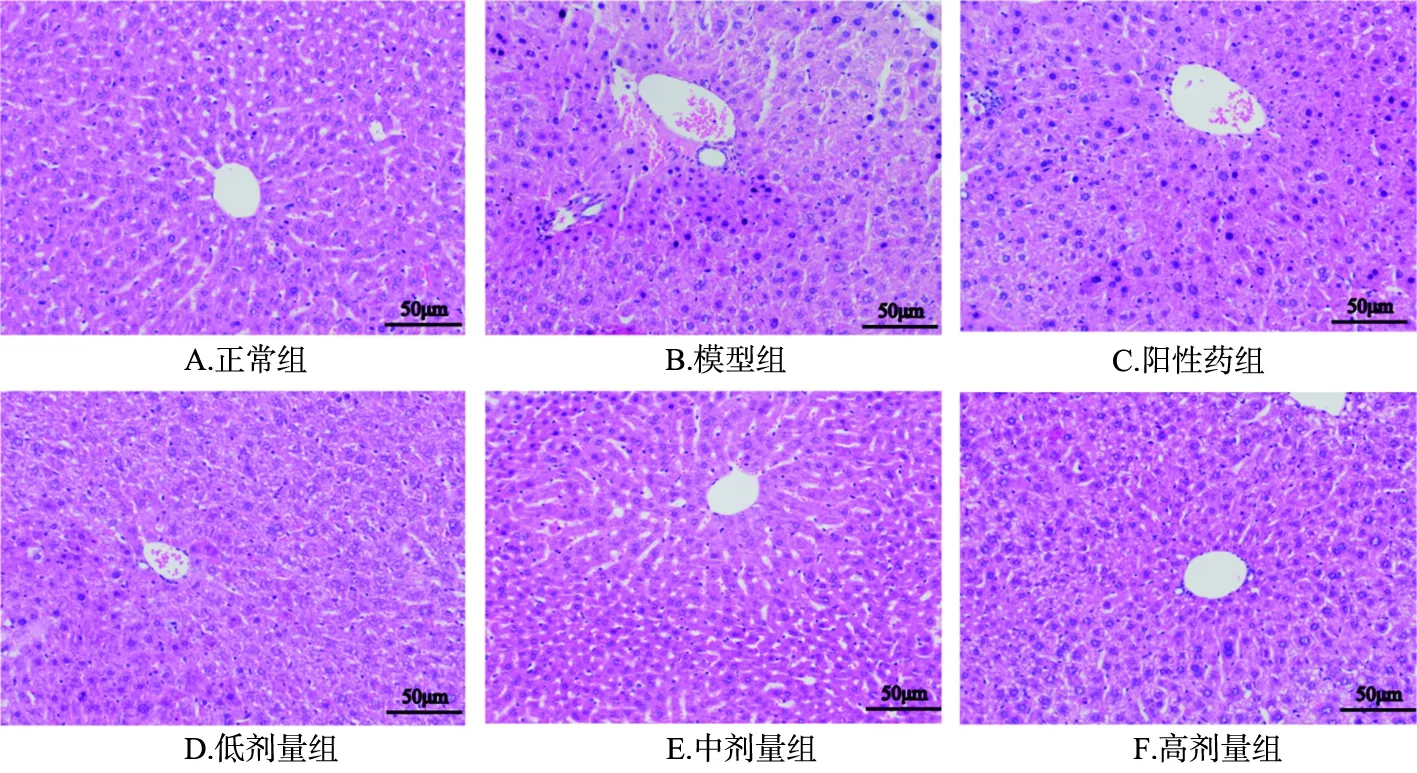
图1 各组小鼠肝脏病理形态学变化(HE,×200)
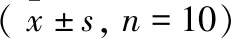
表3 各组小鼠组织中NLRP3、caspase-1基因和蛋白表达水平的变化
注:A.正常组;B.模型组;C.阳性药组;D.低剂量组;E.中剂量组;F.高剂量组。
3 讨论
中医古籍中未见“急性肝损伤(ALI)”这一病名的记载,但根据其临床特点,可将其归属于“药毒”“黄疸”“积聚”等范畴。若短时间药量过大或长期服药导致药毒过猛、药毒蓄积,则损伤肝体,导致肝失疏泄,气机不畅,气滞则血瘀;或肝病传脾,脾运失职,湿浊内生,蕴久化热。故本课题组认为,ALI病位在肝、脾二脏,肝脾失调、气滞湿阻、热毒瘀结为其关键病机,调和肝脾、理气活血、清热利湿、解毒为其有效治法。解毒护肝方中柴胡畅行肝气,为君药;黄芪、炒白术健脾益气,炒白芍、五味子养血柔肝,共为臣药;佐以茵陈清热利湿,田基黄既可清热利湿、解毒,又合以丹参活血散瘀,楮实子功可健脾利水、清肝,4味佐药合用除湿热毒瘀之邪;生甘草清热解毒、调和诸药,为使药。全方十味药,相济并用,共奏疏肝健脾、解毒除湿、活血祛瘀之功,与ALI病机相恰合。课题组前期研究表明解毒护肝方有抗炎保肝作用[6],但其对炎症反应的具体调控机制仍需进一步研究。
ALT和AST均位于肝细胞中,当肝细胞受损时释放入血,因此ALT和AST水平能准确反映肝细胞损伤程度。胆红素也是在临床上应用较广的评价肝损伤情况的指标,其中DBIL和TBIL可以反映肝脏代谢胆红素的能力。当肝细胞受损,胆汁排泄受阻时,血中胆红素含量升高。本实验结果显示,模型组大鼠血清中ALT、AST活性和 DBIL、TBIL含量均显著升高,肝细胞排列紊乱,可见嗜酸性变和炎性细胞浸润,表明APAP对大鼠肝脏造成损伤,并对胆红素的代谢产生了影响。解毒护肝方治疗后,各剂量组大鼠转氨酶活性和胆红素含量均下降,肝脏病理损伤程度减轻,表明解毒护肝方能保护肝细胞,并恢复肝脏代谢胆红素的能力,其中中剂量组降低转氨酶活性的效果最为明显,高剂量组虽能一定程度上改善肝损伤,但可能由于用药剂量过大,加重肝脏负担,导致护肝作用不明显。因此,在临床应用保肝药物对肝损伤患者进行治疗时,并不是用量越大效果越好。
肝脏的炎症反应是ALI的重要发病机制,一般情况下,肝组织中NLRP3和caspase-1表达较低,但是在ALI小鼠模型的肝组织中二者表达水平及炎症因子含量均升高[7],揭示在ALI病情发展中,NLRP3炎症小体介导的炎症反应发挥关键作用。NLRP3炎症小体由NLRP3蛋白、凋亡相关斑点样蛋白(ASC)和无活性的酶原形式(pro-caspase-1)蛋白组成,其中,NLRP3的C端有一个可感知损伤相关分子模式(DAMPs)的结构域[8]。正常情况下,caspase-1以pro-caspase-1存在,当肌体服用过量APAP时,体内坏死性细胞会释放出DAMPs,NLRP3被DAMPs激活后,与ASC发生相互作用,募集pro-caspase-1,被募集后pro-caspase-1发生自体水解,转变为具有活性caspase-1。活化的caspase-1将无活性的IL-1β前体和IL-18前体转化为成熟的IL-1β和IL-18并释放[9-11]。IL-1β能激活和募集白细胞,尤其是募集中性粒细胞进入组织,直接参与器官损伤过程[12];IL-18是T细胞介导肝损伤的媒介,其通过促进T淋巴细胞的增殖和分化,直接介导肝细胞的损伤[13]。本研究结果显示,模型组小鼠血清中IL-1β和IL-18含量和肝组织中NLRP3和caspase-1基因蛋白表达水平均明显升高,揭示APAP可能通过活化NLRP3炎症小体,加重炎症反应,诱导肝损伤发生。解毒护肝方各剂量能不同程度降低IL-1β和IL-18含量以及下调NLRP3和caspase-1基因蛋白表达水平,提示抑制NLRP3炎症小体介导的炎症反应是解毒护肝方防治APAP致ALI的机制之一,这为临床治疗ALI提供了用药参考和实验依据。

