苏木乙酸乙酯提取液通过miR-150/ELK1信号对血管内皮细胞凋亡的影响*
王 倩 袁星星 周亚滨 杨建飞 李鑫峰
(1.贵州中医药大学第二附属医院,贵州 贵阳 550001;2.黑龙江省中医药科学院,黑龙江 哈尔滨 150001;3.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;4.贵州中医药大学,贵州 贵阳 550025)
动脉粥样硬化(AS)作为一种大中型动脉血管壁的慢性炎症性疾病,是诱导缺血性心脏病的主要病理基础,已成为我国人口死亡的重要原因之一[1]。由于AS具有复杂的病理机制,积极探索新的突破点对于提高其整体的防治水平具有重要意义。过去认为血栓机化与再形成和内膜细胞增生理论是AS发生的主要病理机制,然而越来越多的研究认为内皮细胞损伤是AS早期形成的始动因素,并且发现内皮细胞凋亡与AS发生发展存在密切的关联[2-3]。
作为AS的重要危险因素之一,氧化型低密度脂蛋白(ox-LDL)通过诱导内皮细胞损伤凋亡,从而失去调节免疫、炎症和脂质稳态的能力[4-5]。此外,内皮细胞凋亡还可以促进内皮细胞剥脱和泡沫细胞形成,是稳定斑块表型向血栓形成和侵蚀斑块转变的一个关键步骤[6-8]。课题组前期通过体内和体外研究显示,苏木乙酸乙酯提取液(SAEE)具有调控血脂、抗炎、免疫抑制和稳定斑块的作用[9-13]。因此,在本研究中课题组拟通过观察SAEE对ox-LDL诱导的内皮细胞凋亡及miR-150/ELK1信号通路的影响,以期进一步明确SAEE的作用机制。
1 材料与方法
1.1 细胞株
人脐静脉内皮细胞株(HUVEC)购于武汉佰仟度生物科技有限公司,该细胞株由美国典型培养物保藏中心(ATCC)引进。
1.2 药物及试剂
苏木购于贵州中医药大学附属第二医院,使用前经粉碎、乙醇提取、乙酸乙酯萃取后得到SAEE(纯度98%);ox-LDL购于北京索莱宝科技有限公司(货号:H7980);RPMI 1640、10%胎牛血清(Fetal bovine serum,FBS)、青霉素-链霉素混合液购于美国Gibco公司(货号分别为:A4192301、16140071和10378016)。Annexin V-FITC细胞凋亡检测试剂盒和ELK1兔单克隆抗体和辣根过氧化物酶标记山羊抗兔IgG(H+L)购于上海碧云天生物科技公司(货号分别为:C1062M、AF1585和A0208);逆转录试剂盒购于北京宝日医生物技术有限公司(货号:RR047A);RNA提取试剂盒和SYBR Green实时荧光定量PCR试剂盒购于美国Thermo Fisher公司(货号分别为:15596026、A25742);miRNA-150 mimics由上海吉玛制药技术有限公司合成(批号:191019)。
1.3 分组与干预
HUVEC用RPMI1640培养基(含10%FBS和100 μg/mL青霉素/链霉素混合液)于5%二氧化碳、37℃恒温培养箱中培养。取对数期生长的细胞以2×105/孔接种于6孔板中,分为空白组、模型组、SAEE组、模拟剂组和SAEE+模拟剂组,其中除空白组外,其余组参照文献[14]中方法采用100 μg/mL ox-LDL对细胞进行诱导构建内皮细胞损伤模型。同时,SAEE组和SAEE+模拟剂组加入200 μg/mL SAEE进行干预,模拟剂组和SAEE+模拟剂组按照说明书采用Lipofectamine 2000将100 nmoL miRNA-150 mimics转染至细胞。
1.4 指标检测
1.4.1 流式细胞术 采用Annexin V-FITC/PI双染法检测细胞凋亡水平。于48 h收集各组细胞,胰酶消化,预冷PBS离心5 min后以binding buffer重悬细胞。加入5 μL Annexin V-FITC于4℃冰箱避光孵育30 min,再加入5 μL碘化丙啶继续孵育5m in,流式细胞仪检测并分析细胞凋亡率。
1.4.2 Western blotting检测 于48 h收集各组细胞,PBS洗涤细胞后加入RIPA裂解液于冰上裂解30 min,离心收集上清后以BCA法测定蛋白浓度。取50 μg蛋白通过SDS-PAGE进行分离后转膜至PVDF。5%脱脂牛奶封闭1 h,加入稀释后的一抗:ELK1(1∶1 000)和β-actin(1∶1 000),4 ℃孵育过夜。加入辣根过氧化物酶标记山羊抗兔二抗室温下继续孵育1 h。超敏化学发光试剂盒显影后凝胶成像系统拍照。采用Image J软件对目的条带进行分析,以β-actin作为内参蛋白。
1.4.3 MDA含量、LDH释放量、SOD和Caspase-3活性检测 于48 h收集各组细胞培养液,分别采用硫代巴比妥酸法、比色法和黄嘌呤氧化酶法测定MDA含量、LDH释放量、Caspase-3和SOD活性。实验步骤严格参照试剂盒说明书进行。
1.4.4 RT-PCR法检测 于48 h收集各组细胞,分别采用相应的试剂盒提取细胞中总RNA或miRNA,按照试剂盒说明书逆转录合成cDNA。引物:ELK1,正义链 5'-GTAGAAGGGCC CAAGGAAGAGTTG-3';反义链5'-CTGGGCGCTGCCACTGGATGGAAACTGGAA-3'。Bax:正义链 5'-AGGAGCAGGTGCCTACAAGA-3';反义链 5'-GCATTTTC CCACCACTGTCT-3'。Bcl-2:正义链 5'-AGGAGCAGGTGCCTACAAGA-3';反义链5'-GCATTTTCCCACCACTGTCT-3'。Caspase-3:正义链5'-CTGGACTGC GGTATTTGAGAC-3';反义链5'-CCGGGTGCGGTAGAGTAAGC-3'。GAPDH:正义链5'-GGCACAGTCAAGGCTGAGAATG-3';反义链5'-ATGGTGGTGAAGACGCCAGTA-3'。miR-150:正义链5'-TCTCCCAACCCTTGTACC-3';反义链5'-CGAGGAAGAAGACGGAAGAAT-3'。U6:正义链 5'-CTCGCTTCGGCAGCACA-3';反义链 5'-AACGCTTCACGAATTTGCGT-3'。使用上述产物与SYBR Green PCR预混液于ABI 7900PCR机器上进行实时PCR。PCR循环条件为:95°C循环1 min,95℃循环40次,15 s,60℃循环15 s,72 ℃循环45 s。采用2-ΔΔCt法计算相对基因和miR-150的表达量。
1.5 统计学处理
应用SPSS19.0统计软件。所有实验均重复至少3次并且数据均以()表示,定量数据采用单因素方差分析和独立样本t检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 各组HUVEC细胞形态的比较
见图1。倒置相差显微镜显示,正常HUVEC形态良好,呈椭圆形、梭形,细胞核明显,呈铺石路样排列。模型组细胞较空白组变小,并且出现不规则的形态。SAEE组细胞形态及排列较模型组明显改善,但模拟剂组细胞损伤较模型组加重,而SAEE+模拟剂组细胞形态及排列与模型组比较无明显改善。
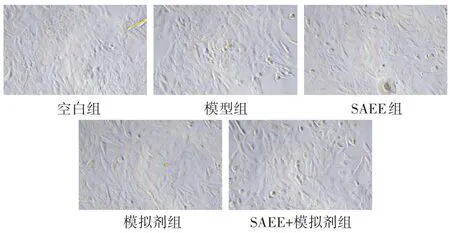
图1 各组HUVEC细胞形态的比较(200倍)
2.2 各组细胞中miR-150表达的比较
见表1。与空白组相比,模型组miR-150的表达水平显著增加,差异具有统计学意义(P<0.05)。与模型组相比,SAEE组miR-150的表达水平显著降低,模拟剂组miR-150的表达水平显著增加,差异均具有统计学意义(P<0.05),而SAEE+模拟剂组miR-150的表达水平与模型组比较略减降低,差异无统计学意义(P>0.05)。
表1 各组细胞中miR-150表达的比较(±s)
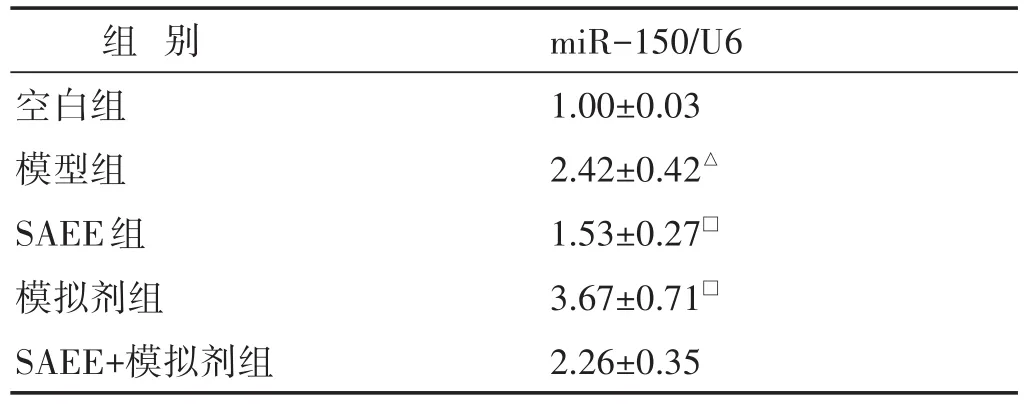
表1 各组细胞中miR-150表达的比较(±s)
注:与空白组比较,△P<0.05;与模型组比较,□P<0.05。下同。
组别空白组模型组SAEE组模拟剂组SAEE+模拟剂组miR-150/U6 1.00±0.03 2.42±0.42△1.53±0.27□3.67±0.71□2.26±0.35
2.3 各组HUVEC细胞凋亡的比较
见表2,图2。与空白组相比,模型组早期凋亡和总凋亡率均显著增加,差异均具有统计学意义(P<0.05)。与模型组相比,SAEE组早期凋亡和总凋亡率均显著降低,模拟剂组早期凋亡、晚期凋亡和总凋亡率均显著增加,差异均具有统计学意义(P<0.05),而SAEE+模拟剂组凋亡率与模型组比较略减降低,差异无统计学意义(P>0.05)。
表2 各组细胞凋亡的比较(%,±s)
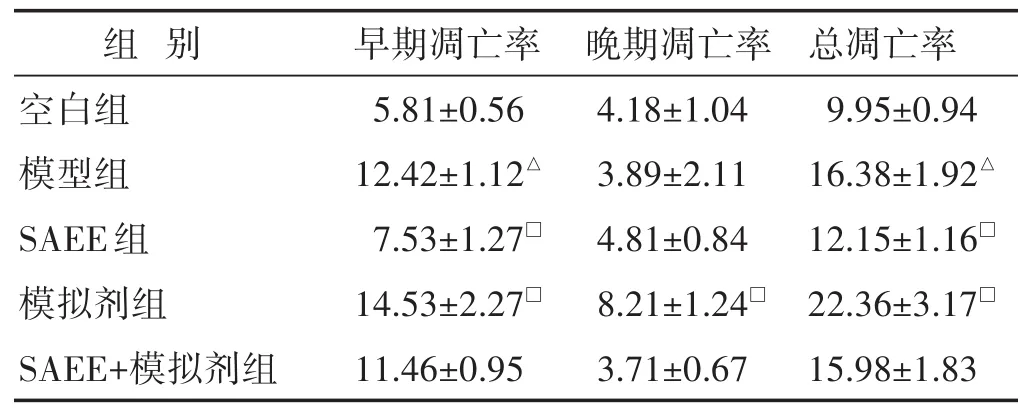
表2 各组细胞凋亡的比较(%,±s)
组 别 早期凋亡率 晚期凋亡率 总凋亡率5.81±0.56 12.42±1.12△7.53±1.27□14.53±2.27□11.46±0.95空白组模型组SAEE组模拟剂组SAEE+模拟剂组4.18±1.04 3.89±2.11 4.81±0.84 8.21±1.24□3.71±0.67 9.95±0.94 16.38±1.92△12.15±1.16□22.36±3.17□15.98±1.83
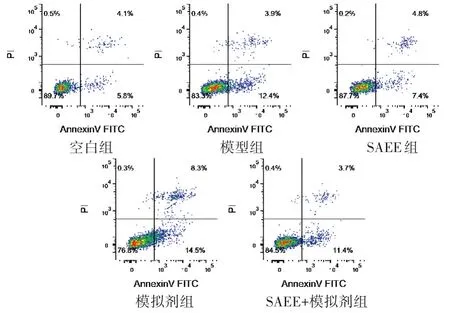
图2 各组HUVEC细胞凋亡的比较
2.4 各组细胞中ELK1表达的比较
见表3,图3。与空白组相比,模型组ELK1蛋白及mRNA的表达水平显著降低,差异均具有统计学意义(P<0.05)。与模型组相比,SAEE组ELK1蛋白及mRNA的表达水平显著增加,模拟剂组ELK1蛋白及mRNA的表达水平显著降低,差异均具有统计学意义(P<0.05),而SAEE+模拟剂组miR-150的表达水平与模型组无明显变化,差异无统计学意义(P>0.05)。
表3 各组细胞中ELK1蛋白及mRNA表达的比较(±s)
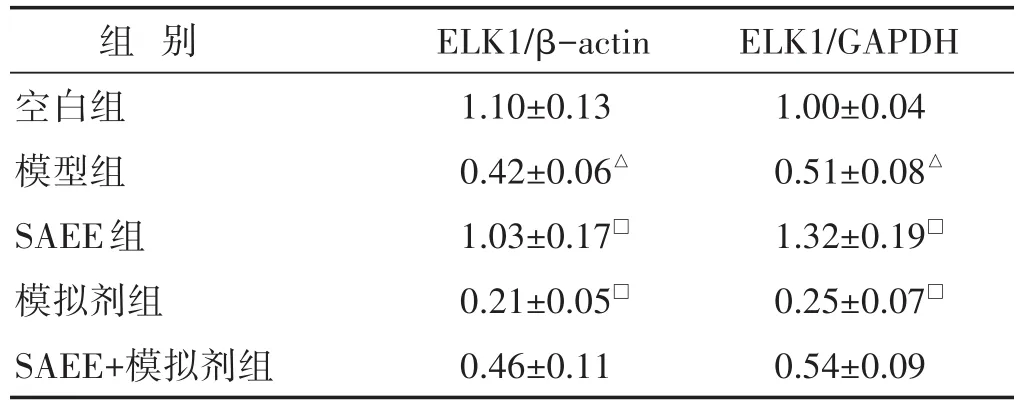
表3 各组细胞中ELK1蛋白及mRNA表达的比较(±s)
组别空白组模型组SAEE组模拟剂组SAEE+模拟剂组ELK1/β-actin 1.10±0.13 0.42±0.06△1.03±0.17□0.21±0.05□0.46±0.11 ELK1/GAPDH 1.00±0.04 0.51±0.08△1.32±0.19□0.25±0.07□0.54±0.09
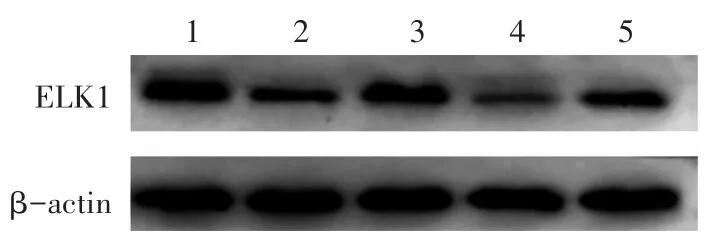
图3 各组细胞中ELK1蛋白表达的比较
2.5 各组细胞中MDA、LDH和SOD水平的比较
见表4。与空白组相比,模型组MDA含量和LDH释放量显著增加,SOD活性显著降低,差异均具有统计学意义(P<0.05)。与模型组相比,SAEE组MDA含量和LDH释放量显著降低,SOD活性显著增加,差异均具有统计学意义(P<0.05);模拟剂组MDA含量和LDH释放量显著增加,SOD活性显著降低,差异均具有统计学意义(P<0.05)。而SAEE+模拟剂组MDA含量、LDH释放量和SOD活性与模型组无明显变化,差异无统计学意义(P>0.05)。
表4 各组细胞中MDA、LDH和SOD水平的比较(±s)
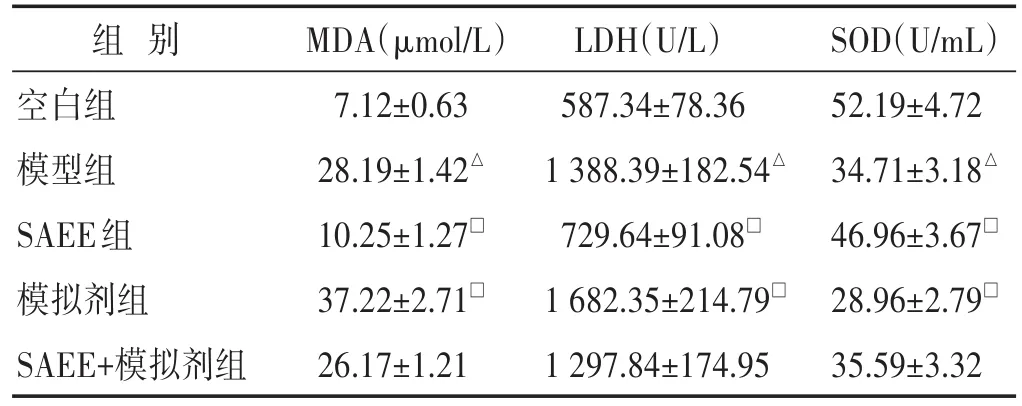
表4 各组细胞中MDA、LDH和SOD水平的比较(±s)
组别空白组模型组SAEE组模拟剂组SAEE+模拟剂组MDA(μmol/L)7.12±0.63 28.19±1.42△10.25±1.27□37.22±2.71□26.17±1.21 LDH(U/L)587.34±78.36 1 388.39±182.54△729.64±91.08□1 682.35±214.79□1 297.84±174.95 SOD(U/mL)52.19±4.72 34.71±3.18△46.96±3.67□28.96±2.79□35.59±3.32
2.6 各组细胞中Caspase-3活性的比较
见表5。与空白组相比,模型组Caspase-3活性显著增加,差异均具有统计学意义(P<0.05)。与模型组相比,SAEE组Caspase-3活性显著降低,模拟剂组Caspase-3活性显著增加,差异均具有统计学意义(P<0.05)。而SAEE+模拟剂组Caspase-3活性较模型组略降低,差异无统计学意义(P>0.05)。
表5 各组细胞中Caspase-3活性的比较(U/mg,±s)
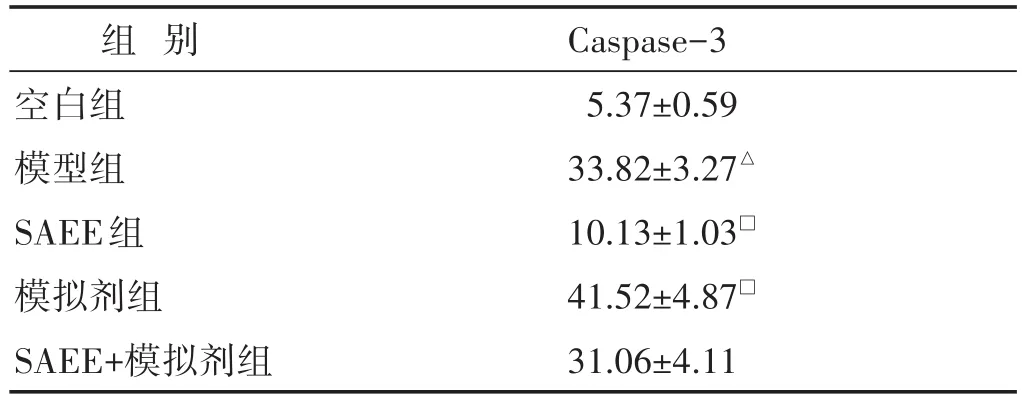
表5 各组细胞中Caspase-3活性的比较(U/mg,±s)
组别空白组模型组SAEE组模拟剂组SAEE+模拟剂组Caspase-3 5.37±0.59 33.82±3.27△10.13±1.03□41.52±4.87□31.06±4.11
2.7 各组细胞中凋亡基因表达的比较
见表6。与空白组相比,模型组Bax和Caspase-3 mRNA的表达水平显著增加,Bcl-2 mRNA的表达水平显著降低,差异均具有统计学意义(P<0.05)。与模型组相比,SAEE组Bax和Caspase-3 mRNA的表达水平显著降低,Bcl-2 mRNA的表达水平显著增加,差异均具有统计学意义(P<0.05);模拟剂组Bax和Caspase-3 mRNA的表达水平显著增加,Bcl-2 mRNA的表达水平显著降低,差异均具有统计学意义(P<0.05)。而SAEE+模拟剂组Bax、Bcl-2和Caspase-3 mRNA的表达水平与模型组无明显变化,差异无统计学意义(P>0.05)。
表6 各组细胞中Bax、Bcl-2和Caspase-3 mRNA表达的比较(±s)
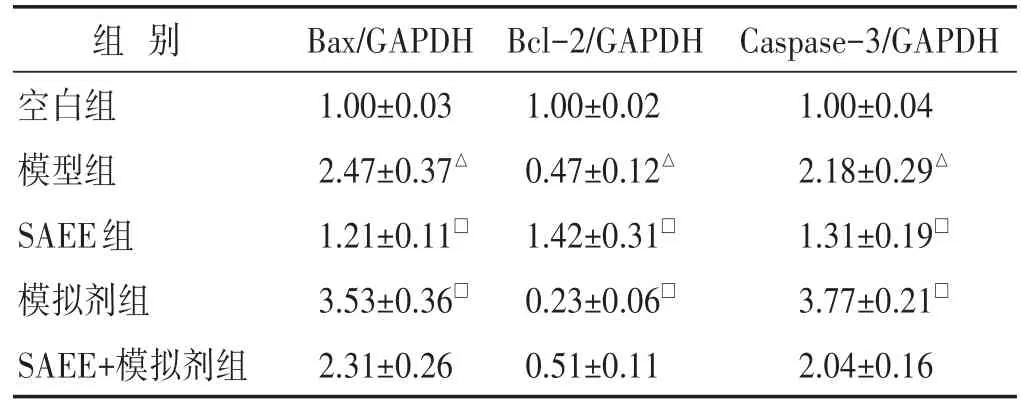
表6 各组细胞中Bax、Bcl-2和Caspase-3 mRNA表达的比较(±s)
组别空白组模型组SAEE组模拟剂组SAEE+模拟剂组Bax/GAPDH 1.00±0.03 2.47±0.37△1.21±0.11□3.53±0.36□2.31±0.26 Bcl-2/GAPDH 1.00±0.02 0.47±0.12△1.42±0.31□0.23±0.06□0.51±0.11 Caspase-3/GAPDH 1.00±0.04 2.18±0.29△1.31±0.19□3.77±0.21□2.04±0.16
3 讨论
血管内皮细胞为紧贴血管内壁的单层细胞,为血液和血管壁的分界细胞,对于维持血管稳态具有重要的作用。在循环因子和炎性因子的诱导下,内皮细胞可出现活化和损伤,从而促进AS的形成[15]。细胞凋亡是细胞在生理或病理条件下激活细胞DNA内切酶活性,从而导致细胞自发性死亡的过程,对于促进生物器官的发育和组织分化的稳定具有重要的意义[16]。有研究发现动脉粥样斑块中内皮细胞凋亡水平增加[17-18]。内皮细胞凋亡导致细胞数量的减少使得内皮通透性增加和完整性的破坏,引起脂质沉积和迁移。在此基础上,平滑肌细胞和单核细胞迁移至动脉内膜,导致血管损伤和斑块形成。此外,越来越多的研究证实内皮细胞凋亡不仅可以促进不稳定型心绞痛、急性冠脉综合征等急性缺血性心脏病的发生,而且还能通过抑制血管再生阻碍血管功能的恢复[19-20]。细胞凋亡是由多种蛋白或细胞因子共同参与的复杂过程,其中促凋亡蛋白(如Bax)与抗凋亡蛋白(如Bcl-2)的平衡对于凋亡的调控具有重要的作用。Caspase-3是Caspase家族最重要的效应型Caspase,一旦Bax的表达上调并促进Bax/Bax同源二聚体的形成,导致线粒体通性增加和细胞色素C的释放,最终激活Caspase-3促进细胞凋亡[21-22]。本研究结果表明,SAEE能够抑制ox-LDL诱导的细胞凋亡,其作用主要是通过抑制Bax/Bcl-2/Caspase-3通路的激活。
MiRNA是一类长度约为18~25 nt的高度保守的非编码RNA,其通过与靶基因3’非翻译区的位点结合促进靶基因mRNA的翻译抑制和降解,从而发挥转录后基因沉默的作用。已有研究证实,miRNA在胆固醇代谢、平滑肌细胞增生和血管内皮细胞炎症和损伤等过程中发挥重要的调控作用。MiR-150是一种和炎症密切相关的miRNA,且与心脑血管疾病的发生密切相关[23]。此外,有临床研究表明,miR-150的表达水平在不稳定型心绞痛和急性心肌梗死患者外周血中显著增高[24]。在本研究中,我们通过ox-LDL诱导构建内皮细胞损伤模型,结果显示模型组中miR-150的表达水平显著增加,而SAEE能够抑制内皮细胞中miR-150的表达水平。通过在SAEE基础上联合miR-150模拟剂结果表明,SAEE对细胞凋亡的抑制作用被显著抵消。因此本结果提示SAEE主要是通过调控miR-150发挥抗凋亡作用的。
我们通过TargetScan网站预测ELK1是miR-150的潜在靶基因。ELK1是ETS结构域转录因子家族的一员,在丝裂原刺激和丝裂原活化蛋白激酶级联反应的基因表达中起关键作用[25]。ELK1具有多种生物学功能,包括调节细胞增殖、细胞周期控制、凋亡和氧化应激[26]。氧化应激是内皮细胞损伤后凋亡的常见诱因,本研究中ox-LDL诱导的内皮细胞损伤模型中氧化应激水平显著增加,ELK1表达水平显著降低。而SAEE能够上调细胞中ELK1的表达水平和SOD活性,降低MDA含量和LDH释放量,从而发挥抗氧化、抑制凋亡的作用。
综上所述,SAEE通过抑制ox-LDL诱导的内皮细胞损伤模型中miR-150的表达,进而上调ELK1的表达水平,从而发挥抗氧化和抑制内皮细胞凋亡的作用。

