miR-223-3P通过抑制NLRP3炎性小体的活化减轻心肌细胞损伤*
赵景宏 刘涛 乔彦 张荣驿 邓建平 王浩宇
(南充市中心医院 1.心内科;2.内分泌科,四川 南充 637000)
心血管疾病(Cardiovascular disease,CVD)是慢性肾脏病(Chronic kidney disease,CKD)最常见的并发症,是慢性肾脏病患者的主要死亡原因。然而,心脏疾病和肾脏疾病相互作用的具体机制仍不清楚[1-4]。硫酸吲哚酚(IS)是一种尿毒症毒素,其在体内的累积与肾功能下降有关。尤其是晚期CKD患者血清中IS水平的增高与患者预后及CVD事件的风险明显相关[5-6]。研究证实IS参与动脉粥样硬化的发生发展,因为它可以通过增强氧化应激导致血管内皮细胞功能紊乱[7]。此外体外研究也显示IS可通过激活丝裂原活化蛋白激酶(MAPK)和NF-kB(Nuclear factor-kappa B)信号通路促进心肌细胞肥大[8-9]。
MicroRNA(miRNA)是一种高度保守的非编码RNA,可通过与靶基因3′-非编码区(3′UTR)特异性结合调节基因表达,导致翻译抑制或靶基因mRNA降解。miRNA已被证实在心血管疾病包括心肌梗死、心肌肥大和心肌缺血再灌注中发挥重要作用[10-13]。然而,由于miRNA可调节多个潜在靶基因,所以许多miRNA在心血管疾病中的作用还有待明确。既往研究表明过表达miR-223-3p可减轻缺血/再灌注诱导的心肌细胞损伤,促进心脏功能的恢复,然而其具体作用机制尚不清楚[14]。本研究探讨miR-223-3p在IS诱导的H9c2细胞中的表达,对细胞活力的影响及其作用机制,以期为心血管疾病的治疗提供新的作用靶点。
1 材料与方法
1.1 细胞培养与H9c2细胞损伤模型的建立 H9c2细胞购自美国菌种保藏中心(Manassas, VA, USA)。H9c2细胞在含有5%CO2和95%潮湿空气环境中培养,室温为37℃。培养基为含有10%胎牛血清(Gibco, Thermo Fisher Scientific, Waltham, MA, USA)、100 μg/mL链霉素和100单位/mL青霉素的DMEM培养基。H9c2细胞损伤模型建立如下:设空白对照组(不作任何处理)和不同浓度IS组(浓度分别为50、100、200、400、800 μmol/L),培养24 h后检测细胞活力。结果表明IS浓度为400 μmol/L时细胞相对活力最接近50%,因此后续实验IS组浓度选择400 μmol/L。
1.2 细胞转染 miR-223-3p mimic, miR-223-3p mimic NC, NLRP3过表达载体pcDNA-NLRP3和空载体NLRP3 NC由GenePharma公司合成 (Shanghai, China)。根据制造商的说明,用转染试剂Lipofectamine 3000(Invitrogen,Carlsbad,CA,USA)将其转染到六孔板中的H9c2细胞。培养6~8 h后,用含有10%FBS的新鲜DMEM替换培养基再进行后续实验。
1.3 CCK8 H9c2细胞以每孔5000个细胞的密度种植在96孔板,适当处理后混合10 μL CCK-8溶液和90 μL无血清DMEM,室温下孵育2 h。根据制造商的说明,用CCK-8法(Shanghai Beyotime Biotechnology, Shanghai, China)测定细胞活力。然后用微孔板读取器在450 nm波长处检测光密度(OD)值。根据不同实验内容进行不同分组,检测IS对细胞活力的影响时分为空白对照组(不作任何处理),阴性对照组(加入生理盐水)和IS组。检测miR-223-3p对细胞活力的影响时分为空白对照组(不作任何处理)、阴性对照组(miR-223-3p NC)和miR-223-3p过表达组(miR-223-3p mimic)。检测NLRP3对细胞活力的影响时分为空白对照组(不作任何处理)、阴性对照组(NLRP3 NC)和NLRP3过表达组(pcDNA-NLRP3)。检测miR-223-3p通过调控NLRP3增强细胞活力时分为空白对照组,阴性对照组(miR-223-3p NC),miR-223-3p过表达组(miR-223-3p mimic)和miR-223-3p过表达+NLRP3过表达组(miR-223-3p mimic+pcDNA-NLRP3)。
1.4 RT-qPCR 使用Trizol试剂(invitrogen; Thermo Fisher Scientific, Inc)从H9c2细胞中提取总RNA,并用nanodrop(nanodrop Technologies; Thermo Fisher Scientific, Inc.)测定RNA浓度。根据制造商的说明使用5X all-in-one rT MasterMix试剂盒(abmgoodchina inc.)将总RNA逆转录为cDNA,然后使用evagreen 2X qPcr MasterMix-low rox试剂盒在aBi 7500PCR检测系统上进行检测。引物序列如下:。2-ΔΔCT法评价基因相对表达水平。miR-223-3P:F: 5′-GTGCAGGGTCCGAGGT-3′,R: 5′-CGGGCT GTCAGTTTGTCA-3′;Caspase-1:F:5′-GCCTTGCC CTCATAATCT-3′, R:5′-ACATCTGGGACTTCTT CG-3′。检测IS对miR-223-3P表达的影响,分组如下:空白对照组(不作任何处理),阴性对照组(加入生理盐水)和IS组。
1.5 Western blot 培养的H9c2细胞在RIPA(Beyotime institute of Biotechnology)裂解缓冲液中裂解,通过BCA法(Beyotime institute of Biotechnology)检测总蛋白浓度。含有50 μg的蛋白样品在6%~10%SDS-PAGE凝胶上电泳分离,再将蛋白转移至聚偏氟乙烯膜上。室温下用5%脱脂牛奶在TBS-0.05% Tween-20溶液中封闭1 h,然后在4℃下加NLRP3一抗(1∶1000稀释;cat. no. ab98151)培养过夜。用PBS液洗涤3次,加二抗孵育2 h。蛋白质的表达用增强化学发光法和Tanon-5200化学发光成像仪进行检测。检测了miR-223-3p对NLRP3蛋白表达的影响,分组如下:空白对照组(不作任何处理)和miR-223-3p过表达组(miR-223-3p mimic)。
1.6 荧光素酶报告分析法 荧光素酶报告质粒psiCHECK- NLRP3-3′-UTR野生型(WT)和psiCHECK- NLRP3-3′-UTR突变型(MUT)由上海基因制药有限公司构建,在NLRP3的3′-UTR中含有野生型和突变型miR-223-3p结合位点,通过Lipofectamine 3000转染到H9c2细胞。24 H后使用Nano-Glo Promega荧光素酶报告系统(Promega, Madison, WI,USA)检测荧光素酶活性。分组如下:阴性对照组(NC,加入生理盐水)和miR-223-3p过表达组(miR-223-3p,转染miR-223-3p mimic)。
1.7 ELISA法 采用酶联免疫吸附法检测H9c2细胞上清液中Caspase-1和IL-1β的表达水平。根据制造商的说明采用Elisa试剂盒(R&D Systems, Minneapolis, MN, USA)进行检测,使用微孔板读取器在450nm处测定OD值。检测miR-223-3p对Caspase-1和IL-1β表达水平的影响时分为空白对照组(不作任何处理),阴性对照组(miR-223-3p无义序列组)和miR-223-3p过表达组(miR-223-3p mimic)。检测NLRP3对caspase-1和IL-1β表达的影响时分为空白对照组(不作任何处理)、阴性对照组(NLRP3 NC)和NLRP3过表达组(pcDNA-NLRP3)。检测miR-223-3p通过NLRP3调控caspase-1和IL-1β表达时分为空白对照组(不作任何处理),阴性对照组(miR-223-3p NC),miR-223-3p过表达组(miR-223-3p mimic)和miR-223-3p过表达+ NLRP3过表达组(miR-223-3p mimic+ pcDNA-NLRP3)。
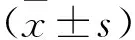
2 结果
2.1 IS对细胞活力的影响 与空白对照组(0.99±0.03)相比,不同浓度的IS(50、100、200、400、800 μmol/L)对H9c2细胞活力均有抑制作用(分别为0.87±0.03、0.79±0.03、0.67±0.04、0.51±0.04、0.43±0.04)。因为IS浓度为400 μmol/L时细胞相对活力最接近50%,故后续选用这个浓度作为H9c2细胞损伤造模浓度,见图1。

图1 IS对细胞活力的影响
2.2 miR-223-3P在各组中的表达 RT-qPCR检测各组H9c2细胞中miR-223-3P表达水平,结果显示和空白对照组(0.98±0.04)及阴性对照组(0.97±0.03)相比,IS组细胞miR-223-3P表达水平明显降低(0.69±0.04),差异有统计学意义(P<0.05),空白对照组和阴性对照组中miR-223-3P表达水平差异无统计学意义(P>0.05),见图2。
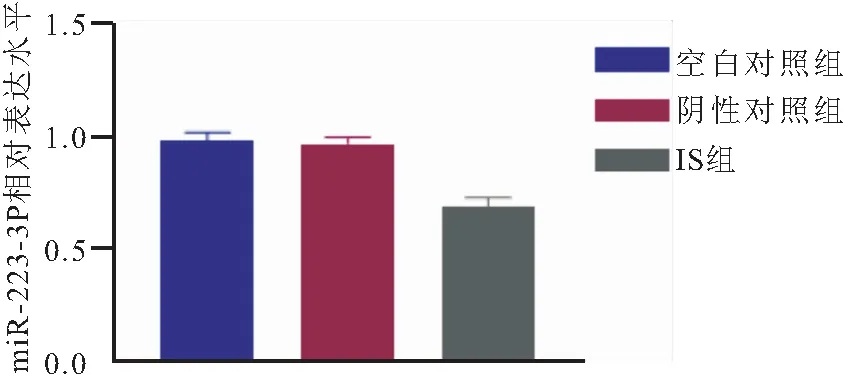
图2 miR-223-3p在各组中的表达水平
2.3 各组细胞中细胞活力表达水平 与空白对照组和阴性对照组相比,IS组中H9c2细胞活力明显降低(分别为0.97±0.03、0.95±0.04、0.52±0.04),差异有统计学意义(P<0.05),见图3。

图3 各组细胞活力水平
2.4 miR-223-3p可靶向结合NLRP3 通过生物信息学数据库Targetscan(http://www.targetscan.org/vert_71/)发现NLRP3存在与miR-223-3p结合位点,进一步通过双荧光素酶实验证实miR-223-3p可与NLRP3靶向结合,见图4、图5。

图4 miR-223-3p与NLRP3结合位点

图5 相对荧光素酶活性测定
2.5 miR-223-3p负调控NLRP3表达 Western blot结果显示,与空白对照组相比,miR-223-3p mimic组中NLRP3蛋白表达水平明显降低(P<0.05),证实miR-223-3p可负调控NLRP3蛋白表达,见图6。

图6 miR-223-3p对NLRP3蛋白表达的影响
2.6 过表达miR-223-3p对细胞活力的影响 将添加IS的H9c2细胞分为空白对照组、阴性对照组(miR-223-3p NC)和miR-223-3p过表达组,CCK8检测细胞活性,结果显示与空白对照组(0.52±0.05)和阴性对照组相比(0.54±0.06),miR-223-3p过表达组(0.71±0.06)细胞活性明显增强,差异有统计学意义(P<0.05),见图7。

图7 miR-223-3p对细胞活力的影响
2.7 过表达miR-223-3p对caspase-1和IL-1β表达的影响 Elisa结果显示,和空白对照组及阴性对照组(miR-223-3p无义序列组)相比,miR-223-3p过表达组中caspase-1和IL-1β表达水平均明显降低(P<0.05),见表1。

表1 各组细胞中caspase-1和IL-1β水平
2.8 过表达NLRP3对细胞活力的影响 将添加IS的H9c2细胞分为空白对照组、阴性对照组(NLRP3 NC)和NLRP3过表达组,细胞活力检测结果显示与空白对照组(0.57±0.08)和阴性对照组相比(0.55±0.06),NLRP3过表达组(0.31±0.05)中H9c2细胞活力明显降低(P<0.05),见图8。

图8 NLRP3对细胞活力的影响
2.9 过表达NLRP3对caspase-1和IL-1β表达的影响 与空白对照组及阴性对照组(NLRP3 NC)相比,过表达NLRP3可明显增强H9c2细胞中caspase-1和IL-1β表达水平(P<0.05),见表2。

表2 各组细胞中caspase-1和IL-1β水平
2.10 miR-223-3p通过调控NLRP3增强细胞活力 与空白对照组(0.50±0.07)和阴性对照组(0.48±0.08)相比,miR-223-3p过表达组(0.70±0.06)中细胞活力明显增强(P<0.05),但是与miR-223-3p过表达组相比,miR-223-3p过表达+ NLRP3过表达组(0.59±0.06)中细胞活力则有所降低(P<0.05),说明miR-223-3p通过抑制NLRP3表达增强细胞活力,见图9。

图9 miR-223-3p通过调控NLRP3增强细胞活力
2.11 miR-223-3p通过调控NLRP3抑制caspase-1和IL-1β表达 与空白对照组和阴性对照组相比,miR-223-3p过表达组中caspase-1和IL-1β表达水平明显降低(P<0.05),但与miR-223-3p过表达组相比,miR-223-3p过表达+ NLRP3过表达组中caspase-1和IL-1β表达水平则有所增高(P<0.05),证实NLRP3可逆转miR-223-3p对caspase-1和IL-1β表达的抑制作用,见表3。

表3 各组细胞中caspase-1和IL-1β水平
3 讨论
有研究[15]表明心血管疾病患者的心血管死亡率和全因死亡率与肾小球滤过率的下降相关,然而慢性肾损害促进心血管疾病发生发展的作用机制非常复杂,因此需要对其机制进行更深入系统的研究。
miRNA在胚胎发育、增殖、血管生成、凋亡、细胞生长、分化和肿瘤发生等多种生物学过程中发挥重要作用。在心血管系统中,miRNA还参与血管生成、心肌细胞收缩、脂质代谢与控制、斑块形成、心律失常和心肌细胞生长[16]。既往研究发现miR-223-3p可减轻缺血/再灌注诱导的心肌损伤,但是其在慢性肾脏病所致心血管疾病中的作用尚未见报道。本研究通过IS建立小鼠心肌H9c2细胞损伤模型,发现与空白对照组和阴性对照组相比,IS组中miR-223-3p表达水平明显降低,但是过表达miR-223-3p可明显增强H9c2细胞活性,减轻IS诱导的细胞损伤,证实miR-223-3p对IS诱导的心肌H9c2细胞的保护作用。
本研究进一步探讨了miR-223-3p发挥心肌细胞保护作用的具体机制。结果显示miR-223-3p可能以NLRP3依赖的方式调控心肌细胞活性。NLRP3炎性小体是一种细胞溶质蛋白复合物,由NLRP3、ASC(apoptosis-associated speck-like protein)和pro-caspase-1组成。NLRP3炎性小体是在一些内源性“危险信号”比如氧化应激、溶媒体失稳和线粒体功能障碍的刺激下组装形成的[17]。研究表明NLRP3炎性小体的激活与多种炎性疾病的发病机制密切相关[18-19],它可通过活化的caspase-1引起多种促炎细胞因子如IL-1β和IL-18的成熟和分泌[20]。而分泌的IL-1β和IL-18可加重炎症,最终导致细胞溶解和细胞焦亡[21]。既往研究证实心肌缺血和心肌损伤常伴有严重的炎症反应[22],作为炎症反应的核心,NLRP3炎性小体被认为是众多炎症性疾病的关键因子,并且有研究证明抑制NLRP3信号通路对冠状动脉结扎引起的心肌缺血和损伤具有保护作用[23]。研究结果表明过表达NLRP3可促进caspase-1和IL-1β表达水平的增高并可导致H9c2细胞活性降低,与既往研究结果相符。结果还发现过表达miR-223-3p可下调caspase-1和IL-1β的表达水平,为验证miR-223-3p是否通过NLRP3炎性小体通路调控细胞活性,进行了功能回复实验,结果显示与空白对照组和阴性对照组相比,miR-223-3p过表达组中细胞活力明显增强,但是与miR-223-3p过表达组相比,miR-223-3p过表达+ NLRP3过表达组中细胞活力则有所降低,说明NLRP3可逆转miR-223-3p对细胞活力的增强作用,发现与miR-223-3p过表达组相比,miR-223-3p过表达+ NLRP3过表达组中caspase-1和IL-1β表达水平则有所增高,证明NLRP3可逆转miR-223-3p对caspase-1和IL-1β表达的抑制作用。上述结果证实miR-223-3p通过负调控NLRP3表达,抑制炎性小体形成并下调caspase-1和IL-1β的表达水平增强细胞活力。
4 结论
本研究结果发现,miR-223-3p在IS诱导的H9c2细胞中的表达水平明显降低,过表达miR-223-3p可明显增强H9c2细胞活力,miR-223-3p可靶向结合NLRP3并负调控NLRP3表达,miR-223-3p可能是通过调控NLRP3抑制caspase-1和IL-1β表达从而增强H9c2细胞活力。本研究对慢性肾疾病相关心肌细胞损伤的病因和治疗提供了新的认识,且加深了心肾相互作用机制的理解。但是本实验只做了细胞层面的研究,还需要开展动物实验加以验证。

