沉默环状RNA_单酰甘油酯酶促进睾丸支持细胞增殖而抑制凋亡*
史圣甲 贾一凡 季兴哲 周梁 张洲
(1.西北妇女儿童医院生殖中心,陕西 西安 710003;2.肿瘤生物学国家重点实验室·空军军医大学免疫学教研室, 陕西 西安710032)
精子发生是一个复杂而协调的过程[1-2],支持细胞是曲细精管中唯一的体细胞,为精子发生通过提供必需的结构、免疫和营养支持[3-4]。支持细胞数目及功能异常将导致精子发生障碍,在临床上多表现为唯支持细胞综合征(Sertoli cell-only syndrome,SCOS)[3,5]。因此,进一步探索支持细胞数目和功能的调控机制,将有助于深入理解精子发生机制,从而推动非梗阻性无精子症的诊疗进展。环状RNA(circular RNA, circRNA)是一类新近发现的内源性非编码RNA[6-7]。大量研究证实circRNA可通过多种机制调控关键基因的表达,在多种疾病的发生及进展中发挥着至关重要的作用[8-9]。然而circRNA在精子发生及成熟中的功能尚不完全清楚。课题组前期文章发现非梗阻性无精子症和梗阻性无精子症患者睾丸组织中存在大量差异表达的circRNA,并通过实时定量聚合酶链反应(RT-qPCR)证实环状_RNA0008045(Circbase ID:has_circ_0008045,circ_MGLL)在非梗阻性无精子症睾丸组织中的表达较梗阻性无精子症升高[10],但具体功能仍待深入探索。因此,本研究进一步评估了circ_MGLL对支持细胞增殖及凋亡的影响,并探索了潜在机制,现将结果报告如下。
1 材料与方法
1.1 实验试剂 睾丸原代支持细胞(CP-H060RNA)及睾丸支持细胞专用完全培养基(CM-H060)购自武汉普诺赛公司。RNA提取试剂盒、细胞计数试剂盒-8(Cell count kit-8,CCK-8)、细胞凋亡试剂盒、细胞周期试剂盒购自北京索莱宝科技有限公司。一步法RT-qPCR试剂盒购自北京康为世纪公司。Lipofectamine 2000购自Thermo Fisher公司,EdU细胞增殖试剂盒、si-circ_MGLL、si-正常对照(Normal control,NC)、miR-NC、miR-1228/miR-1233/miR-149/miR-924类似物(mimics)购自广州锐博生物科技公司。
1.2 实验仪器 NanoDrop紫外分光光度计购自Thermo Fisher公司,流式细胞仪购自Beckman公司,荧光定量PCR仪、多功能酶标仪购自BIORAD公司,荧光显微镜购自OLYMPUS公司。
1.3 方法
1.3.1 细胞转染 将50000个支持细胞铺至6孔板,至细胞汇合度至60%时,取250 μL 无血清培养基+5 μL小干扰RNA(small interfering RNA, siRNA)/miRNA/质粒制备试剂I,取250 μL 无血清培养基+5 μL Lipofectamine 2000制备试剂Ⅱ。将试剂Ⅰ和试剂Ⅱ混合,孵育15 min,而后逐滴滴加至细胞,5 h后更换为完全培养基,48 h后进行后续功能学实验。将转染si-NC的支持细胞命名为si-NC组,转染si-circ_MGLL的支持细胞命名为si-circ_MGLL组。
1.3.2 RNA提取和一步法RT-qPCR 胰酶消化si-NC组或si-circ_MGLL组细胞,1 mL裂解液充分裂解10 min, 1 mL注射器反复抽吸数次。加入200 μL氯仿,震荡15 s,室温放置5 min,4℃、13400 g离心后,吸取水相层。加入1/2体积的乙醇,转移至吸附柱中,4℃、13400 g离心后加入500 μL去蛋白液。4℃、12000 g离心后加入500 μL漂洗液。4℃、13400 g再次离心去除残留试剂,加入20 μL去RNA酶ddH2O,室温放置2 min。4℃、13400 g离心,所得液体即为组织/细胞总RNA,NanoDrop测定RNA纯度与浓度。配制一步法RT-qPCR反应试剂:12.5 μL 2×UltraSYBR Onestep Buffer, circ_MGLL/MGLL或相应对照正义及反义引物各0.5 μL,UltraSYBR Onestep EnzymeMix 0.5 μL,RNA模板1 μL(100 ng),去RNA酶ddH2O补齐至25 μL。震荡混匀后离心,上机检测,PCR反应条件设定为反转录45℃ 10 min,预变性95℃ 5 min,变性95℃ 10 s+退火/延伸62℃ 45 s(35个循环),4℃保存样品至检测结束。GAPDH正义引物:5′-GAAGGTGAAGGTCGGAG TC-3′,反义引物:5′-GAAGATGGTGATGGGATTT CA-3′;circ_MGLL正义引物:5′-GCCTACCTGCTC ATGGAGTT-3′,反义引物:5′-AGACGGCATTCAG CAGTTG-3′;MGLL正义引物:5′-ACAACTTTCAA GGTCCT-3′,反义引物:5′-CGAGAGAGCACGCTG GAG-3′。GAPDH做为内参,相对表达水平计算公式:2-ΔΔct。
1.3.3 细胞计数试剂盒-8(CCK-8)检测细胞增殖速度 将5000个 si-NC组和si-circ_MGLL组细胞铺至96孔板,每组设置8个副孔,共5个96孔板。过夜培养后,两组各取1板,向每孔加入10 μL CCK-8溶液,37℃孵育1 h,酶标仪450 nm记录吸光度值,此时数据为第0天数据。而后每天同一时间两组各取1板细胞,重复上述步骤,获取第1至第4天吸光度值。根据两组吸光度值绘制细胞增殖曲线。
1.3.4 5-乙炔基-2′脱氧尿嘧啶核苷(5-ethynyl-2′-deoxyuridine,EdU)检测增殖细胞 si-NC组和si-circ_MGLL组细胞加入100 μL EdU培养基孵育2 h。1×PBS清洗2次后加入50 μL甘氨酸,摇床孵育5 min。1×PBS清洗2次后加入100 μLApollo染色反应液,室温避光摇床孵育30 min。1×PBS清洗2次后加入TrintonX-100摇床孵育10min。1×PBS清洗2次后加入Hoechst反应液,室温避光摇床孵育30 min。1×PBS清洗2次后,荧光显微镜拍照。
1.3.5 流式细胞术检测细胞的凋亡和周期 收集si-NC组和si-circ_MGLL组细胞,1×PBS清洗3次,1 mL Binding buffer悬浮细胞,调整细胞密度至106/mL。检测细胞凋亡:两组细胞加入5 μL Annexin-V FITC,室温避光孵育10 min,而后加入5 μL PI,室温避光孵育5 min。1×PBS清洗2次,500 μLPBS重悬细胞,上机检测细胞凋亡。检测细胞周期:两组细胞加入70%预冷乙醇500 μL固定,4℃过夜。离心后,400 μL PI染色液混匀,4℃避光孵育30 min。1×PBS清洗2次,500 μL PBS重悬细胞,上机检测细胞周期。
1.3.6 荧光素酶报告基因检测circ_MGLL和miRNAs结合关系 合成circ_MGLL全长序列,对荧光素酶报告载体psiCHECK2质粒进行XhoI和NotI酶切,将circ_MGLL插入psiCHECK2对应位点,所得载体即为Luci-circ_MGLL。当支持细胞密度至70%时,将Luci-circ_CLTLC1与miR-1228/miR-1233/miR-149/miR-924 mimics共转染至支持细胞,根据共转染成分的不同分为五组:Luci-circ_MGLL+miR-NC组、Luci-circ_MGLL+miR-1228组、Luci-circ_MGLL+miR-1233组、Luci-circ_MGLL+miR-149组、Luci-circ_MGLL+miR-924组。48 h后,裂解各组细胞,向细胞裂解液中加入100 μL萤火虫荧光素酶检测试剂,混匀后测定相对荧光强度。而后加入100 μL海肾荧光素酶检测试剂,混匀后多功能酶标仪测定相对荧光强度。根据两次检测荧光强度的比值计算各组相对荧光素强度。
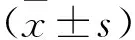
2 结果
2.1 沉默circ_MGLL表达促进支持细胞增殖 RT-qPCR结果显示,si-circ_MGLL可有效沉默支持细胞中呈环状结构circ_MGLL的表达,而对呈线性结构MGLL的表达无影响(P<0.05)(见图1A)。CCK-8结果显示,沉默circ_MGLL表达后,支持细胞增殖速度加快(P<0.05 )(见图1B)。EdU结果显示,沉默circ_MGLL表达后,增殖细胞比例升高(P<0.05)(见图1C、图1D),以上结果提示circ_MGLL抑制支持细胞增殖。
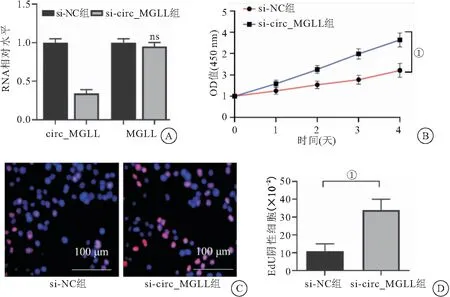
图1 敲降circ_MGLL增强支持细胞增殖
2.2 沉默circ_MGLL表达抑制支持细胞凋亡 流式细胞术结果显示,沉默circ_MGLL表达后,支持细胞凋亡百分比降低(P<0.05)(见图2A、图2B),G1期细胞百分比明显降低,S期细胞百分比明显升高(P<0.05)(见图2C、图2D),以上结果提示circ_MGLL促进支持细胞凋亡,阻滞细胞周期于G1期。

图2 敲降circ_MGLL抑制支持细胞凋亡
2.3 circ_MGLL可结合相关miRNAs MiRanda、Targetsca和RNAhybird网站联合预测circ_MGLL潜在结合的miRNAs (见图3A),结果显示miR-1228、miR-1233、miR-149、miR-924和circ_MGLL具有较高的结合潜能(见图3B)。序列比对分析提示circ_MGLL与miR-1228、miR-1233、miR-149、miR-924存在结合位点(见图3C)。荧光素酶报告基因显示:Luci-circ_MGLL与上述miRNA类似物共转染后,相对荧光强度较miR-NC共转染组明显降低(P<0.05)(见图3D),以上结果提示circ_MGLL可吸附并结合上述miRNAs。

图3 circ_MGLL潜在结合miRNAs
3 讨论
支持细胞可为生殖细胞提供其分化及成熟必需的营养及免疫豁免微环境,其数目和功能异常将导致精子发生障碍[4,11-13]。既往研究已初步证实非编码可通过多种机制影响睾丸支持细胞的数目和功能而调控精子发生[14-16]。如miR-4270通过靶向抑制生长停滞与DNA损伤诱导基因α(Growth arrest and DNA damage inducible alpha,GADD45A)的表达,而抑制人和小鼠支持细胞增殖并促进其凋亡,从而导致精子发生障碍[17]。另有研究[18]发现miR-202在非梗阻性无精子症睾丸组织中表达升高,并抑制细胞增殖和生物合成功能。课题组前期研究也发现circ_0000116在非梗阻性无精子症睾丸组织中表达上调,并可作为竞争性内源性RNA(Competing endogenous RNA,ceRNA)吸附miR-449a而抑制精子发生[19]。因此,进一步鉴定与支持细胞数目与功能相关的非编码RNA,将有助于推动无精子症诊疗进展。
课题组还发现非梗阻性无精子症和梗阻性无精子症患者睾丸组织中存在大量差异表达的circRNA,其中circ_0023313、circ_0008045(circ_MGLL)、circ_00058058在非梗阻性无精子症睾丸组织中表达升高,而circ_0061817、circ_00002023、circ_00008533在非梗阻性无精子症组织中表达下降[10]。其中尚无研究探讨来源于单酰甘油酯酶(MGLL)第7外显子的circ_RNA0008045(Circbase ID:has_circ_0008045,circ_MGLL)在睾丸组织中的表达及功能。因此选取circ_MGLL作为本研究的后续研究对象,结果显示:沉默circ_MGLL的表达将导致支持细胞增殖能力增加、而凋亡水平降低。因此,推测异常升高的circ_MGLL将诱导支持细胞凋亡,而支持细胞数目异常将导致精子发生障碍,这可能是非梗阻性无精子症的发病机制之一。
近年来,研究证实ceRNA机制是circRNA调控相关致病基因表达最常见的一种形式。circRNA可通过吸附并结合相关miRNAs,从而解除miRNAs对下游靶基因转录的抑制,进而参与调控相关疾病的发生及进展[20-21]。为了深入揭示circ_MGLL调控支持细胞增殖和凋亡的机制,本研究初步探索了circ_MGLL是否具有作为ceRNA的潜能。通过三个生物信息学网站[22-24]和荧光素酶报告基因实验,我们发现circ_MGLL可结合miR-1228、miR-1233、miR-149、miR-924。既往研究显示miR-1228在乙二醇甲醚暴露的动物睾丸中表达升高,并与细胞凋亡和分化密切相关[25]。此外,miR-1233可被证实可通过抑制双特异性磷酸酶9(Dual-Specificity Phosphatase 9,DUSP9)的表达而抑制凋亡[26]。研究还发现,miR-149是精子功能的重要调控调控因子,其在人类胚胎早期发育过程中发挥重要功能[27]。因此,circ_MGLL可能通过结合上述miRNAs并抑制其相关功能,从而实现对睾丸支持细胞增殖和凋亡的调控。
本研究仅探索了circ_MGLL在睾丸支持细胞中的表达及功能,尚缺少大样本的无精子症患者睾丸组织标本的验证性实验。此外对circ_MGLL调控支持细胞增殖和凋亡机制的相关探索较为粗浅。尽管发现了一系列凋亡相关miRNAs是circ_MGLL的潜在结合因子,但仍需更深入的研究阐述相关miRNAs是否可介导circ_MGLL对支持细胞增殖和凋亡的调控。
4 结论
本研究结果发现,沉默circ_MGLL表达促进睾丸支持细胞增殖并抑制凋亡,并可吸附结合miR-1228/miR-1233/miR-149/miR-924。本研究初步探索了circ_MGLL对睾丸支持细胞增殖的调控机制,为非梗阻性无精子症提供了潜在的诊疗靶点。

